从红土镍矿湿法废水中回收镁和锰
吴文卫 杜云鹏 吴咪娜 李丽娜 张文杰 李 俊 左 壮
(1.云南省生态环境科学研究院,昆明 650032;2.云南省重金属污染控制工程技术研究中心,昆明 655211;3.中南大学 资源循环研究院,长沙 410083;4.格林美股份有限公司,深圳 518101)
镍作为三元电池材料原料,决定着电池的续航里程,对新能源领域的发展有重要影响[1,2]。红土镍矿作为未来镍的主要来源,高效开发利用至关重要。湿法工艺具有能耗低、绿色环保等优点,是今后处理红土镍矿的主要工艺[3-5]。在高温高压环境中,硫酸选择性浸出红土镍矿中的Ni、Co、Mg、Mn等有价金属,而绝大部分Fe、Al通过水解残留在渣相。逐步调节浸出液pH值,去除大部分杂质离子,最终液相pH值调至7.2~7.8,经沉淀制得中间产品氢氧化镍钴(MHP)[6]。液相中Ni2+、Co2+基本全部沉淀进入固相,Mn2+、Ca2+、Mg2+等离子停留在废水中,给后续处理带来较大压力。
印度尼西亚具有丰富的红土镍矿资源,但原矿中MnO的含量(2%~3%)远高于国内(<1%),湿法工艺产生的废水中Mn含量超过1.5 g/L,高于外排标准(<50 mg/L),需要开发绿色廉价的除锰工艺,提高企业生产的效益,减少污染。目前,去除废水中Mn的主要方法有沉淀法(氢氧化物沉淀、混凝沉淀、铁氧体沉淀)、离子交换法、生物法等[7-9]。由于工业生产中的废水体量大,需要高效快速处理,氢氧化物沉淀法应用的最为普遍。程建国等用石灰调节矿坑废水pH值去除Mn2+,结果表明在废水pH>8.5时开始出现沉淀,pH>10时废水中的Mn基本去除,除锰后的溶液含Mn小于2 mg/L[10]。由于Mn可作为三元动力电池(Ni-Co-Mn)的原料,也具有广阔的应用前景,因此回收红土镍矿浸出废水中的Mn,不仅能提高生产企业的经济效益,还能显著降低废水处理难度。基于此,本文以印尼某新能源材料公司红土镍矿湿法工艺产线的废水为研究对象,根据废水中不同金属离子碳酸盐溶度积的差异,采用先沉淀Mn再沉淀Mg的梯次沉淀工艺,选择性回收废水中的Mn和Mg,提高红土镍矿有价金属的综合利用率。
1 试验
红土镍矿湿法工艺产生的废水初始pH值约7.5,所含金属有Mn、Mg和Ca等,主要金属含量见表1。碳酸钠、碳酸铵、液碱等试剂均为分析纯。CO2气体以钢瓶形式储存,纯度>99%。
碳酸锰、碳酸钙和碳酸镁在20 ℃时的溶度积分别为1.8×10-11、2.8×10-9和3.5×10-8,碳酸盐和氢氧化物不同沉淀理论极端pH值见表2。由表2可知,Ca、Mg和Mn出现碳酸盐的沉淀pH值存在较大差异,可通过控制pH值实现Mn和Mg的初步分离回收。

表2 不同物质的理论沉淀pH值
每次试验在烧杯中进行,试验温度为室温(26 ℃),每次废水用量为500 mL。由于废水初始pH值约7.5,接近中性,需要先通入CO2使溶液pH值适当降低。试验以CO2流量1 L/min通入,在废水pH值降至5时,再滴加NaOH溶液维持溶液pH值在6.0~7.0,反应10~20 min,使溶液中的Mn以MnCO3形式沉淀。过滤后,再向滤液中加入NaCO3,调整溶液pH值,选择性沉淀Mg。
2 结果与讨论
重点讨论CO2调节废水pH值至5左右后,各工艺参数条件对有价金属回收的影响。
2.1 沉淀终点pH值对Mn回收的影响
在CO2气体流量2 L/min、NaOH浓度20%、反应时间30 min的条件下,研究反应终点pH值对废水中有价金属回收的影响,结果如图1所示。
从图1可以看出,随着反应终点pH值的逐渐升高,Ca、Mn和Mg的回收率逐渐升高,固相含Mn量逐渐降低,当溶液pH值约6.6时,Mn的回收率基本平衡,达到99.4%,与极端沉淀理论pH值(表2)基本一致。由于Ca和Mg的回收率也随着溶液pH值的升高而升高,导致最终固相含Mn量随着溶液pH值的降低而降低,影响产品碳酸锰的纯度。综合考虑,最终反应pH值控制在6.6左右,效果最佳,此时对应沉淀后的溶液含Mn量小于5 mg/L。
2.2 沉淀反应时间对Mn回收的影响
在CO2气体流量2 L/min、NaOH浓度20%,控制沉淀反应终点pH值在6.6左右,研究沉淀反应时间对Mn回收的影响,结果如图2所示。
从图2可以看出,随着沉淀反应时间的延长,废水中Ca、Mg和Mn的回收率均先升高后趋于平稳,沉淀反应15 min时,Ca、Mg和Mn的回收率分别为30.25%、7.6%、98.15%,继续延长沉淀反应时间,Mn的回收率升高不明显。当沉淀反应时间较长时,Mg和Ca沉淀率升高,固相中Mg和Ca含量增加,影响碳酸锰的纯度,而且通入的CO2还会持续消耗NaOH,因此从回收效果考虑,控制反应时间为15 min,回收效果最佳,此时对应液相中Mn的含量为6.24 mg/L。
2.3 沉淀pH值调节剂种类对Mn回收的影响
选择性沉淀锰主要通过pH值调节剂控制金属沉淀,因不同碱性调节剂调节效果有较大差异,本文重点研究NaOH、CaO和Na2CO3三种典型碱性pH值调节剂对废水中Mn选择性回收的影响。向废水中分别滴加不同碱性溶液调节沉淀反应pH在6.6左右,反应15 min后过滤,沉淀pH值调节剂对Mn回收的影响试验结果如图3所示。
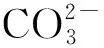
2.4 调节剂 NaOH浓度对Mn回收的影响
向调节废水pH值至5左右的溶液中分别滴加不同浓度的NaOH溶液,控制反应pH值在6.6左右,反应15 min过滤,研究NaOH浓度对Mn回收的影响,结果如图4所示。
从图4可以看出,NaOH浓度不同时,Mn的回收率基本持平,均超过99%,但随着NaOH浓度的增加,固体中Mn的含量有降低趋势,尤其是NaOH浓度超过10%后,下降趋势明显。可能是NaOH浓度过高后,废水中出现局部过碱的情况,导致Ca和Mg也转化成碳酸盐沉淀,使Ca和Mg的回收率增加,沉淀产物杂质含量高。因此,控制废水沉淀pH值调节剂NaOH浓度不超过10%为宜。
2.5 沉淀Mn后溶液回收Mg
选择性沉淀Mn后的废水含Mg约5 g/L、Ca约0.3 g/L,有必要进一步处理废水中Mg,使废水达到外排或循环再用的标准。由表2可知,MgCO3和Mg(OH)2的沉淀pH值均高于CaCO3和CaOH,采用沉淀法回收Mn势必造成溶液中Ca的沉降。由于溶液含Ca较少,考虑采用沉淀法制备MgCO3粗产品,后续再根据需要提升产品纯度。
室温(26 ℃)下,用0.5 mol/L的Na2CO3溶液调节溶液终点pH值沉淀回收废水中的Mg,控制沉淀反应时间20 min,不同终点pH值时,主要成分Ca和Mg的沉降情况见表3。由表3可知,以Na2CO3作调节剂在溶液pH值大于10时,溶液中的Mg和Ca已经很低,沉淀Mg的溶液经过滤后再通入CO2回调溶液pH值至中性即可达到外排标准。

表3 沉淀终点pH值对Mg回收的影响
3 产品质量分析
粗碳酸锰产物的XRD分析结果如图5所示。对最佳沉淀Mn条件下所得初级碳酸锰产品进行扫描电镜(SEM)面扫描和线扫描分析结果分别如图6、图7所示,其中图7中的线扫曲线不代表含量,仅表示元素直接的趋势及相关性。
从图5可以看出,沉淀锰后的产物XRD特征衍射峰为MnCO3和(Mg,Ca)CO3的衍射峰,且MnCO3衍射峰的强度明显较高,说明产物主要为MnCO3,含有少量杂质(Mg,Ca)CO3。由图6可知,该MnCO3产品主金属元素Mn含量较多,与O元素广泛分布,主要杂质元素Ca、Mg、Fe含量较少,且较为分散。由图7可知,产物所含主要元素O和Mn的含量同时升高或降低,呈正相关,其它杂质成分波动较小,进一步证实产物主要成分为MnCO3,可作为粗级MnCO3产品。
4 成本效益估算
红土镍矿湿法工艺相较于火法而言碳排放量可大幅度减少,高压浸出后的浸出废液中添加石灰石中和残酸时会释放大量CO2,可在反应罐顶部收集释放的CO2气体并通过风机鼓入废水,回收废水中的Mn,以此提高红土镍矿企业经济效益。
以印度某产线为例,年产3万吨镍金属,每天废水排放量3.5×104m3,其中废水中Mn的含量为1.8 g/L,以产线每年生产300 d为周期,核算生产初级碳酸锰的经济效益,核算结果见表4。
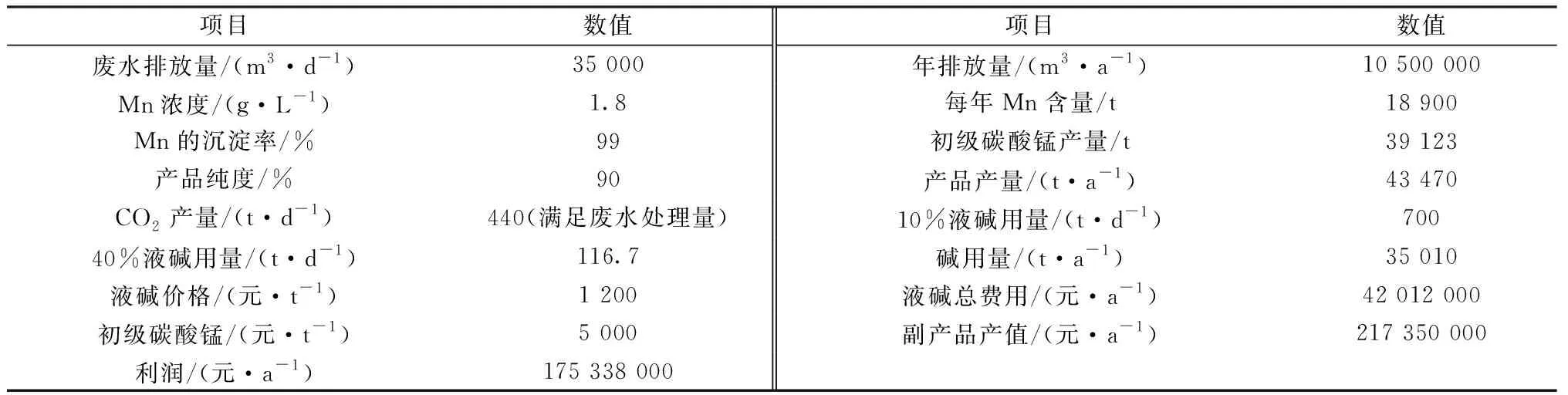
表4 MHP产线废水的处理成本明细
由表4可知,以生产线上沉淀除铁铝工段释放的CO2为调节剂,滴加液碱选择性回收Mn2+生产初级副产品碳酸锰。试剂NaOH消耗为最主要成本,对于电费、人工、设备折旧可忽略,根据试剂的消耗核算,每年回收废水中Mn2+,能创造1.7亿的利润,经济效益好。
5 结论
1)CO2通入废水后,以浓度10%的NaOH作pH值调节剂,在pH=6.6、反应时间15 min的条件下,能使废水中Mn的沉降回收率达到99.4%。制得的初级碳酸锰含量超过90%。
2)以0.5 mol/L碳酸钠继续条件液相pH>10,能进一步回收Mg2+,废水中的Mg基本去除完毕,达到直接外排标准。
3)沉淀的固体样主要以碳酸锰为主,能够作为电解锰车间原料。
4)以30 000吨/年镍金属的产线为例,估算利用CO2+NaOH回收制备碳酸锰的经济效益,年利润可超过1亿元。

