卵泡液外泌体miRNA对颗粒细胞糖酵解途径介导多囊卵巢综合征患者卵泡发育的影响及其作用机制
曹建平,张家宁,单会荃,刘宣,苏杰,崔奎青
广西大学动物科学技术学院亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530000
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是全球育龄女性常见的内分泌疾病,发病率高达10%,主要表现为卵泡发育不良、稀发排卵或无排卵、高雄激素血症等[1]。PCOS 患者不孕率达70%,常伴随2型糖尿病、肥胖、子宫内膜癌等,还广泛存在抑郁、焦虑的情况,严重危害女性身心健康[2]。虽然PCOS 患者的临床表征和生化指标具有极大异质性,但卵泡发育障碍仍是该病的典型特征,影响约10%的不育女性[3]。卵泡液(follicular fluid,FF)提供了卵泡发育的微环境,FF 的改变是卵泡发育障碍的主要原因。FF 内含包括外泌体在内的多种囊泡及分子物质,这些物质间的协调作用可促进卵泡发育和卵子成熟[4]。研究证明,FF中一些核酸和蛋白质与PCOS患者卵泡葡萄糖代谢、脂蛋白代谢、细胞增殖等过程密切相关[5]。因此,FF是PCOS患者卵泡发育障碍相关研究的重要切入点。外泌体可携带及转运包括miRNA在内的非编码RNA 和mRNA[6],在多种体液或细胞培养基上清中稳定存在,且稳定性极强。研究证明,外泌体的RNA构成不同于其分泌细胞,但二者miRNA的表达却高度相似[7]。在癌细胞中,外泌体miRNA是细胞间信息传递和信号交流的重要方式,可参与细胞迁移、细胞分化、免疫应答、抗原提呈、肿瘤侵袭等过程[8]。
能量是卵泡发育的首要条件,研究证明,PCOS患者常伴有葡萄糖代谢异常,颗粒细胞(granulosa cells,GCs)的糖酵解是卵泡发育的主要能量来源[9],GCs的糖酵解产物乳酸是卵泡发育良好的环境刺激,GCs凋亡是PCOS 卵泡闭锁的主要原因[10]。研究证明,FF外泌体主要由GCs分泌,可调节PCOS患者GCs的功能[11]。因此,探讨FF外泌体miRNA 对GCs糖酵解途径导致PCOS 患者卵泡发育的影响,对治疗PCOS具有重要意义。目前,对GCs糖酵解调控因素的研究主要集中在内分泌激素、信号通路、非卵泡液miRNA等[12-14],关于FF 外泌体miRNA 调控GCs 糖酵解的研究较少。本研究通过转录组学方法检测PCOS 及非PCOS不孕患者FF外泌体miRNA的差异,以期为PCOS的治疗提供潜在的新靶点。
1 材料与方法
1.1志愿者招募 于2020 年1— 6 月桂林医学院附属医院生殖中心共招募6名接受体外受精-胚胎移植术(in vitrofertilization-embryo transfer,IVF-ET)的志愿者,包括3名PCOS和3名非PCOS患者。经桂林医学院附属医院伦理委员会批准(批准号:GLMUIA2019021),所有样本均在患者知情同意后获取。PCOS组纳入标准:按《鹿特丹共识(2004)》定义PCOS组表型,确定PCOS组至少满足以下2 种标准:①少排卵和/或无排卵(经期超过35 d或月经次数低于8次/年);②高雄血症体征(循环总睾酮升高超过45 ng/dL或患有多毛症);③卵巢形态超声监测为卵泡超过12 个,但直径均不超过9 mm的多囊特征。排除引起月经过少或体内高雄水平的其他发病原因,如迟发性肾上腺皮质增生和肾上腺雄激素分泌肿瘤。非PCOS组纳入标准:卵巢形态及功能正常、规律的月经周期(26~35 d)、体内雄激素水平正常(<45 ng/dL)、两侧的窦卵泡数为6~10个。共同排除标准:年龄超过35岁,卵巢囊肿及肿瘤、卵巢手术史或放化疗史、子宫内膜异位症、体内泌乳素过高、甲状腺功能异常及染色体异常者;就诊前半年内服用影响体内激素水平或影响糖脂代谢药物者。
1.2药物 人绒毛膜促性腺激素(human chorionic gonadotrophin,hCG)购自珠海丽珠制药集团有限公司。
1.3主要试剂及仪器 QIAGEN exoEasy Maxi kit 购自德国QIAGEN公司;PBS购自生工生物工程(上海)股份有限公司;磷钨酸购自山东西亚化学有限公司;Trizol试剂购自美国Thermo Fisher公司;HiScript ⅢRT SuperMix for qPCR 购自南京诺唯赞生物科技股份有限公司;NEBNext®Poly(A)mRNA Magnetic Isolation Module 购自英国New England Biolabs 公司;RiboZero Magnetic Gold Kit(Human/Mouse/Rat)、NEB Multiplex Small RNA Library Prep Set、TruSeq Rapid SR Cluster Kit及Illumina NextSeq 500 测序仪均购自美国Illumina公司;Agilent 2100 Bioanalyzer购自美国Agilent Technologies Inc。
1.4外泌体样本的采集及鉴定 所有志愿者在促排卵前测定基线激素水平,于黄体期使用短效长方案促排卵,肌内注射hCG(2 000 U)触发36 h后,穿刺取双侧直径>15 mm卵泡的无血清FF,1 500×g离心15 min,取上清,-80 ℃保存。采用QIAGEN exoEasy Maxi kit(超速离心法)提取FF中外泌体,用PBS(预先经0.2µm水相滤膜过滤)溶解外泌体,取20 µL,滴加至铜网上,用2%磷钨酸(pH 5.0)负染60 s,置透射电镜观察外泌体形态。
1.5miRNA 测序 用Trizol试剂提取FF外泌体的总RNA,经1%琼脂糖凝胶电泳和Nanodrop浓度测定仪检测后,构建各样品的文库,用Agilent 2100 Bioanalyzer 测定其质量。混合各样品文库,用0.1 mol/L NaOH 变性成单链DNA,在Illumina flow cell 上捕获原位扩增簇(cluster),按说明书在Illumina NextSeq 500测序仪上进行循环测序,获得的数据为raw sequencing data,经测序质控后,去掉Read 中接头序列和过短序列产生的trimmed data,应用Bowtie 软件将获得的短序列与参考基因组GRCh38进行比对,将组内每百万映射读数(counts per million,CPM)均值≥1的RNA判为在分组中表达,并应用edge R语言包进行组间差异分析,以Fold Change ≥1.5(或≤0.67)且P<0.05的标准筛选差异RNA并进行聚类分析。利用聚类Profiler R包进行差异表达基因(differentially expressed genes,DEGs)的GO 注释分析和KEGG 路径分析;应用Omnipath 数据库对miRNA 进行互作分析。转录组测序由北海康成生物(上海)科技有限公司完成。
1.6qPCR 检测 根据GenBank 中登录的基因序列,应用Oligo 6 软件设计引物,引物序列见表1,由生工生物工程(上海)股份有限公司合成。随机抽取16个miRNA,采用Trizol 试剂提取所有外泌体样本的RNA,经HiScriptⅢRT SuperMix for qPCR 试剂盒逆转录为cDNA,并以其为模板进行PCR扩增。PCR扩增条件为:95 ℃5 min;60 ℃10 s,95 ℃30 s,共40个循环;溶解曲线:65 ℃5 s,以0.5 ℃梯度递增至95 ℃。以U6为内参,采用比较Ct法计算基因表达水平。
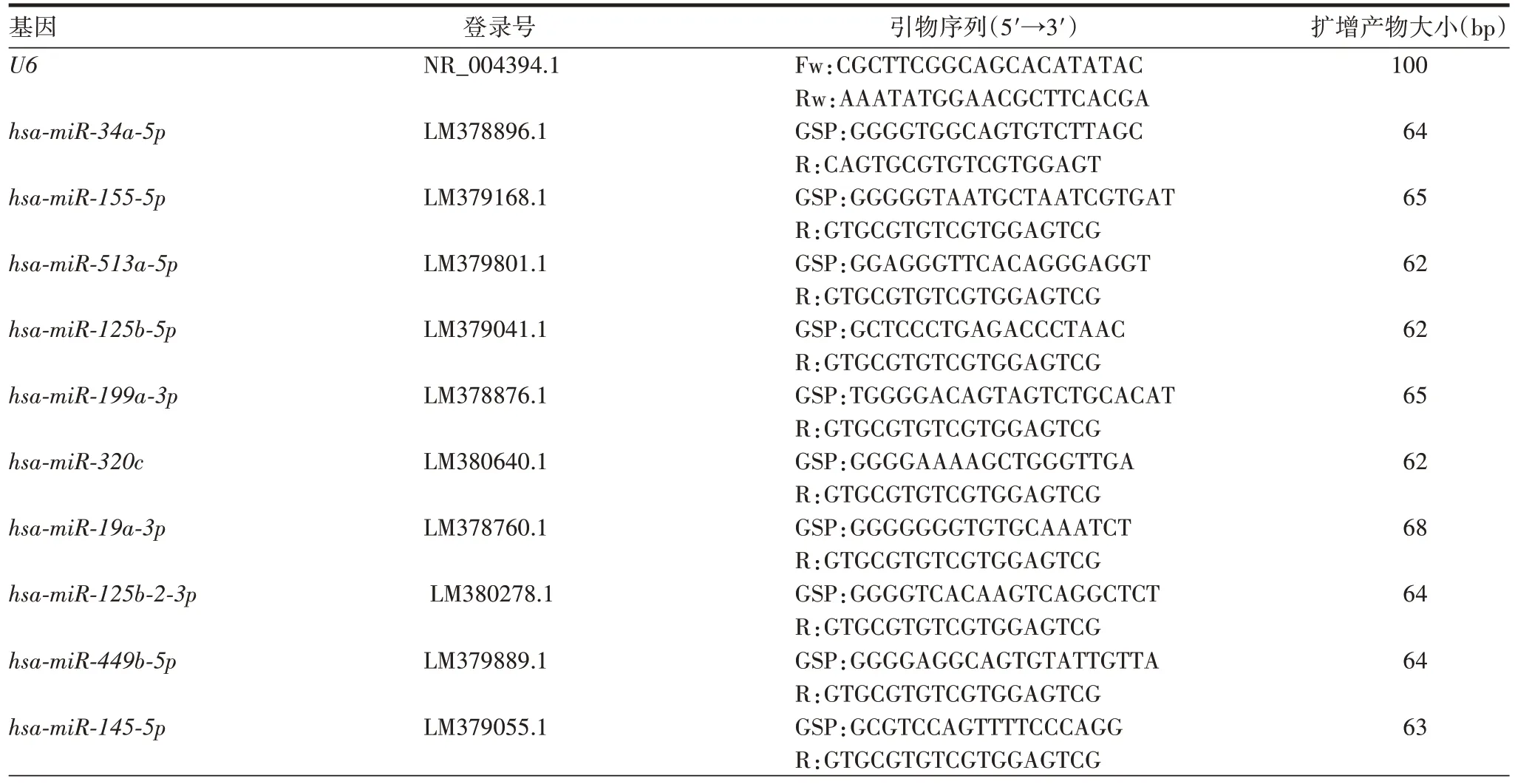
表1 qPCR检测的引物序列信息Tab.1 Primer sequences for qPCR
1.7统计学分析 应用GraphPad Prism 8.0、IBM SPSS Statiatics 26或bioinformatics软件(http://www.bioinformatics.com.cn/)进行数据分析,所有数据均以均数± 标准差(x±s)表示,组间及组内比较采用无配对检验或单因素方差分析,随后采用Bonferroni事后检验,以P<0.05为差异有统计学意义。
2 结果
2.1临床表征差异 志愿者促排卵前基线激素水平检测结果表明,PCOS组与非PCOS组志愿者的年龄、不孕年限、身体质量指数(body mass index,BMI)、促卵泡生成素(follicle-stimulating hormone,FSH)、催乳素(prolactin,PRL)、孕酮(progesterone,P)、空腹血糖等指标差异均无统计学意义(t=0.163 ~1.681,P均>0.05),PCOS组的黄体生成素(luteinizing hormone,LH)、抗缪勒管激素(anti-Mullerian hormone,AMH)、睾酮(testosterone)、窦卵泡数显著高于非PCOS组(t=2.479 ~9.163,P均<0.05),见图1。表明纳入的志愿者符合本研究的分组要求。

图1 PCOS组与非PCOS组志愿者各项临床指标的比值Fig. 1 Ratios of clinical indexes between PCOS group and non-PCOS group
2.2FF外泌体的鉴定 透射电镜观察结果显示,2组FF 外泌体边缘均清晰,中央淡染的杯口状囊泡,直径为100~150 nm,结构完整,符合外泌体特征,见图2。外泌体浓度约为8×1010particles/mL。

图2 FF外泌体形态的透射电镜观察Fig. 2 Transmission electron microscopy images of FF exosomes
2.3miRNA转录组差异分析 共获得56 023 668个raw sequencing data,>94.54%的碱基质量得分超过Q30,trimmed reads与参考基因组比对率约为60%,共发现928个miRNA。与非PCOS组比较,PCOS组外泌体中共筛选出59个差异miRNA(DEmiRNA),其中31个上调,28个下调,见图3。为验证转录组数据可靠性,随机抽取16个miRNA 进行qPCR 检测,结果表明,基因表达差异趋势与miRNA 测序结果高度相似,证明miRNA 测序数据可靠,见表2。上述结果表明,与非PCOS组比较,PCOS组外泌体转录谱发生显著改变。

图3 差异表达miRNA的热图Fig.3 Heat map of differentially expressed miRNAs
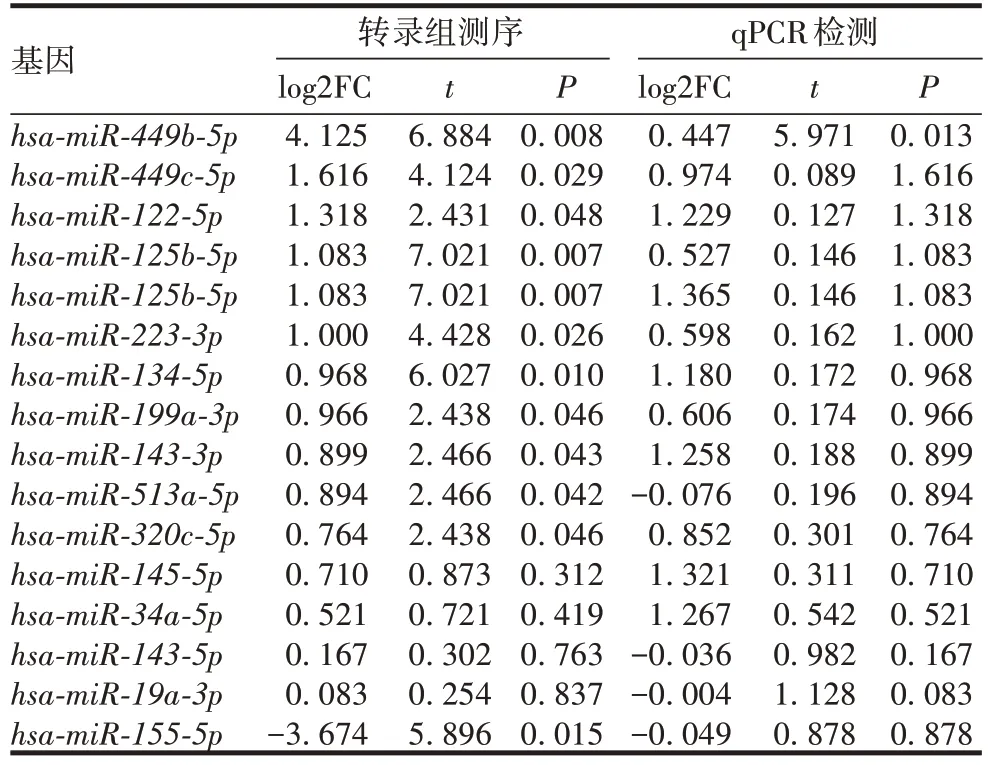
表2 miRNA测序与qPCR检测结果的对比Tab.2 Comparison of miRNA sequencing and qPCR results
2.4DEmiRNA 的GO 注释分析及KEGG 路径分析GO 注释分析结果表明,与非PCOS 组比较,PCOS 组外泌体DEmiRNA 对糖酵解的负调节显著上升,对葡萄糖的输入和响应、蛋白激酶合成与活性、ATP 酶活性等与糖酵解和能量代谢有关过程的正调节均显著下降,见图4。KEGG路径分析结果表明,在DEmiRNA调控的KEGG路径中存在缺氧诱导因子-1、胰岛素抵抗、卵母细胞减数分裂、坏死性凋亡等与细胞凋亡有关的显著差异通路,见图5。上述结果表明,在PCOS患者FF 外泌体中,通过miRNA 调控mRNA,可显著改变GCs糖酵解效率和细胞凋亡状态。

图4 外泌体转录组DEmiRNA的GO注释分析Fig. 4 GO annotation analysis of DEmiRNAs in exosomal transcriptome

图5 外泌体转录组DEmiRNA的KEGG路径分析Fig.5 KEGG pathway analysis of DEmiRNAs in exosomal transcriptome
2.5miRNA 候选靶基因调控网络的生物信息 通过miRNA 互作网络分析发现,PKM、PFKL、HK2是miRNA 调节GCs 糖酵解的关键靶基因,SLC2A1是miRNA调节GCs凋亡的关键靶基因,见图6。这些关键靶基因构成了FF 外泌体miRNA 调控GCs 生物学过程的重要靶点。

图6 miRNA的互作网络分析Fig.6 Interaction network analysis of miRNAs
3 讨论
本研究提取了2 组志愿者的FF 外泌体,并进行质量鉴定,外泌体转录组测序分析结果表明,PCOS患者FF外泌体miRNA可通过PKM、PFKL、HK2和SLC2A1等关键基因抑制GCs 糖酵解,并促进其凋亡,可减少糖酵解过程中产生ATP,降低终产物乳酸产量,最终造成卵泡发育障碍。
外泌体是经胞吐方式由组织或器官内各种细胞分泌的一种细胞外囊泡[15],外泌体在透射电镜下呈杯口状,直径为30~200 nm[16-17],本研究对FF 外泌体的鉴定结果与上述一致。外泌体中含有大量miRNA等物质,miRNA 通过外泌体在细胞间转移,从而发挥不同功能[18-19]。外泌体miRNA 在肿瘤发生发展中调节作用的相关研究较多,如乳腺癌细胞系释放的外泌体miR-105可降低内皮细胞中zo-1基因的表达,从而促进肿瘤转移[20-22]。本研究结果表明,外泌体miRNA可调控GCs摄取葡萄糖、糖酵解、蛋白激酶合成、ATP合成、细胞凋亡等生物学过程,这些生物学过程均与GCs 的糖酵解途径密切相关。多项研究证明,外泌体miRNA 通过控制糖酵解关键酶的表达来调控瓦氏效应细胞糖酵解[23-25],PCOS 患者的GCs 为一种瓦氏效应细胞,因此推断,外泌体miRNA在GCs的糖酵解途径中发挥重要作用。在PCOS中,FF外泌体miRNA可抑制GCs 的糖酵解关键酶活性,糖酵解整体水平下调,糖酵解过程ATP 产生减少,导致卵泡发育的能量供应不足,这是介导PCOS卵泡发育障碍的首要因素。糖酵解代谢产物乳酸水平是衡量瓦氏效应细胞代谢水平的标志[26]。研究发现,PCOS 患者的卵泡发育需要高浓度的乳酸刺激[27]。本研究结果表明,外泌体miRNA通过沉默GCs的糖酵解导致乳酸水平下降,减弱了卵泡发育的环境刺激,这是介导PCOS 卵泡发育障碍的另一重要因素。
PCOS 长期困扰女性的身心健康,卵泡发育障碍是PCOS 患者最显著的特征,也是导致PCOS 患者不孕的重要因素。本研究揭示了FF 外泌体miRNA 调节GCs 糖酵解介导PCOS 卵泡发育障碍的机制,为PCOS 患者卵泡发育障碍的分子机制研究提供了实验依据,也为该病的治疗提供潜在的新靶点。

