奥利司他联合达英-35治疗肥胖型多囊卵巢综合征疗效及对患者血清性激素水平的影响
李 珍,乔鹏艳,康丽荣
(山西省妇幼保健院,山西 太原 030013)
多囊卵巢综合征(Polycystic ovary syndrome,PCOS)近年来被诸多女性熟知,其作为以内分泌紊乱为主的综合征,以20~40岁的年轻女性最为多见,发病率为5%~10%[1]。患者多伴有异常血糖和血脂代谢、高雄激素血症、高胰岛素血症、胰岛素抵抗、卵巢体积过大、优势卵泡体积增加、慢性无排卵及月经不规律等症状,临床表现为肥胖、月经失调、多毛和青春痘等,其中有40%~60% PCOS患者体重指数(BMI)超过28 kg/m2表现为肥胖[2-3]。有研究[4]指出,肥胖可增加胰岛素抵抗作用,从而诱发机体代偿分泌过多胰岛素,造成脂肪异常代谢以增加肥胖发生。近年来,临床常口服避孕药治疗PCOS患者,应用最广泛的短效避孕药达英-35是通过降低卵巢源性雄激素作用而调节机体内分泌紊乱,但对于肥胖型PCOS患者的疗效不理想,提示单一药物作用局限,无法有效改善肥胖型PCOS患者胰岛素抵抗和糖代谢异常症状[5-6]。于是学者开始关注奥利司他和二甲双胍,其中奥利司他通过与脂肪酶结合抑制胃肠道脂肪酶的活性,降低机体吸收和利用食物中脂肪,从而降低血脂水平[7];而二甲双胍则是通过调动机体组织对葡萄糖的转化与利用,从而可降低血糖水平,两种药物均能有效减重并改善胰岛素抵抗[8-9]。基于此,本研究将奥利司他和二甲双胍分别联合口服避孕药达英-35治疗肥胖型PCOS患者,观察两种药物的治疗效果及对性激素、血脂、身体状况等影响,为临床诊疗提供可靠依据,现将结果及结论报告如下。
1 资料与方法
1.1 一般资料 本研究经山西省妇幼保健院妇伦理会批准,患者对本研究知情后,于2019年6月至2022年12月选取PCOS患者138例肥胖型纳入本次研究,按非随机临床同期对照研究及患者自愿原则分为A组和B组各69例。其中A组年龄20~36岁,平均(27.76±3.42)岁;病程1~8年,平均(4.53±1.02)年;不孕时长2~6年,平均(3.04±0.78)年;初潮年龄11~17岁,平均(13.95±1.56)岁;BMI 28~33 kg/m2,平均(29.37±1.18)kg/m2。B组年龄21~34岁,平均(26.45±2.76)岁;病程2~8年,平均(4.68±1.17)年;不孕时长1~6年,平均(3.18±0.66)年;初潮年龄13~16岁,平均(14.09±1.05)岁;BMI 27~33 kg/m2,平均(29.31±1.20)kg/m2。两组患者一般资料比较无统计学意义(均P>0.05),同期可比。诊断标准:PCOS的诊断标准参考2003年Rotterdaln国际会议所达成的共识[10],经抽血内分泌检查及超声影像学检测存在以下症状任意两项即可确诊:月经停止、稀发或无规律;表现为多毛、肥胖、青春痘和高血糖等;单或双侧卵巢中直径为2~9 mm的卵泡存在12个及12个以上,及(或)卵巢体积不小于10 cm3。当确诊的PCOS患者BMI>28 kg/m2时判定为肥胖型[11]。病例纳入标准:符合PCOS标准且BMI 28~33 kg/m2者;年龄20~36岁,病程1~8年,未采取任何避孕措施的情况下不孕时间超过1年者;患者胰岛素抵抗指数(HOMA-IR)≥2.69;未接受过与研究相关疾病治疗者;未服用性激素以及免疫调节剂者;无脏器疾病;肝肾功能正常;无精神异常;生命体征平稳无危重症,且能配合临床完成相关诊治及检查工作;无交流障碍。排除标准:患其他内分泌紊乱疾病者;合并其他卵巢疾病者;对奥利司他、二甲双胍和达英-35等治疗药物有过敏反应者;心、肺、肝、肾存在功能疾病或肿瘤者;糖尿病、血液性疾病及自身免疫性疾病者;近期服用激素类药物者;临床资料缺失者。
1.2 治疗方法 两组患者均调整饮食结构以低盐和纤维素为主,减少高糖和高脂食物摄入,增加适量减重运动,保持健康生活方式,同时给予口服避孕药治疗;用药时机约在月经来潮或停用激素药物治疗后出血第5天,口服达英-35(国药准字J20140114),于睡前服用1 片,1 次/d,连续服用21 d后停药7 d。A组在此基础上联合奥利司他治疗,餐后30 min口服奥利司他胶囊(国药准字H20123210,规格:0.12 g/颗)l 颗/次,2次/d。B组联合盐酸二甲双胍缓释片(国药准字H20093098,规格:0.5 g/片)口服,l 片/次,2次/d,均于餐后30 min服用,均治疗3个月经周期。两组患者于第3个月的月经来潮第5天口服来曲唑片(国药准字H20213428,规格:2.5 mg/片)2片/次,1 次/d,连续服用5 d,第10 天肌注注射用尿促性素(国药准字H20033042,规格:75 U/支)75~150 U/次,1 次/d,经超声检测显示子宫黏膜厚度≥8 mm,并且卵巢中发育最好的卵泡直径≥18 mm时,肌注人绒毛膜促性腺激素(规格:22.8 U/支)10000 U/次,并于1~2 d内进行同房。需要注意的是在患者治疗的同时还应对卵泡数量及直径进行超声监测,若治疗中途出现明显不良症状,需考虑停止用药并予以针对性措施,待患者症状改善后再继续疗程。
1.3 观察指标
1.3.1 临床疗效指标:对比两组患者治疗后的临床疗效,具体如下[12],连续3个月的月经周期规律,经期出血量、性激素水平和糖脂代谢完全恢复正常,排卵正常为显效;月经周期逐渐规律,经期出血量、性激素水平和糖脂代谢有所改善,可排卵为有效;月经无规律,经期出血量、性激素水平和糖脂代谢异常,无排卵为无效。总有效率=(有效+显效)例数/总例数×100%。
1.3.2 血清性激素水平:对比两组患者治疗前后促卵泡激素(FSH)、促黄体生成素(LH)、雌二醇(E2)、总睾酮(TT)、游离睾酮(FT)水平。分别采集治疗前和治疗3个月经周期后的月经第2~5 天空腹静脉血5 ml于促凝管中,2000 r/min离心20 min收集血清并-80 ℃保存。借助全自动血细胞分析仪检测FSH、LH、E2、TT和FT水平。
1.3.3 血糖代谢水平:对比两组患者治疗前后空腹血糖(FPG)、餐后2 h血糖(2 hPG)、空腹胰岛素(FINS)和HOMA-IR[13]水平。采用上述血清和方法检测FPG、2 hPG和FINS水平,计算HOMA-IR。HOMA-IR=[FPG(mmol/L)×FINS(mIU/L)]/22.5。
1.3.4 血脂代谢水平:对比两组患者治疗前后甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)水平。采用上述血清和方法检测TG、TC、HDL-C和LDL-C水平。
1.3.5 肥胖形态学指标:对比两组患者治疗前后体质量(BW)、腰围(WC)、臀围(HC)变化。测量并记录BW、WC和HC数值。
1.3.6 妊娠及症状表现情况:对比两组患者治疗结束后妊娠及症状表现情况。定期随访和动态监测卵子成熟率、临床妊娠率、流产率、月经改善率和卵巢多囊样变改善率,本次随访结果截至2023年5月31日。
1.3.7 不良反应发生情况:记录两组患者治疗期间不良反应发生例数,以(发热、呕吐、腹泻、头痛)发生例数/总例数来计算总发生率,评估两组用药安全性。
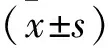
2 结 果
2.1 两组患者临床疗效对比 A组临床总有效率为88.41%,与B组72.46%相比,差异统计学有意义(P<0.05),见表1。

表1 两组患者临床疗效对比[例(%)]
2.2 两组患者治疗前后血清性激素水平对比 治疗后两组FSH、LH、E2、TT和FT水平均显著降低(均P<0.05),但治疗后两组各指标相比差异无统计学意义(均P>0.05),见表2。
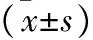
表2 两组患者治疗前后血清性激素水平对比
2.3 两组患者治疗前后血糖代谢水平对比 治疗后两组FPG、2 hPG、FINS、HOMA-IR均显著降低(均P<0.05),但治疗后两组各指标相比差异无统计学意义(均P>0.05),见表3。
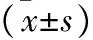
表3 两组患者治疗前后血糖代谢水平对比
2.4 两组患者治疗前后血脂代谢水平对比 治疗后两组TG、TC、LDL-C水平均显著降低,HDL-C显著升高(均P<0.05);治疗后A组TG、TC低于B组,HDL-C高于B组(均P<0.05),但LDL-C比较差异无统计学意义(P>0.05)。见表4。
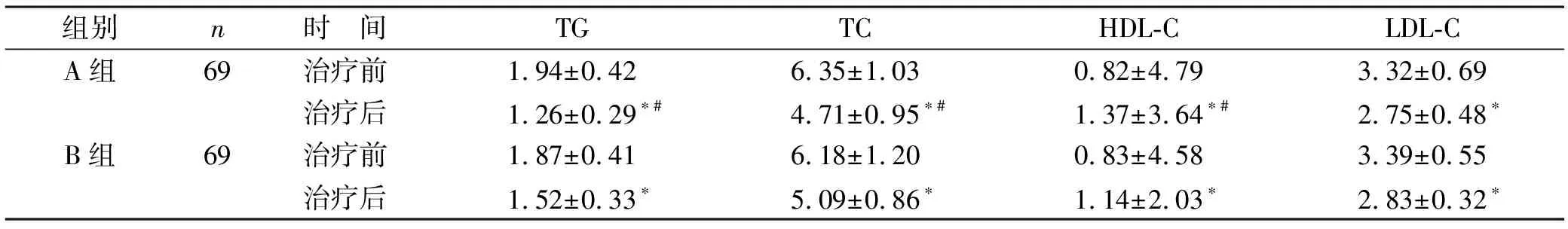
表4 两组患者治疗前后血脂代谢水平对比(mmol/L)
2.5 两组患者治疗前后肥胖形态学指标对比 治疗后两组患者BW、WC和HC与治疗前相比均显著降低(均P<0.05);治疗后A组与B组相比BW更小(P<0.05),而WC和HC比较差异无统计学意义(均P>0.05)。见表5。
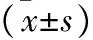
表5 两组患者治疗前后肥胖形态学指标对比
2.6 两组患者治疗后妊娠及症状表现情况对比 观察组卵子成熟率为65.22%,对照组卵子成熟率为62.32%,两组相比差异无统计学意义(P>0.05),且两组临床妊娠率、流产率、月经改善率及卵巢多囊样变改善率相比差异也无统计学意义(均P>0.05),见表6。
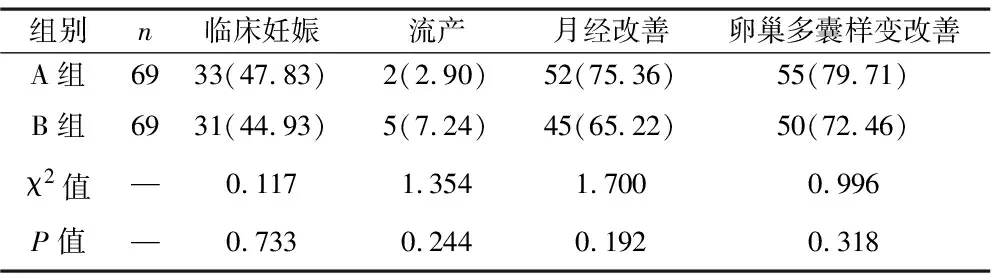
表6 两组患者妊娠及症状表现情况对比[例(%)]
2.7 两组患者治疗期间不良反应发生情况对比 A组不良反应总发生率为5.80%低于B组的17.39%,两组比较差异有统计学意义(P<0.05),见表7。
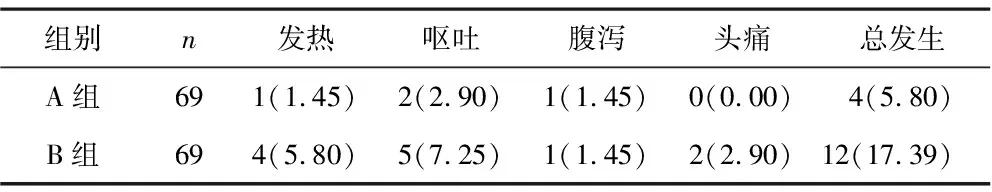
表7 两组患者治疗期间不良反应发生情况对比[例(%)]
3 讨 论
PCOS是导致20~40岁育龄女性不孕的常见因素之一,患者发生肥胖、月经失调、多毛等症状的同时还会增加高雄激素血症、胰岛素抵抗、慢性无排卵等其他并发症,是由于垂体分泌过多的激素使得内分泌系统发生紊乱,卵巢受刺激多囊样变,诱发不孕,正是因为合并以上因素,使得临床在治疗该疾病时会存在一定的困难[14-15]。而肥胖型PCOS作为其中较为多见的一种类型,患者发生胰岛素抵抗的概率更大,极易诱发机体代偿分泌过多胰岛素影响机体糖脂代谢水平,而且肥胖还可促使卵巢分泌过多内源性雄激素促使脂肪细胞体积增大且易沉积于内脏,从而降低机体脂肪代谢活性加重肥胖症状,如此往复循环最终导致PCOS患者病情加剧,因此关于该疾病的治疗已成为国内外学者的重要研究难点之一[16]。此外众多学者认为PCOS可能与月经紊乱、肥胖、排卵异常等因素息息相关,且因体内雄性激素升高,所以患者易出现脂代谢、骨代谢紊乱等现象,目前临床针对于该疾病的治疗需根据PCOS患者主诉、生理需求及机体代谢情况,需给予肥胖型PCOS患者抑制LH分泌、降低T和FSH水平等调节机体内分泌紊乱的治疗,同时给予降低胰岛素抵抗、调节糖脂代谢水平的针对性治疗[17-18]。并对患者采用饮食控制、功能锻炼等综合方案,达到缓解临床症状、调整月经周期、提高受孕率及改善生命质量的目的。
短效避孕药达英-35又称炔雌醇环丙孕酮片,是治疗PCOS的常见药物,具有降低雄激素、提高卵巢敏感性、改善子宫内膜等作用,抑制内膜增生的同时又可改善紊乱的经期、经量、经色和经质等,从而增加PCOS患者卵子成熟率和临床妊娠率,但无法改善PCOS患者表现的胰岛素抵抗症状,且会加重PCOS患者糖代谢异常[19-20]。而奥利司他通过与胃和肠道的脂肪酶特异性结合抑制脂肪酶活性,进而阻碍食物中脂肪转化为机体可吸收的甘油和脂肪酸,阻碍脂肪吸收以调节脂代谢水平;二甲双胍通过阻碍肠道吸收葡萄糖,促进机体中糖原转化为二氧化碳、水和丙酮酸等以调节糖代谢水平[21-23]。已有研究将奥利司他和二甲双胍运用于PCOS患者治疗中,结果表明奥利司他能有效降低BIM并抑制内源性雄性激素的生成,二甲双胍能有效减轻临床症状并改善胰岛素抵抗作用,两者均能达到减重的效果[24]。但目前关于两者分别联合口服避孕药达英-35对肥胖型PCOS患者治疗效果的对比研究较少,临床治疗药物选择上尚未形成统一标准。本次研究比较奥利司他和二甲双胍分别联合达英-35治疗,结果显示,奥利司他相比于二甲双胍联合达英-35治疗肥胖型PCOS患者有更好的临床疗效,卵子成熟率、临床妊娠率、月经改善率和卵巢多囊样变改善率均更高,但差异无统计学意义,可能与两者疗效相当有关,亦可能与本研究随访期较短(大部分患者仍在随访中)有关。同时,两种药物治疗均能显著降低患者FSH、LH、E2、TT、FT、FPG、2 hPG、FINS、TG、TC和LDL-C水平,降低了HOMA-IR、BW、WC和HC,提高HDL-C,提示奥利司他和二甲双胍均能改善患者血清性激素水平和糖脂代谢水平,降低肥胖形态学指标;而奥利司他联合组与二甲双胍联合组相比TG和TC水平及BW显著更低,HDL-C显著更高,说明奥利司他在调节血脂代谢水平和降低肥胖形态学指标方面更优于二甲双胍联合组,这是因为奥利司他主要通过抑制机体吸收和利用脂肪以降低血脂发挥作用,机体热量摄入减少达到减重效果[25],但其具体机制有待进一步探究。此外,两种药物治疗患者出现不良反应的概率相比,以A 组更低,说明两种治疗方案具有较高安全性,但奥利司他更具优势。但本研究还存在局限性,如未对不同年龄范围的患者用药效果进行深入研究,加上随访期限较短,对患者长久预后未进行统计分析,有待后期补充论证。
综上所述,相比于二甲双胍,奥利司他联合达英-35可以更好地降低肥胖型PCOS患者血脂代谢水平和肥胖形态学指标,但相关结论仍需多中心研究及延长随访期后论证。

