动脉灌注化疗联合细胞因子诱导杀伤细胞治疗晚期卵巢癌疗效及对患者血清癌胚抗原、糖类抗原125、可溶性B7-H4蛋白水平的影响
王 静,张虹宇,张 磊,赵仰光,王 健
(1.天津市肿瘤医院,天津 300060;2.秦皇岛市第四医院,河北 秦皇岛 066000;3.河北医科大学第三医院妇产科,河北 石家庄 050000)
卵巢癌是导致妇女死亡的常见恶性肿瘤之一,其病死率居首位,约75%以上的卵巢癌患者在就诊时已属晚期[1-3]。目前,临床上对于晚期卵巢癌多先行标准肿瘤细胞减灭术+术后静脉化疗(铂类或紫杉醇药物)为主的一线治疗方式,尚不能对所有患者产生最佳疗效,且存在明显不良反应[4-5]。近年来,随着介入技术的发展,动脉灌注化疗及栓塞术以其良好效果在临床上得到了高度重视[6-7]。由于髂内动脉是妇科恶性肿瘤的血供主要来源,若将化疗药物自髂内动脉内直接注入,或可影响其所供应的靶器官使化疗药物发挥最大的抗癌生物效应,使局部化疗药物的高浓度,全身低浓度,若于化疗基础上联合细胞因子诱导的杀伤细胞(Cytokine induced killers,CIK)即可重建机体免疫系统,直接或间接杀伤肿瘤细胞,使抗肿瘤效果、肿瘤细胞耐药性显著提升[8]。血清肿瘤标志物癌胚抗原(Carcino embryonic antigen,CEA)、糖类抗原125(Carbohydrate antigen 125,CA125)是上皮来源的恶性肿瘤的血清标志物,可用于诊断卵巢癌并评估其恶性程度,临床中应用广泛[9-10]。可溶性B7-H4蛋白(soluble B7-H4 protein,sB7-H4)是T细胞共抑制分子,可与T细胞上表达的未知受体相互作用对T细胞的免疫应答产生抑制,引发肿瘤免疫逃逸,与肿瘤进展密切相关[11]。基于此,本研究探讨动脉灌注化疗联合CIK治疗晚期卵巢癌的临床疗效及对患者血清CEA、CA125、sB7-H4水平的影响。
1 资料与方法
1.1 一般资料 选取2019年1月至2020年6月本院收治的103例晚期卵巢癌患者为研究对象。病例纳入标准:①经病理检查确诊且符合相关诊断标准[12];②FIGO分期为Ⅲ-Ⅳ期;③生存期超6个月;④卡式功能状态(KPS)评分>90分;⑤本次试验内容均告知患者和其家属,且阅读并签署知情同意书。排除标准:①认知和精神障碍者;②伴有严重心、肝、肾功能障碍者;③合并其他恶性肿瘤者;④化疗禁忌证者。按入院顺序分为两组,对照组(n=52)行动脉灌注化疗,观察组(n=51)行动脉灌注化疗联合CIK治疗。对照组年龄45~73岁,平均(54.27±6.63)岁;FIGO分期:Ⅲ期34例,Ⅳ期17例;病理类型:浆液性癌、黏液性癌各18例,子宫内膜样癌16例。观察组年龄46~74岁,平均(54.30±6.71)岁;FIGO分期:Ⅲ期31例,Ⅳ期20例;病理类型:浆液性癌16例,黏液性癌、子宫内膜样癌各19例。两组患者年龄、FIGO分期、病理类型等一般资料对比,无统计学差异(均P>0.05)。
1.2 治疗方法
1.2.1 动脉灌注化疗:两组在治疗期间均予以水化、利尿、止吐等治疗,先实施肿瘤细胞减灭术,对照组在此基础上行动脉灌注化疗,于髂内动脉起始部,采用5号半或7号针头行穿刺,再将稀释后卡铂或顺铂(顺铂70~90 mg或卡铂300~500 mg+阿霉素30~50 mg,环磷酰胺600~800 mg)自每侧髂内动脉灌注30 ml,推药时间10~30 min。
1.2.2 CIK治疗:于化疗前1 d取外周血50 ml抗凝、离心后取单个核细胞,调整细胞密度,以RPMI -1640培养基培养,先加入干扰素-γ(INF-γ)培养1 d,再加入CD3单抗和白细胞介素-2(IL-2),3 d更换1次培养基,于6 d后取CIK,行免疫学检查(CD3+、CD56+T细胞比例≥50%,CD3+、CD8+T细胞比例≥30%,真菌、细菌等培养显示阴性),将CIK与含1%人血清蛋白的0.9%氯化钠溶液混匀,在化疗结束后第7天输注患者体内,1次/d,连续输注5 d,疗程间隔4周,总6~8个疗程。
1.3 观察指标 ①临床疗效:完全缓解为化疗后4周内未发现明显肿瘤病变;部分缓解为化疗后4周内残留肿瘤病灶最大垂直径和直径减少超过50%,且没有其他新病灶出现;稳定为肿瘤病灶最大垂直径、直径缩小或增加不超过50%,且未有其他新病灶出现;进展为肿瘤病灶最大垂直径和直径增加超过25%,或者有新病灶;总有效=完全缓解+部分缓解。②卵巢血流参数:治疗前后采用彩色超声仪(深圳恩普公司,型号EMP-3000,探头频率4~9 MHz)进行卵巢血流检测,测定搏动指数(PI)、阻力指数(RI)、收缩期峰值流速(PSV),3次测量取平均值。③血清指标:于治疗前及治疗后收集患者5 ml外周静脉血,进行5 min的3000 r/min离心,将上层血清放置在-80 ℃中,酶联免疫吸附法(ELISA)检测CEA、CA125、sB7-H4水平,试剂盒购自上海美轩生物科技有限公司(货号MEXN-H0609、MEXN-H0603、MHB002)。④记录不良反应发生情况及随访3年生存率,不良反应分级标准参考 WHO《抗癌药物常见不良反应分级标准》制定。
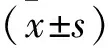
2 结 果
2.1 两组患者临床疗效比较 观察组总有效患者45例,对照组总有效患者32例,观察组有效率88.23%高于对照组的61.54%(P<0.05),见表1。
2.2 两组患者卵巢血流参数比较 两组治疗前卵巢血流参数对比,无统计学差异(均P>0.05),治疗后PI、RI值观察组较对照组升高,RSV值较对照组下降(均P<0.05),见表2。
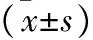
表2 两组患者卵巢血流参数比较
2.3 两组患者血清CEA、CA125、sB7-H4水平比较 两组治疗前血清CEA、CA125、sB7-H4水平比对,无统计学差异(均P>0.05),治疗后观察组血清CEA、CA125、sB7-H4水平较对照组下降(均P<0.05),见表3。
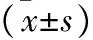
表3 两组患者血清CEA、CA125、sB7-H4水平比较
2.4 两组患者不良反应发生情况比较 两组骨髓抑制、发热、肾功能损伤、肝功能损伤等,各组不良反应发生率比较,差异有统计学意义(P<0.05),见表4。
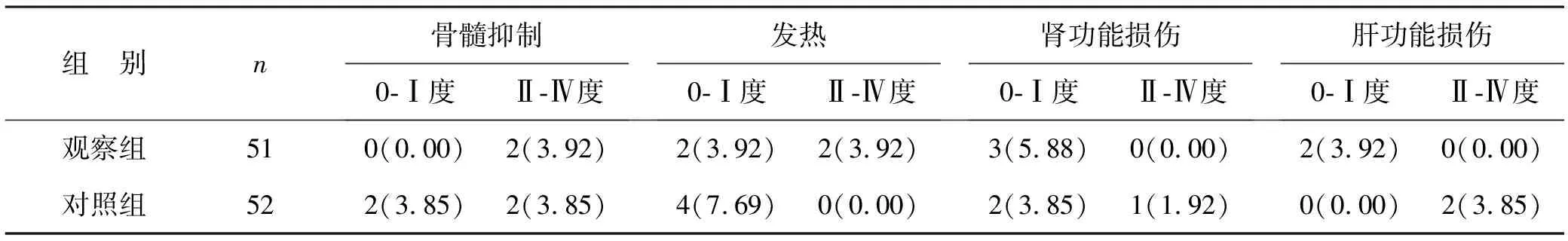
表4 两组患者不良反应发生情况比较[例(%)]
2.5 两组生存率比较 随访3年,观察组3年生存率为78.43%(40/51)高于对照组的57.69%(30/52)(χ2=5.086,P<0.05)。
3 讨 论
卵巢癌在女性生殖器癌中发病率占第3位,但病死率居首位,卵巢癌的发病早期(I期)常无明显临床症状,发现时多已为晚期(Ⅲ、Ⅳ期)预后较差,且晚期肿瘤微环境处于免疫抑制状态,免疫抑制作用强,促进肿瘤逃逸,初次肿瘤细胞减灭术治疗效果有限[13-14]。张军宪等[15]报道了,药物对肿瘤细胞的杀伤力与其血药浓度呈正相关,相较于静脉化疗、腹腔化疗,动脉化疗药物“首过效应”疗效可增强超20倍,增加一定范围内局部药物浓度,特别对于顺铂等浓度依赖型药物,更能充分起作用。CIK细胞是以单核细胞为基础,以细胞因子诱导培养处理后获得一群NK样T细胞,其增殖速度快、抑瘤活性高,对于多重耐药肿瘤细胞也较为敏感,细胞实验表明,CIK细胞可诱导卵巢癌耐药株细胞凋亡,使耐药基因表达下降,耐药细胞免疫原性提升,对卵巢癌耐药细胞株的杀伤作用强,且其与化疗联合可产生协同抗肿瘤效应[16]。
本研究结果显示,观察组有效率88.23%高于对照组的61.54%,说明动脉灌注化疗联合CIK提高化疗药物的抗肿瘤效果。盆腔内生殖器以及其他组织多由髂内动脉予以血液供应,直接经髂内动脉化疗目的性强,能减少药物与血浆蛋白的结合时间,提高肿瘤区域游离药物的浓度高及其对癌细胞的杀灭作用[17]。双侧髂内动脉灌注化疗使盆腔脏器的血流灌注提升,并以高浓度的化疗药物减少肿瘤细胞的增殖。而联合CIK治疗,因其有T淋巴细胞的抗肿瘤活性,NK细胞的非MHC限制性杀瘤特点,杀瘤谱更广,输注CIK后,不损伤机体免疫系统结构和功能,可对肿瘤细胞进行直接杀伤,调节和增强机体的免疫功能,增强化疗效果[18]。卵巢血流动力指标中PI能反映血管壁弹性变化,RI能反映被测血管远端阻力,PSV可反映血液流通速度[19-20]。本研究表明,治疗后观察组PI、RI高于对照组,RSV低于对照组,可见测定卵巢血流状态有利于评估疾病,卵巢恶性肿瘤会明显影响卵巢血供。与付小玲等[21]研究较为一致。
血清肿瘤标志物CEA、CA125和sB7-H4检测结果显示,治疗后观察组血清CEA、CA125、sB7-H4水平较对照组下降,这主要由于动脉灌注化疗对残留癌细胞的凋亡和分解作用,进一步抑制了残留癌细胞扩增,癌细胞膜表面CEA、CA125等的释放降低。而sB7-H4过表达会促进卵巢上皮细胞恶性转化,提高肿瘤细胞的增殖和黏附能力,动脉灌注化疗后,降低了癌细胞的增殖活性,故sB7-H4水平降低。于文亮[22]发现,卵巢癌患者血清中ROBO4的含量降低、sB7-H4的含量升高;血清中ROBO4、sB7-H4含量的变化与肿瘤临床病理分期改变、癌基因异常表达均密切相关。赵姝娟等[23]研究发现,在卵巢癌影像学表现出异常时,如:边界不清、形态不规则、壁结节、腹膜转移和淋巴结转移等,血清CEA水平将会显著升高。JOHNSON等[24]认为,Ⅳ期卵巢癌患者中CA125水平阳性率>90%,但其早期升高程度不明显,而在其他一些妇科良性肿瘤或恶性肿瘤中CA125水平会呈现一定程度增加,检测时需注意诊断和鉴别。此外,化疗药物在杀灭癌细胞时,也会对正常细胞造成刺激,引起不良反应症状。本研究中不良反应发生率和3年生存率与李阿利等[25]的研究结果一致,说明动脉灌注化疗联合CIK治疗卵巢癌安全有效。
综上所述,卵巢癌患者行髂内动脉灌注化疗和CIK联合治疗是一种安全、有效的治疗手段,但对于化疗中药物的使用及剂量大小仍需进一步研究,以确定选择最优药物和制定最佳治疗方案。

