基于熵权法和灰色关联度结合成分分析优选人参提取物抗氧化活性最佳极性部位
徐志佳,李胜楠,周文文,肖凤琴,刘 晖,杨亦柳,李光哲,*,严铭铭,2,*
(1.长春中医药大学,吉林长春 130117;2.吉林省中药保健食品科技创新中心,吉林长春 130117)
人参(Panax ginsengC.A.Meyer)是五加科、人参属植物,具有大补元气,复脉固脱,补脾益肺,生津养血,安神益智之功效[1]。现代研究表明人参有多种药理作用,包括调节血压、促进和调节免疫功能、调节脂类物质代谢、抗氧化、延缓衰老等[2]。人参营养丰富,富含多种活性物质,其中包括人参皂苷Rb1、Re、Rd、Rg1 等多种皂苷、多糖类等有效成分[3]。
近年来研究发现人参是一种天然抗氧化剂的优良来源[4],Yu 等[5]发现人参皂苷Re 可通过减轻氧化应激抑制大鼠心肌损伤,改善心功能不全。人参皂苷Rg1、Rb1、Re 可通过调节红细胞核因子相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)、血红素氧合酶1(hemeoxygenase-1,HO-1)蛋白表达、JNK 通路来抑制氧化应激作用[6-7]。赵雨初等[8]通过研究人参总皂苷对H2O2诱导的红细胞氧化应激作用机制发现人参总皂苷能够帮助恢复细胞内氧化平衡,抑制H2O2诱导的红细胞氧化应激。此外,人参具有药食两用的特点[9-10],有研究报道以人参多糖和人参提取物为主要原料的功能性食品具有抗氧化、防衰老、保护皮肤等效果[11-12]。
因此,本研究利用液-液萃取法将人参水提取物分为石油醚部位(R1)、氯仿部位(R2)、乙酸乙酯部位(R3)、正丁醇部位(R4)、水部位(R),应用灰色关联分析[13]结合熵权法[14]对人参不同极性部位的7 种组分含量、5 个体外抗氧化活性质量特性指标赋权并建立相关性分析,科学优选人参抗氧化最佳极性部位并评价活性与成分间的关系,以期从人参提取物中初步筛选天然抗氧化剂部位,为开发研究人参功能性食品提供原料及理论依据。
1 材料与方法
1.1 材料与仪器
人参药材 购自于长春中医药大学附属医院,批号:20 220815;石油醚、三氯甲烷、乙酸乙酯、正丁醇、过硫酸钾、三氯乙酸 分析纯,北京化工厂;人参皂苷Rg1(批号:C27N11Q132589)、人参皂苷Re(批号:J25GB152733)、人参皂苷Rb1(批号:G01O11 Y126429)标准品,均购于上海源叶生物科技有限公司;没食子酸(批号:110831-200302)、芦丁(批号:100080-200707)标准品,均购于中国药品生物制剂所;DPPH、ABTS 购于上海麦克林生化科技有限公司;DME/F-12 1:1(1X)培养基、FBS(胎牛血清)、P/S(青链霉素双抗溶液)、0.25%胰蛋白酶溶液、二甲基亚砜、1×PBS(磷酸盐缓冲液)均购于美国Gibco 公司;人神经母细胞瘤细胞(SH-SY5Y)购于武汉普诺赛生命科技有限公司。
AB265-S 十万分之一分析天平 瑞士METTLER TOLEDO 公司;CP223C 电子天平 美国奥豪斯仪器有限公司;KQ-250B 型超声波清洗器 昆山市超声仪器有限公司;HH-6 数显恒温水浴锅 金坛市佳美仪器有限公司;DZF-6053 真空干燥箱 上海一恒科学仪器有限公司;DZTW 电子调温电热套北京市光明医疗仪器有限公司;UV-1700 紫外分光光度计 日本SHIMADZU 公司;Infinite M200PRO型全自动酶标仪 瑞士Tecan 公司;3131 型细胞培养箱CO2培养箱 美国Thermo 公司。
1.2 实验方法
1.2.1 人参提取物不同极性部位获取 将干燥人参样品破碎过筛(20 目),称量人参50 g,置于圆底烧瓶内,加入10 倍量蒸馏水,加热回流提取2 h,过滤,再向滤渣中加入10 倍量蒸馏水,回流提取2 h,过滤。合并两次提取液,将提取液浓缩至50 mL。依次使用石油醚、三氯甲烷、乙酸乙酯、正丁醇以萃取溶剂与浓缩液体积比为1:1 进行萃取,萃取3 次,合并同部位萃取液,回收溶剂,干燥,即得。
1.2.2 人参提取物不同极性部位抗氧化活性研究
1.2.2.1 人参提取物不同极性部位对超氧阴离子清除能力 采用邻苯三酚自氧化法[15]。Tris-HCl(50 mmol/L pH=8.2)和邻苯三酚溶液(浓度为6 mmol/L)于25 ℃预热20 min。在96 孔板中加入150 μL Tris-HCl、30 μL 样品溶液、30 μL 预热过的邻苯三酚,25 ℃保温4 min,加20 μL 浓盐酸,于420 nm 处测定吸光度值A1。以蒸馏水替代样品溶液所测得吸光度值作为A0。以蒸馏水代替邻苯三酚作为空白对照组A2。按下式计算超氧阴离子的清除率。
1.2.2.2 人参提取物不同极性部位对羟基自由基清除能力 采用水杨酸法测定对羟基自由基的作用[16],取96 孔板,每孔分别加入50 μL 样品、50 μL 硫酸亚铁溶液(6 mmol/L)、50 μL 过氧化氢(6 mmol/L),于37 ℃恒温加热10 min 后加入50 μL水杨酸(6 mmol/L),于37 ℃恒温加热30 min 后在510 nm 处测定吸光度值A1。以蒸馏水代替样品液,测定吸光度值A0;以1 mL 蒸馏水代替过氧化氢溶液,测定吸光度值A2。按下式计算羟基自由基清除率。
1.2.2.3 人参提取物不同极性部位对DPPH 自由基清除能力 参照乐婷等[17]的实验方法,略有改动。在96 孔板中,每孔加入100 μL 样品水溶液,100 μL DPPH 溶液,于暗室反应30 min,在517 nm 处测定吸光度值A1;以甲醇代替DPPH 溶液作为样品对照组,测定吸光度值A2;以蒸馏水代替样品液作为空白对照组,测定吸光度值A0。按下式计算DPPH 自由基的清除率。
1.2.2.4 人参提取物不同极性部位对ABTS+自由基清除能力 ABTS+自由基清除率测定:参照文培华等[18]的实验方法,有所改动。ABTS+自由基清除能力由下式计算。
A1:样品+ABTS+溶液吸光度值,A0:PBS 溶液+ABTS+溶液吸光度值。
1.2.2.5 人参提取物不同极性部位对H2O2诱导的SH-SY5Y 细胞氧化损伤的保护能力 参考于婧文等[19]方法,略有改动。采用DME/F-12 1:1 培养基(10% FBS,1% P/S)培养SH-SY5Y 细胞,并取对数生长期的SH-SY5Y 细胞以5×103个/孔均匀接种于96 孔板中,待细胞贴壁70%~80%后,弃去培养液,用人参不同极性部位对细胞预保护6 h,再与250 μmol/mL H2O2共同作用于SH-SY5Y 细胞株24 h 后,在显微镜下观察细胞形态并采用CCK-8 法检测细胞活力,观察人参不同极性部位对H2O2损伤SH-SY5Y 细胞的保护作用。其中,空白组为细胞+培养基;模型组为细胞+培养基+H2O2溶液;给药组为细胞+培养基+样品+H2O2溶液。
式中,ODs:细胞+培养基+CCK-8+样品或H2O2溶液吸光度值;ODc:细胞+培养基+CCK-8;ODb:培养基+CCK-8+样品或H2O2溶液吸光度值。
1.2.3 人参提取物不同极性部位活性成分测定
1.2.3.1 人参皂苷Re、Rb1、Rg1 测定 对照品溶液制备:参考2020 年版《中国药典》一部人参项下含量测定的方法[20],精密称取人参皂苷Re、Rb1、Rg1 对照品,加甲醇制成浓度(Cs)为每1 mL 含0.2 mg 对照品的混合溶液。
供试品溶液制备:精密称取人参提取物1 g(W),放入具塞锥形瓶中,精密量取50 mL(V)色谱甲醇加入锥形瓶中,超声处理30 min 后,补重,用0.22 μm微孔膜过滤,既得供试品溶液。
液相色谱条件:以十八烷基硅烷键合硅胶为填充剂,以乙腈为流动相A,水为流动相B 进行梯度洗脱,检测波长为203 nm:0~35 min:流动相A:19%,流动相B:81%;35~55 min:流动相A:19%~29%,流动相B:81%~71%;55~70 min:流动相A:29%,流动相B:71%;70~100 min:流动相A:29%~40%,流动相B:71%~60%。
样品测定:采用高效液相色谱法(HPLC)测定样品中人参皂苷Re、Rb1、Rg1 含量。分别精密吸取对照品溶液10 μL(Vs)与供试品溶液10~20 μL(Vi),注入液相色谱仪测定,测得对照品峰面积(As),供试品峰面积(Ai)。
式中,Ci:供试品浓度,mg/mL;Vi:供试品进样量,μl;Ai:供试品峰面积;Cs:对照品浓度,mg/mL;Vs:对照品进样量,μL;As:对照品峰面积;V:供试品体积,mL;W:精密称取提取物质量,g。
1.2.3.2 总多糖测定 参照牛晓方等[21]方法,以葡萄糖为标准品,制备得回归方程为y=7.2892x+0.0398(R2=0.9998),以此计算样品各极性部位中总多糖含量(xt)。
式中,y:吸光度值,xt:测定得总多糖含量,mg;D:稀释倍数;W:样品取样量,g。
1.2.3.3 总皂苷测定 参考刘瑞等[22]的方法,以人参皂苷Re 为标准品,制备得回归方程为y=4.4292x-0.01(R2=0.9973),以此计算样品各极性部位中总皂苷含量(xg)。
式中,y:吸光度值,xg:测定得总皂苷含量,mg;D:稀释倍数,W:样品取样量,g。
1.2.3.4 总黄酮测定 参考华晶忠等[23]方法,以芦丁为标准品,制备得回归方程为y=3.3694x-0.0737(R2=0.9993),以此计算样品各极性部位中总黄酮含量(xh)。
式中,y:吸光度值,xh:测定得总黄酮含量,mg;D:稀释倍数,W:样品取样量,g。
1.2.3.5 总酚酸测定 参考何峰等[24]的方法,以没食子酸为标准品,制备得回归方程为y=12.082x+0.0059(R2=0.9998),以此计算样品各极性部位中总酚酸含量(xs)。
式中,y:吸光度值,xs:测定得总酚酸含量,mg;D:稀释倍数,W:样品取样量,g。
1.2.4 熵权法 假设给定了n 个样本,k 个指标,本研究中n=5,k=12。由此组成单元序列{Xij}(i=1、2、3......n;j=1、2、3......k),对原始数据进行标准化处理。
1.2.4.1 数据标准化处理 按下列公式对12 个指标的原始数据标准化处理。
若为正向指标,则
若为负向指标,则
式中,Yij:标准化处理后数据;Xij:原始数据,第i 个样品第j 个指标值。
1.2.4.2 各指标的信息熵
根据信息熵(Ej)的定义,信息熵的计算公式:
Pij=Yij/∑Yij,若pij=0,则lnpij=0。确定各指标信息熵后,计算各指标权重(Wi),计算公式为:
式中,Ei:样品第i 个指标的信息熵。
1.2.5 灰色关联度分析
1.2.5.1 原始数据规格化处理 由于各评价指标间数据差异较大,故对原始数据进行规格化处理。处理公式:
式中,Yik:第i 个样本第k 个指标的规格化处理后数据,Xik:第i 个样本第k 个指标的原始数据,Xk:样品第k 个指标的均值。
1.2.5.2 关联系数计算 按下列公式计算相对最优参考序列{Ysk}和最差参考序列{Ytk}关联系数。
式中,Δmin=min|Yik-Ysk|;Δmax=max|Yik-Ysk|。
式中,Δmin=min|Yik-Ytk|;Δmax=max|Yik-Ytk|;ρ:分辨系数,本研究以1.2.4.2 项下公式计算所得指标权重(Wi)为该系数取值。
1.2.5.3 关联度计算 按下列公式计算相对于最优参考序列ri(s)和最差参考序列ri(t)关联度。
1.2.5.4 相对关联度计算 相对关联度ri与最优和最差参考序列关联度密切相关,按下列公式计算:
根据n 个样品相对关联度大小排序,最终为优劣评价结果。
1.3 数据处理
采用Excel 2021 版进行数据处理,SPSS 23.0 软件进行统计学分析及LSD 多重比较,以P<0.05(双侧)为差异有统计学意义,所有试验进行3 次重复。应用Matlab R2016b 进行权重计算和灰色关联度分析。
2 结果与分析
2.1 人参提取物不同极性部位抗氧化能力
2.1.1 人参提取物不同极性部位对超氧阴离子清除能力 提取物不同极性萃取物对超氧阴离子清除能力见图1、表1,在实验浓度范围内,随着浓度不断增加,各部位对超氧阴离子清除能力大大增强。清除超氧阴离子的IC50值分别为1.15 mg/mL(R)、1.27 mg/mL(R1)、1.29 mg/mL(R2)、1.17 mg/mL(R3)、0.75 mg/mL(R4)。结果表明R4 的超氧阴离子清除能力相对最强,这可能是因为在人参正丁醇部位中总酚酸、总皂苷、总黄酮类化学物质成分含量较高,超氧阴离子可与其很好的结合,因此对超氧阴离子的清除能力较强。该结果与何紫艳[25]关于人参皂苷元体外抗氧化活性研究结果一致。
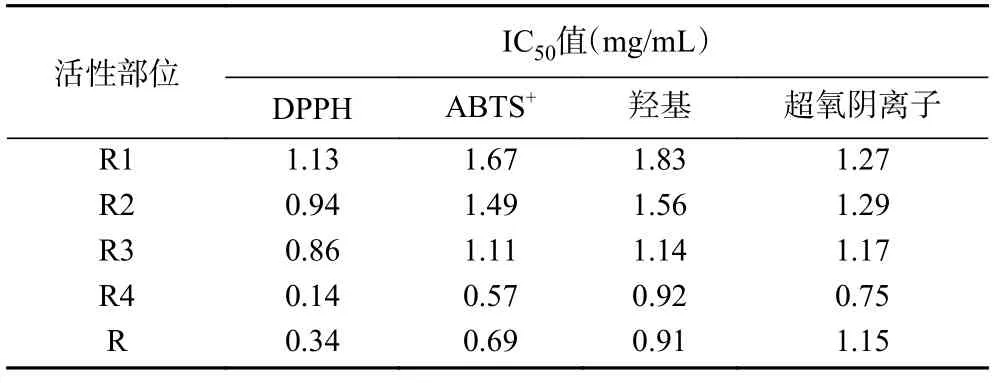
表1 人参不同极性部位对各自由基的IC50 值结果Table 1 Resuits of IC50 of free radicals at different polarity sites of ginseng

图1 人参提取物不同极性部位的超氧阴离子自由基清除率Fig.1 Superoxide anion free radical clearance rates of different polar parts of ginseng extract
2.1.2 人参提取物不同极性部位对羟基自由基清除能力 人参不同极性部位对羟基自由基的清除率结果如图2、表1 所示,人参各部位都具有羟基自由基清除能力,且随着浓度的增加,各部位对羟基自由基清除能力不断增强。清除羟基自由基的IC50值分别为0.91 mg/mL(R)、1.83 mg/mL(R1)、1.56 mg/mL(R2)、1.14 mg/mL(R3)、0.92 mg/mL(R4)。结果表明R 的羟基自由基清除能力相对最强,该结果可能与人参各部位中的总多糖、总黄酮类等成分具有活泼的酚羟基,在遇到活性氧自由基时,易失去酚羟基上的氢,具有直接清除羟基自由基、H2O2等活性氧、自由基的作用有关[26]。

图2 人参提取物不同极性部位的羟基自由基清除率Fig.2 Hydroxyl free radical clearance rates of different polar parts of ginseng extract
2.1.3 人参提取物不同极性部位对DPPH 自由基清除能力 人参不同极性部位对DPPH 自由基的清除率结果如图3、表1 所示,人参各部位都具有明显的DPPH 自由基清除能力,且在实验浓度范围内,随着浓度的增加,各部位对DPPH 自由基清除能力逐渐增强。清除DPPH 自由基的IC50值分别为0.34 mg/mL(R)、1.13 mg/mL(R1)、0.94 mg/mL(R2)、0.86 mg/mL(R3)、0.14 mg/mL(R4)。结果表明R4 的DPPH 自由基清除能力相对最强,这可能是因为在人参正丁醇部位中总酚酸、总皂苷、总黄酮类能与自由基发生化学反应,干扰自由基链式反应发生,从而产生抗氧化作用[27]。

图3 人参提取物不同极性部位的DPPH 自由基清除率Fig.3 DPPH free radical clearance rates of different polar parts of ginseng extract
2.1.4 人参提取物不同极性部位对ABTS+自由基清除能力 人参提取物不同极性部位对ABTS+自由基的清除率结果如图4、表1 所示。人参各部位都具有明显的ABTS+自由基清除能力,在实验浓度范围内,随浓度增加各部位对ABTS+自由基清除能力不断增强。清除ABTS+自由基的IC50值分别为0.69 mg/mL(R)、1.67 mg/mL(R1)、1.49 mg/mL(R2)、1.11 mg/mL(R3)、0.57 mg/mL(R4)。结果表明R4的ABTS+自由基清除能力相对最强,说明人参正丁醇部位具有非常好的ABTS+自由基清除活性,该结果与刘士伟[28]利用植物乳杆菌发酵人参中活性成分抗氧化研究结果一致。

图4 人参提取物不同极性部位的ABTS+自由基清除率Fig.4 ABTS+ free radical clearance rates of different polar parts of ginseng extract
2.1.5 人参不同极性部位对H2O2诱导的SH-SY5Y细胞氧化损伤的保护能力 提取物不同极性部位对H2O2诱导的SH-SY5Y 细胞氧化损伤有保护能力,如图5 所示,相比于模型组,SH-SY5Y 细胞在空白组正常贴壁状态下呈上皮样,有短触角延伸,成簇生长;在应用H2O2诱导损伤后,细胞形态变大变圆,轮廓不清晰;经过给药处理后的镜下见细胞形态接近于正常状态。采用CCK-8 法检测细胞存活率结果如图6,显示与模型组相比各组样品均提高了细胞存活率。表明人参不同极性部位可以改善H2O2诱导的细胞氧化损伤,其中正丁醇部位对细胞氧化损伤保护能力相对最强。

图6 人参提取物不同极性部位对H2O2 诱导的SH-SY5Y 细胞氧化损伤细胞存活率对比图Fig.6 Cell survival rate of H2O2 induced oxidative damage in SH-SY5Y cells at different polar sites of ginseng extract
2.2 人参不同极性部位成分含量
本研究采用高效液相色谱法对人参单体成分进行含量测定,由表2 可知,随着萃取溶剂的极性增大,人参皂苷Rg1、Re、Rb1 含量逐渐增高,其中正丁醇萃取物中单体皂苷的含量高于水提物与其余萃取物。同时,我们应用紫外分光光度计对人参水提物和各萃取物中的总物质进行含量测定可知,正丁醇萃取物中的总酚酸、总皂苷、总黄酮含量高于水提物与其它萃取物,分别为3.97%、37.76%、34.79%。以上研究结果表明正丁醇可以相对充分提取人参中的有效成分。

表2 人参不同极性部位成分含量Table 2 Composition content of Panax ginseng of different polar parts
2.3 人参不同极性部位成分与抗氧化活性相关性分析
如表3 所示,人参不同极性部位成分含量及抗氧化能力相关性分析结果表明,DPPH 自由基IC50值与总酚酸、总黄酮、人参皂苷Re、人参皂苷Rb1 含量呈极显著负相关(P<0.01),与总皂苷、总多糖、人参皂苷Rg1 含量呈显著负相关(P<0.05)。说明DPPH 自由基的清除是人参中多种成分共同作用的结果,总酚酸、总黄酮等成分含量越高DPPH 自由基清除率越高,由表2 可知在人参不同极性部位中,正丁醇部位的总酚酸、总黄酮等含量相对最高,表明正丁醇部位对DPPH 自由基清除能力相对最好。ABTS+自由基IC50值与总多糖、总黄酮、人参皂苷Re、人参皂苷Rb1 含量呈显著负相关(P<0.05),说明当人参中总多糖、总黄酮、人参皂苷Re 等含量越高ABTS+自由基的清除率越高,由表2 可知在人参不同极性部位中,正丁醇部位的总黄酮、人参皂苷Re 含量相对最高,表明正丁醇部位对ABTS+自由基清除能力相对最好。羟基自由基的IC50值与总酚酸含量呈负相关,说明在不同极性部位中总酚酸含量越高对羟基自由基的清除能力越强,由表2 可知,在人参不同极性部位中,正丁醇部位的总酚酸含量相对最高,表明正丁醇部位对羟基自由基清除能力相对最强。超氧阴离子自由基IC50值与总皂苷、人参皂苷Rg1 含量呈极显著负相关(P<0.01),与总黄酮、人参皂苷Re、人参皂苷Rb1 含量呈显著负相关(P<0.05),说明总皂苷、人参皂苷Rg1 等成分含量越高超氧阴离子自由基清除率越高,由表2 可知在人参不同极性部位中,正丁醇部位的总皂苷、人参皂苷Rg1 含量相对最高,表明正丁醇部位对超氧阴离子清除能力相对最好。细胞氧化损伤保护能力与总黄酮、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1 含量呈显著正相关(P<0.05),说明在不同极性部位中人参总黄酮、皂苷Rg1 等成分含量越高保护细胞氧化损伤能力越强。因此,通过以上相关性分析结果表明人参抗氧化活性及氧化损伤细胞保护能力与不同极性部位中活性成分含量密切相关,在人参不同极性部位中,正丁醇部位的总酚酸、总皂苷、总黄酮、人参皂苷Rg1 等成分含量相对最高,侧面验证说明正丁醇部位可能是人参提取物抗氧化活性最佳极性部位。
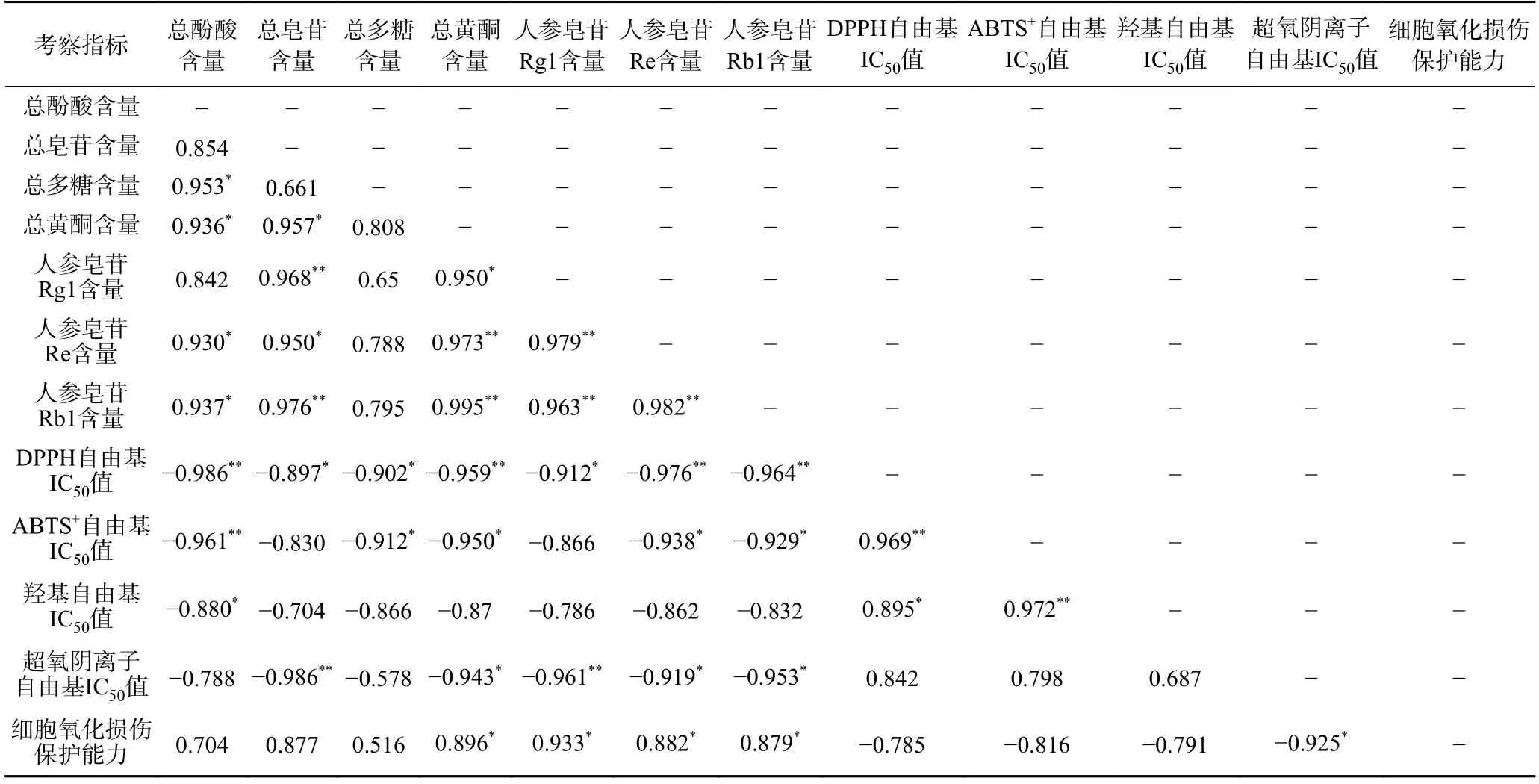
表3 人参不同极性部位成分与抗氧化能力相关性分析Table 3 Correlation analysis of antioxidant ability and components in different polar parts of Panax ginseng
2.4 人参不同极性部位灰色关联分析
灰色关联分析是对运行机制与物理原型不清晰的灰关系序列化、模式化,进而建立灰关联分析模型,目的在于寻求一种能够衡量各因素间关联度大小的量化方法,确定参考数列与其他比较数列间的关联程度,能够更直观评价不同样品间的优劣[29]。为准确表明人参何种极性部位具有良好的抗氧化活性和氧化损伤细胞保护能力,采用熵权法结合灰色关联度法进一步数据分析。
2.4.1 熵权法所得信息熵值及指标权重 据信息熵定义,对于某项指标,可用熵值来判断其离散程度,信息熵值越小,指标离散程度越大,则该指标对综合评价的影响就越大。以指标权重(Wi)作为计算灰色关联系数的分辨系数,可使结果更加准确可信。因此,本研究利用信息熵这个工具,计算各个指标的权重,结果见表4。

表4 熵权法计算所得信息熵及权重Table 4 Information entropy and weight are calculated by entropy weight method
2.4.2 灰色关联系数和相对关联度 根据公式(16)和(17)计算不同极性部位相对最优参考序列和最差参考序列的关联系数,结果见表5~表6。关联度按照公式(18)和(19)进行计算。将相对最优参考序列的关联度最大及相对最差参考序列的关联度最小定义为最佳评价单元,即得到相对关联度,结果见表7。根据相对关联度的大小进行排序,得到不同极性部位抗氧化活性的优劣评价结果,相对关联度值越大,表明该部位抗氧化活性越高。本研究以总酚酸、总皂苷、总多糖含量等12 个指标,通过灰色关联模型和熵权模型,对人参不同极性部位抗氧化活性进行优劣评价,发现人参不同极性部位相对关联度范围为0.352~0.618,说明人参不同极性部位间的抗氧化活性存在一定差异,依据相对关联度大小,显示正丁醇部位排名最前,表明其抗氧化作用相对最优(与氯仿比较有统计学意义P<0.05)。以上说明,通过灰色关联度分析结合熵权法科学评选出正丁醇部位为人参具抗氧化活性的最理想部位。

表5 各比较序列相对于最优参考序列的关联系数Table 5 Association coefficients of each comparative sequence relative to the optimal reference sequence

表6 各比较序列相对于最差参考序列的关联系数Table 6 Association coefficients for each comparative sequence relative to the worst reference sequence

表7 人参不同极性部位关联度、相对关联度及排序Table 7 Order of association,relative correlation and quality of Ginseng of different polar parts
3 讨论与结论
本研究以人参为原料,应用液-液萃取法将人参水提物依次使用石油醚,氯仿、乙酸乙酯、正丁醇萃取,将其分为水部位、石油醚部位、氯仿部位、乙酸乙酯部位、正丁醇部位五个不同极性部位,通过测定各部位对DPPH 自由基、ABTS+自由基、羟基自由基、超氧阴离子自由基的清除率及细胞氧化损伤模型的存活率研究各极性部位的抗氧化活性,结合熵权法和灰色关联分析对人参不同极性部位抗氧化活性进行优劣评价。经研究发现人参不同极性部位间抗氧化活性存在一定差异,将人参五种不同极性部位的指标数据以相对关联度综合排序,各极性部位抗氧化活性顺序为:R4>R>R3>R2>R1,正丁醇部位(R4)排名最前,经计算所得相对关联度相对最大(0.618),正丁醇部位的体外抗氧化活性相对最强。此外,还对人参化学成分及抗氧化活性进行相关性分析,阐明二者之间关系。结果显示,人参不同极性部位的化学成分及抗氧化活性间存在显著相关。人参不同极性部位抗氧化活性的变化趋势与其总酚酸、总黄酮、总皂苷含量具有一致性,因此推断其酚酸、黄酮、皂苷类成分可能是人参发挥抗氧化作用的潜在物质基础,同时人参正丁醇部位中总酚酸、总皂苷、总黄酮等成分含量显著高于其他极性部位。由以上推断,本研究通过正丁醇萃取人参水提物所得部位抗氧化活性相对最好,初步优选出正丁醇部位可能为人参最佳抗氧化活性部位。为人参作为天然抗氧化剂的研究及人参抗氧化食品的开发应用提供科学依据。

