酶法辅助提取人工培育蝉花多糖工艺优化及其动力学、热力学、抗氧化研究
谢 娜,程俊文,徐 娟,吴学谦,李春如,王玉芹,熊科辉,贺 亮,*
(1.浙江省特色中药资源保护与创新利用重点实验室,浙江农林大学食品与健康学院,浙江杭州 311300;2.浙江省森林资源生物与化学利用重点实验室,浙江省林业科学研究院,浙江杭州 310023;3.泛亚生命科学研究院,浙江泛亚生物医药股份有限公司,浙江嘉兴 314200;4.浙江五养堂药业有限公司,浙江丽水 323000)
蝉花(Cordyceps cicadae)属于虫草科,分布于我国长江以南,是与冬虫夏草相类似的虫草,其是蝉的幼虫在羽化前被虫草菌感染、寄生、吸收营养,最终被菌丝体完全占据后的躯壳[1]。早在明代《本草纲目》就已记载包括冬虫夏草、蝉花、黑木耳在内的40 多种食用菌,这类食用菌受到学者的广泛关注。但因野生资源较少,严重限制了蝉花商业化的应用。蝉拟青霉(Paecilomyces cicadaeMiq.Samson)又名雌蝉花,是从天然蝉花子实体中有丝分裂出的孢子真菌[2-3],可通过人工培育的方法进行大规模生产,有效解决资源短缺的问题。2021 年底,利用该食用菌培育出的虫草被卫健委批准列入“新资源食品”目录(2021 年第9 号公告),因此,吸引了大量学者围绕该真菌进行人工培育。
越来越多的文献报道,人工培育的蝉花含有多糖、核苷、腺苷、麦角甾醇、虫草酸等多种活性成分[4]。其中多糖组分能够改善机体自身的免疫功能,提升机体的抗病、抗风险能力,减少各种常见病的发生,毒副作用较小,不容易造成药物的残留,可以放心食用。研究表明,天然蝉花多糖具有抗氧化[5]、抗肿瘤[6]、保护肾脏[7]、增强免疫活性[8]等药理作用。目前,报道的提取人工培育蝉花多糖的方法主要为微波法[9]。而多糖提取方法有热水浸泡、酸、碱提法、酶法辅助提取等[10]。单纯的热水浸提法耗时且得率不高;酸、碱提法多糖对设备要求较高,且容易破坏多糖的内部结构;酶法提取是将酶作为一种生物催化剂来破坏植物细胞壁结构,有效去除蛋白质等成分干扰,加快细胞中活性物质溶出,该方法操作安全,易于控制,提取效率高[11],所以本次实验采用木瓜蛋白酶法提取人工培育蝉花多糖。
本文拟采取酶法提取人工培育蝉花多糖,结合响应面法对其提取工艺进行优化,重点考察料液比、酶添加量、酶解温度、提取时间等单因素对多糖得率的影响,建立该多糖提取工艺的数学模型,获得其最佳提取工艺,并探究其动力学和热力学性质,再根据DPPH·、·OH 及ORAC 等指标,测定该虫草多糖的体外抗氧化活性,为进一步深度开发人工培育蝉花资源及其活性多糖组分提供可能。
1 材料与方法
1.1 材料与仪器
人工培育蝉花菌粉 浙江泛亚医药有限公司;酚类、单糖标品、无水葡萄糖、水杨酸、过氧化氢、硫酸亚铁、浓硫酸 徐州淞誉化工科技有限公司;维生素C、2,2-联苯基-1-大苦基肼基(DPPH)、荧光素、水溶性VE衍生物(Trolox)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、木瓜蛋白酶(3 units/mg)上海阿拉丁生物科技股份有限公司;所用试剂均为分析纯。
RE-201D 旋转蒸发仪 常州亚旺仪器有限公司;SB25-YZ-120DB 超声波清洗机 上海越众仪器设备有限公司;IEC-CL31R 多功能高速离心机 美国Thermo 公司;荧光微孔板细胞分析仪 美国Thermo 公司;LT-DBX60N 精密可编程烘干箱 上海博迅设备有限公司;DL-3020 低温冷却液循环泵宁波新芝有限公司;电子天平 北京正联兴业称重科技有限公司;电热恒温水浴锅 苏州正基仪器有限公司。
1.2 实验方法
1.2.1 人工培育蝉花的预处理及提取 将原料用95%乙醇按料液比1:10(g/L)除脂,水浴90 ℃回流,每次3 h,放在55 ℃ 的烘箱之中烘干,过40 目筛,放置备用。
取一定量的人工培育蝉花,用蒸馏水做溶剂,调节pH 为6.5,放入65 ℃水浴锅中搅拌30 min,调节pH 至7.0。90 ℃回流提取,每次2 h,过滤,将滤渣复提一次。将2 次所得滤液混合,按溶液体积的1%加入木瓜蛋白酶,放入70 ℃烘箱2 h,进行多次搅拌,5000 r/min 离心5 min,取上清液。60 ℃下进行减压浓缩,浓缩液与95%乙醇体积比例为1:4,醇沉(4 ℃,12 h),5000 r/min 离心8 min,收集沉淀,冷冻干燥后,得到即为蝉花粗多糖。
1.2.2 粗多糖得率的测定 采用苯酚-硫酸法测定多糖含量[12]。利用葡萄糖溶液绘制标准曲线,用紫外分光光度计在490 nm 处测定其吸光值,得到葡萄糖标准曲线y=15.94x-0.0622,R2=0.9581,说明该标准曲线具有线性关系。将10 mg 样品称取到烧杯中进行溶解,转移至10 mL 容量瓶定容,按照制定标准曲线的同样方法测定样品吸光度值,计算蝉花菌粉多糖得率:
式中:m 为人工培育蝉花菌粉质量,g;C 为样品多糖质量浓度,mg/mL;V 为样品溶液总体积,mL;n 为稀释倍数。
1.2.3 单因素实验 考虑料液比、酶添加量、酶解温度、提取时间不同因素对蝉花虫草多糖得率的影响。将酶添加量控制为1.5%,酶解温度控制为65 ℃,提取时间为90 min,考察料液比(1:10、1:20、1:30、1:40、1:50 g/mL)对多糖得率的影响;将料液比控制在1:30 g/mL,酶解温度控制为65 ℃,提取时间为90 min,考察酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)对多糖得率的影响;将料液比控制在1:30 g/mL,酶添加量控制为1.5%,提取时间为90 min,考察酶解温度(45、55、65、75、85 ℃)对多糖得率的影响;将料液比控制在1:30 g/mL,酶添加量控制为1.5%,酶解温度为65 ℃,考察提取时间(70、80、90、100、110 min)对多糖得率的影响。
1.2.4 人工培育蝉花多糖提取工艺响应面试验优化根据单因素实验,将料液比、酶添加量、酶解温度、提取时间为4 个因素,每个因素选取3 个水平,进行Box-Behnken 原理设计响应面试验见表1,将蝉花多糖得率作为响应值,对其提取工艺进行优化。
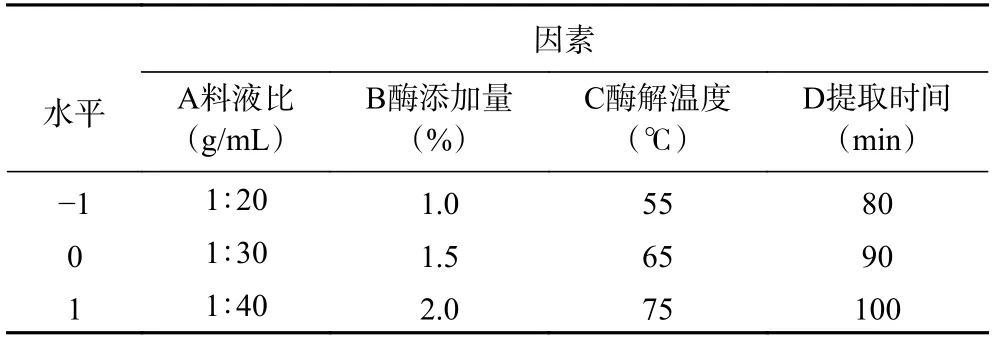
表1 响应面试验因素与水平Table 1 Factors and levels of response surface test
1.2.5 人工培育蝉花多糖提取动力学分析 参考文献[13]可知,多糖的提取过程一般分为三个阶段:溶剂向内渗透、有效成分内部扩散到表面中以及有效成分向外扩散到溶剂。假设人工培育蝉花样品为球形,根据Fick 第二定律[14]:
设f=r·c,方程可以变成
根据傅里叶变换求得:
通常情况下,高次项分布趋近于0,可忽略,式(4)取n=1,则:
等式左右两边同时取对数得:
式(5)、式(6)为蝉花多糖提取过程的动力学模型,该模型反映了多糖提取过程中提取的酶添加量、料液比、酶解温度、提取时间参数对蝉花多糖浓度的影响。
式中:Ds为扩散系数;C 为任意时间的得率,%;C∞为平衡时的得率,%;C0为提取溶液中多糖的初始得率,%;K 为速率常数,min-4;t 为提取时间,min。
1.2.6 热力学分析 根据文献[15],将Arrhenius 公式进行下列推导:
式中:A 为阿伦尼乌斯常数;R 为气体常数,8.314 J/mol·K;T 为提取温度,K;K 为分配系数;Ea 为活化能,kJ/mol;ΔGm 为吉布斯自由能,kJ/mol;ΔHm 为焓自由能,kJ/mol;ΔSm 为熵自由能,kJ/mol。
1.2.7 抗氧化活性分析
1.2.7.1 DPPH 自由基清除能力的测定 参考文献[16-17]方法,制备不同浓度梯度(0.25,0.5,1.0,1.5,2.0,2.5 mg/mL)的粗多糖溶液,依次添加2 mL DPPH 乙醇溶液,混合均匀,避光室温放置30 min,用蒸馏水作空白,VC溶液作对照,在517 nm 处测定其吸光度,计算DPPH 自由基清除率:
式中:A0为空白对照品在517 nm 处的吸光值;A1为样品溶液的在517 nm 处吸光值;A2为以蒸馏水代替DPPH 的样品溶液在517 nm 处的吸光值。
1.2.7.2 羟自由基清除能力的测定 参考文献[18-19]的方法,制备不同浓度梯度(0.25,0.5,1.0,1.5,2.0,2.5 mg/mL)的粗多糖溶液,取1~5 号试管,加入2 mL 多糖溶液,再依次加入9.0 mmol/L FeSO4溶液、9.0 mmol/L 水杨酸乙醇液、8.8 mmol/L H2O2溶液各2.0 mL,摇匀,在室温下放置30 min 待其稳定,紫外分光光度计510 nm 处测定不同浓度多糖溶液吸光度值,维生素C 溶液作对照液,计算羟自由基清除率:
式中:A0为空白对照品在510 nm 处的吸光值;A1为样品溶液在510 nm 处的吸光值;A2为多糖溶液不加显色剂H2O2在510 nm 处的吸光值。
1.2.7.3 氧化自由基清除能力的测定 根据文献[20]的方法,取荧光96 孔板,分别做对照组、标准曲线组、样品组。三组同时加入荧光素盐(700 nmol/mL)40 μL,对照组加入20 μL 磷酸盐缓冲液,标准曲线组加入20 μL 水溶性VE衍生物Trolox(200 μmol/mL),样品组加入20 μL 待测样品。37 ℃烘箱孵育15 min,阴性对照组加入140 μL 磷酸盐缓冲液,其他待测孔全部加入140 μL AAPH(12 mmol/mL)。迅速用酶标仪进行测量。在485 nm 激发条件下,538 nm发射波长处记录荧光发射强度的变化。从0 min 开始,每隔2 min 测量一次,记录120 min,计算样品荧光变化零阶矩曲线下面积(area under curve,AUC),并绘制Trolox 标准曲线,计算样品ORAC 值:
式中:f1:初始荧光读数;fn:时间为一定时间(min)后荧光读数。
1.3 数据处理
所有单因素及响应面试验进行3 组重复并取平均值,使用Origin8.0 软件对获得的数据进行统计学分析,响应面设计和数据处理采用Design Expert 12.0 分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比的确定 由图1 可知,料液比在1:10~1:50 g/mL 范围内,多糖得率随功率增大显著(P<0.05)增加。当料液比在1:30 g/mL 时,多糖得率达到最大,可能是样品与溶剂的接触达到平衡,多糖不再析出;当料液比大于1:30 g/mL 时,多糖得率不再继续升高,因为过多的加溶剂会导致杂质的溶出,从而抑制多糖的溶解[21]。所以,料液比控制在1:30 g/mL 时为最佳。
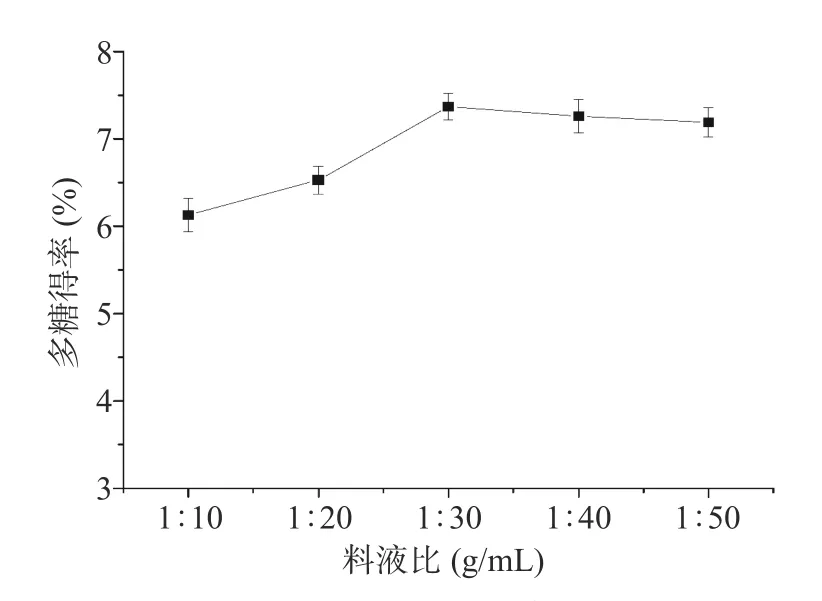
图1 料液比对多糖得率的影响Fig.1 Effect of liquid to solid ratio on polysaccharide yield
2.1.2 酶添加量的确定 由图2 可知,酶添加量在0.5%~1.5%范围内,多糖得率随酶添加量增加显著(P<0.05)增大。当酶添加量在1.5%时,多糖得率达到最大;当酶添加量大于1.5%时,多糖得率不再因为酶添加量增多继续升高,可能是在固定量的原料下,酶添加量已经最大化,对于多糖的溶出不再起作用。所以,酶添加量在1.5%时为最佳。

图2 酶添加量对多糖得率的影响Fig.2 Effect of enzyme dosage on polysaccharide yield
2.1.3 酶解温度的确定 由图3 可知,酶解温度在45~65 ℃范围内,多糖得率随酶解温度增加显著(P<0.05)增加。当酶解温度在65 ℃时,多糖得率达到最大;当酶解温度大于65 ℃时,多糖得率不再因为酶解温度增多继续升高,可能是因为温度太高,部分多糖出现降解。所以,酶解温度在65 ℃时为最佳。
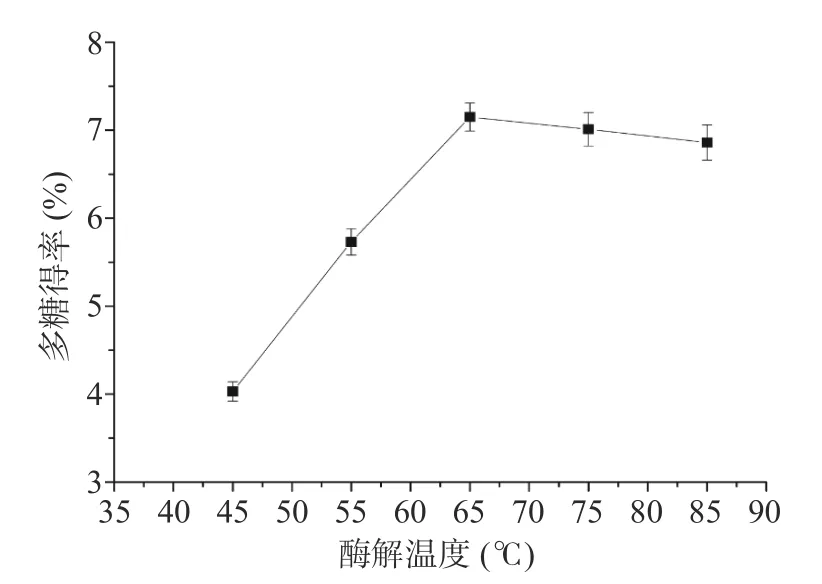
图3 酶解温度对多糖得率的影响Fig.3 Effect of enzymatic hydrolysis temperature on polysaccharide yield
2.1.4 提取时间的确定 由图4 可知,提取时间在70~90 min 范围内,多糖得率随提取时间增加显著(P<0.05)上升。当提取时间在90 min 时,多糖得率达到最大;当提取时间大于90 min 时,多糖得率不再因为提取时间增加继续升高,还出现下降趋势,可能是在90 min 内多糖溶解率达到最优。所以,提取时间在90 min 时为最佳。

图4 提取时间对多糖得率的影响Fig.4 Effect of extraction time on polysaccharide yield
2.2 响应面试验
2.2.1 响应面试验结果分析 根据Design expert 软件,设计出四因素三水平响应面试验,共29 个试验点,详细方案如下表2,方差分析见表3,根据拟合结果,得到多糖得率Y 的回归方程:

表2 各因素响应面试验设计与结果Table 2 Response surface design and results for each factor
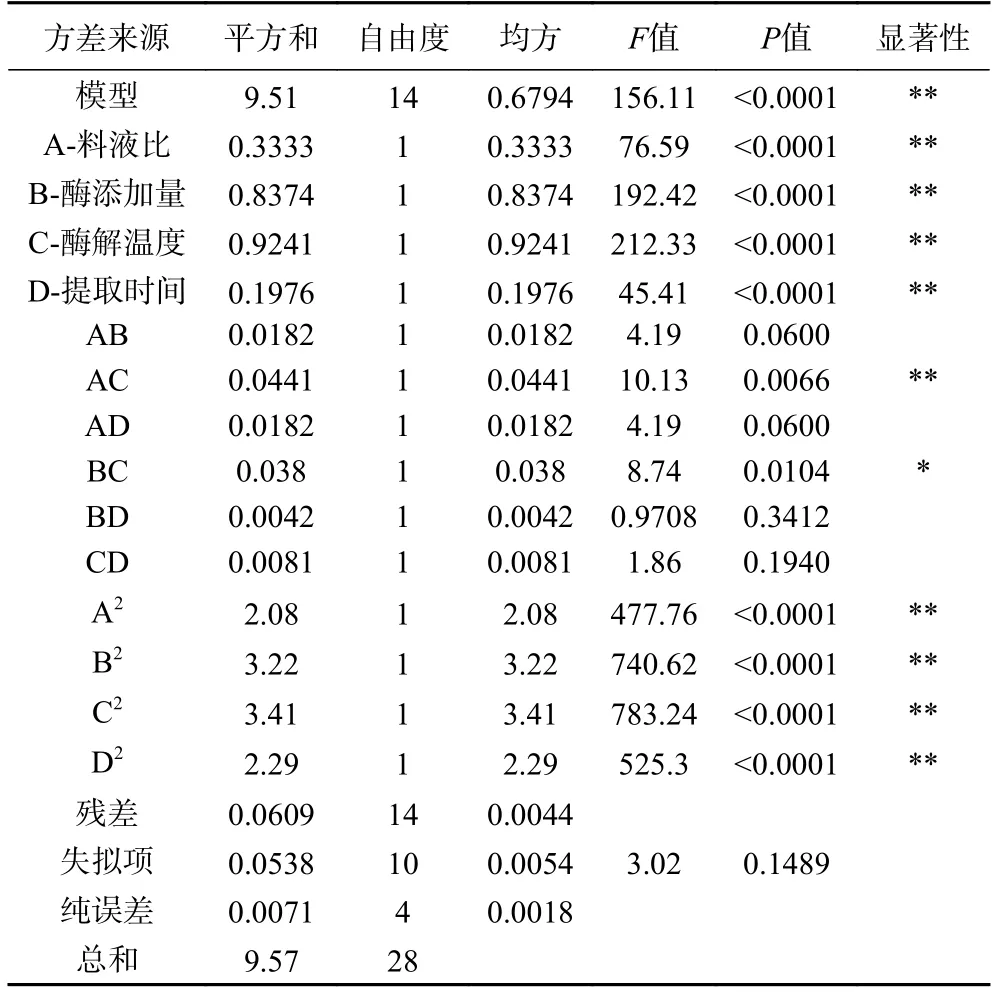
表3 各因素回归方程的方差分析Table 3 Variance analysis of regression equations of various factors
由表3 可知:本数据模型P<0.0001,失拟项P(0.1489)>0.05,说明该试验模型成立。A(料液比)、B(酶添加量)、C(酶解温度)、D(酶解时间)四个因素P值均小于0.001,说明本文选定的四个因素对蝉花虫草多糖得率有显著的影响;其中R2=0.9936,R2adj=0.9873,CV=0.96%,说明该实验拟合效果较好,误差小,准确度高,外界因素对多糖得率影响较小,可以用此模型对提取目标多糖工艺参数进行优化。通过F值,可以看出每个单因素对多糖得率的影响为:C>B>A>D,即酶解温度>酶添加量>料液比>提取时间。
2.2.2 交互作用分析 通过响应面软件得到的响应面曲面图见图5,可以看到两因素交互结果对人工培育蝉花多糖的影响。由文献[22-23]得知,响应曲面图和等高线图均可显示不同因素对结果的影响,响应曲面图中曲线越陡,说明该因素对结果影响越大;等高线接近椭圆说明两因素的交互作用显著。由图5可知,A(料液比)与C(酶解温度)、B(酶添加量)与C(酶解温度)这两组响应图曲线陡峭,且等高线成椭圆,表明这两组因素交互作用对目标多糖得率影响显著,与表3 方差结果一致,更加证实了该数学模型的准确性。
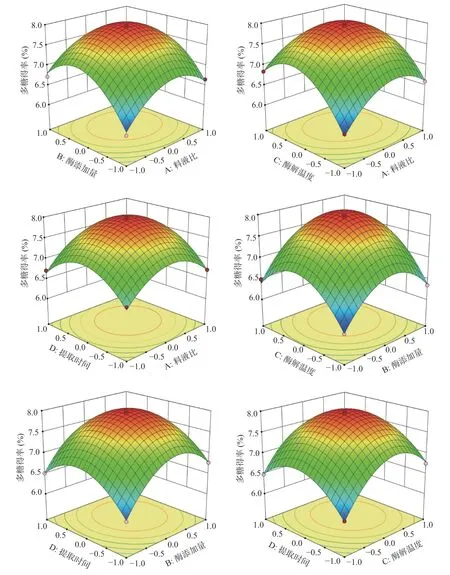
图5 两因素交互作用对多糖得率的影响Fig.5 Effect of interaction of two factors on polysaccharide yield
2.2.3 响应面试验的优化及验证 通过本次研究可知,人工培育蝉花多糖得率是文献[24]报道的天然蝉花得率1.18 倍。根据响应面试验模型,得到多糖提取最佳工艺预测值:料液比为1:30 g/mL、酶添加量为1.596%、酶解温度为66.92 ℃、提取时间为91.03 min,人工培育蝉花预测提取得率为7.99%。结合实际生产情况,将试验条件改成料液比1:30 g/mL、酶添加量为1.6%、酶解温度为67 ℃、提取时间为90 min,进行3 次以上平行试验,得到多糖得率平均值为7.91%,与理论值相差较小,再次说明本次响应面模型对优化人工培育蝉花多糖的提取工艺具有一定的可行性。
2.3 人工培育蝉花提取多糖的动力学分析
2.3.1 速率常数求解 研究了不同酶添加量下,多糖得率随时间的变化。根据表4 可知,多糖得率随着时间的增加而增加,100 min 时得率已经达到平衡,将100 min 时的得率设为平衡得率C∞。取ln[C∞/(C∞-C)]和时间t 作图(图6),随着酶添加量增加,得率也在不断提高,说明ln[C∞/(C∞-C)]和t 呈线性依赖关系。由此可知,人工培育蝉花多糖的提取过程符合Fick 第二定律。通过图6 的回归方程可得到表5,根据表5 的拟合系数(R2>0.9),说明该模型拟合较好。同时得到了在不同酶添加量下速率常数K 值,并随着酶添加量增多而变大,这是因为木瓜蛋白酶的添加有效分解人工培育蝉花菌丝壁上的蛋白以及游离蛋白,更好地使目标多糖溶解[25]。

图6 不同酶添加量下ln[C∞/(C∞-C)]与时间的关系图Fig.6 Relationship between ln[C∞/(C∞-C)] and time at different enzyme addition

表4 不同酶添加量对多糖提取效果的影响Table 4 Polysaccharide extraction rate under different enzyme addition
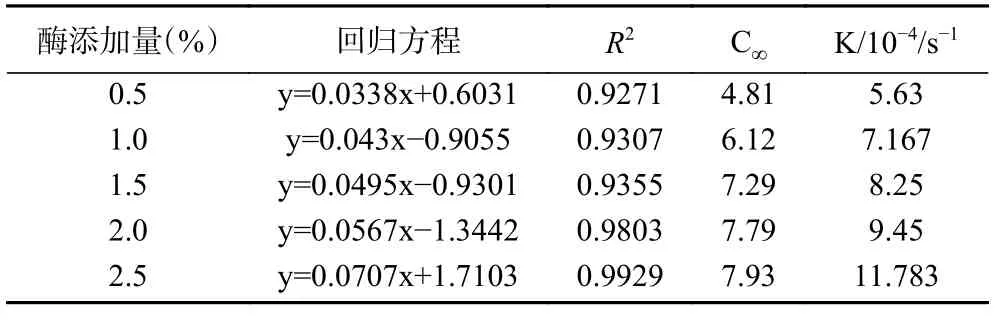
表5 不同酶添加量下ln[C∞/(C∞-C)]与t 的回归方程Table 5 Regression equation between ln[C∞/(C∞-C)] and t at different enzyme addition
2.3.2 相对萃余率的求解 相对萃余率是多糖在某一条件下的残留值比上平衡时的得率,其数值越小,说明得率越大。基于表4 数据,利用(C∞-C)/C∞与时间t 作图得到如下图7,从图中拟合曲线显示,拟合方程精度良好(R2≥0.9),说明整个提取过程符合指数方程模型。进一步得知,相对萃余率常数与表5中速率常数的趋势一致,说明在不同酶添加量的条件下,多糖的得率随着时间增加而提高,该萃取过程与建立的动力学模型吻合。

图7 不同酶添加量下相对萃余率与时间的关系Fig.7 Relationship between the relative rate and time at different enzyme addition
2.3.3 半衰期 半衰期是指提取一半多糖所需要的时间。由t1/2=ln2/k 对酶添加量作图。根据图8 可知,半衰期与酶添加量成反比,通过酶的催化和能量的消耗,酶添加量越大,半衰期越小,越有利于人工培育蝉花中的蛋白分解,使多糖的溶出越快,从而t1/2值越低[26]。
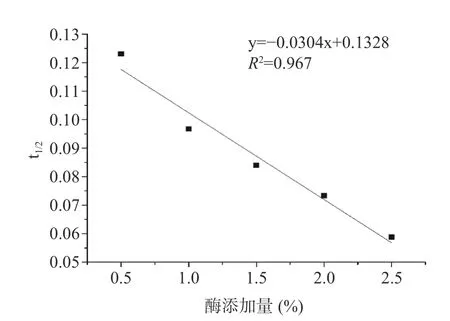
图8 不同酶添加量与t1/2 的关系Fig.8 Relationship between different enzyme additions and t1/2
2.4 热力学相关性质
根据单因素实验可知,酶添加量在1.5%的条件下,提得率达到最佳,所以,选酶添加量在1.5%的情况下进行热力学分析。如表6,根据热力学公式,求出活化能Ea=10.32 kJ/mol,ΔGm为-0.82~-13.49 kJ/mol,吉布斯能小于零,说明提取多糖的反应是一个不可逆的自发反应;ΔHm大于零,说明人工培育蝉花多糖的提取过程是一个吸热的反应[27]。研究表明,多糖得率与温度升高呈正相关。

表6 人工培育蝉花多糖分布常数热力学参数Table 6 Thermodynamic parameters of distribution constants of artificially-cultivated Cordyceps cicadae
2.5 人工培育蝉花体外抗氧化活性分析
2.5.1 DPPH 自由基清除率 DPPH 是较为常用的考察活性物质的抗氧化能力的药理模型[28-29]。由图9 可知,在0.25~2.5 mg/mL 范围内,人工培育蝉花粗多糖溶液随着浓度增大,对DPPH 自由基清除能力也逐渐升高;当多糖溶液浓度为1.0 mg/mL,对DPPH 自由基清除率达到81.9%,通过计算得到其IC50数值:0.54 mg/mL,其抗氧化活性高于浙江金蝉花[30]。结果表明,人工培育蝉花具有良好的抗氧化性。但是相对于维生素C 对照液的抗氧化性还是较弱。
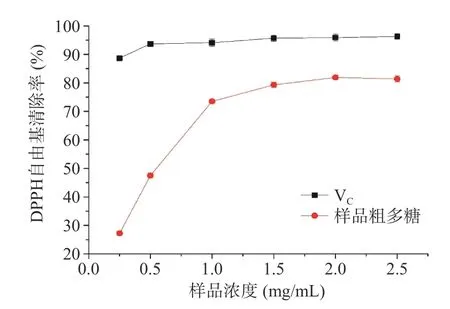
图9 不同浓度粗多糖对DPPH 自由基的清除率Fig.9 DPPH scavenging capacity of crude polysaccharide with different concentration
2.5.2 羟自由基清除率 羟自由基和DPPH 自由基一样,经常被作为常用的考察物质的抗氧化能力的模型[31]。由图10 可知,在0.25~2.5 mg/mL 范围内,人工培育蝉花粗多糖溶液随着浓度增大,对羟自由基清除能力也逐渐升高,当多糖溶液浓度为1.0 mg/mL,对羟自由基清除率达到80.2%,得到其IC50为0.60 mg/mL,高于江苏野生金蝉花[32]。结果表明,人工培育蝉花具有良好的抗氧化性。但是相对于维生素C 对照组的抗氧化性还是较弱。
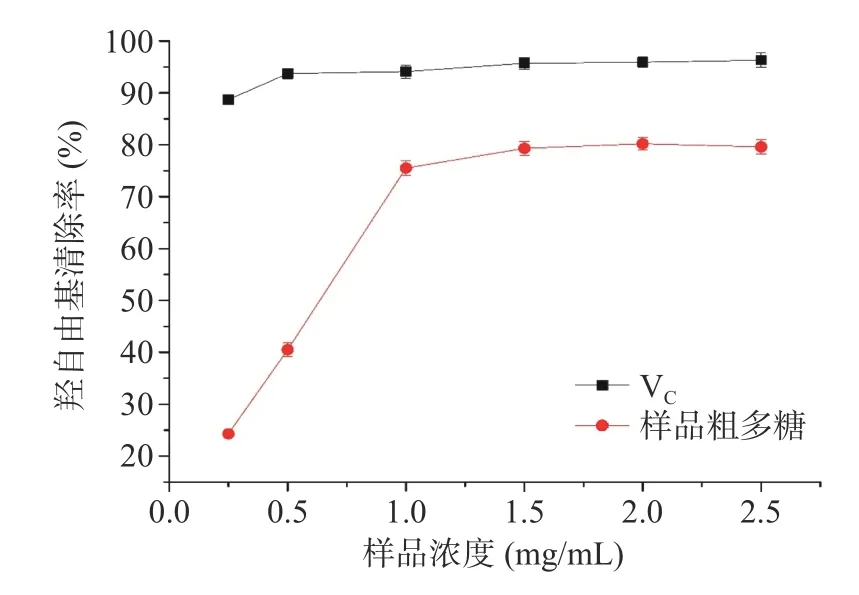
图10 不同浓度粗多糖对羟自由基的清除能力Fig.10 Hydroxyl radical scavenging capacity of crude polysaccharide with different concentration
2.5.3 氧化自由基的吸收能力 以维生素E(Trolox)浓度为横坐标,以当量的形式代表药物的抗氧化能力,NetAUC 为纵坐标,为相对曲线面积,制定标准曲线[33]。如图11,该标准曲线y=0.8981x+2.8097,R2=0.9572,表明该标准曲线有良好的线性关系,将样品的NetAUC 值大入标准曲线中,得到对应的Trolox浓度值,计算氧自由基数值。用Trolox(μmol/g)表示样自由基吸收能力,根据标准曲线得到人工培育蝉花粗多糖的ORAC 值为45.62 Trolox μmol/g,说明人工培育蝉花具有良好的抗氧化活性。
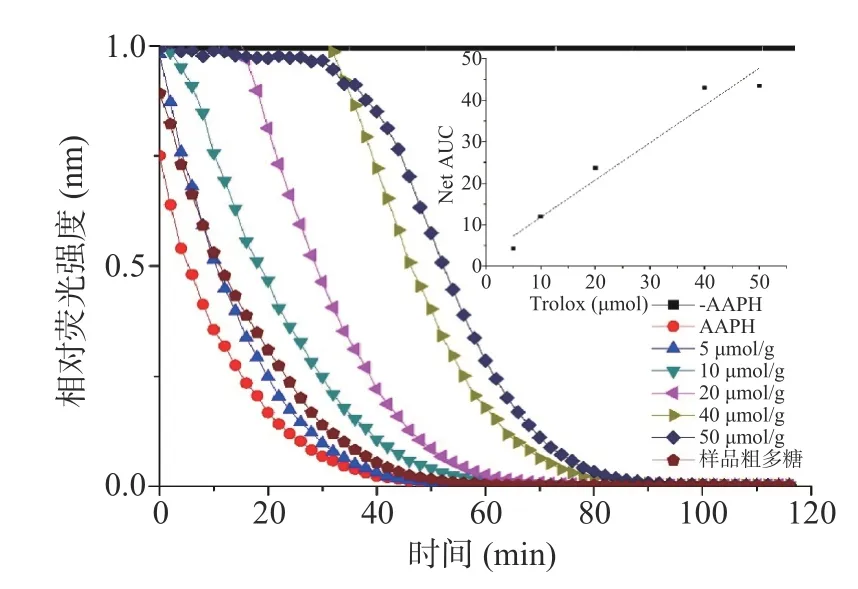
图11 不同浓度粗多糖对氧化自由基的清除能力Fig.11 Oxygen free scavenging capacity of crude polysaccharide with different concentration
3 结论
本实验以商业化的人工培育蝉花为原料,利用酶法辅助提取其活性多糖组分,从单因素实验结果发现,各因素对多糖得率均有显著影响;结合响应面优化法,建立了适合人工培育蝉花多糖的数学模型,该模型具有良好的稳定性和准确性,其中对多糖得率影响最大的是酶解温度,其次是酶添加量、料液比和提取时间。结合实际生产最终获得最佳提取工艺:料液比1:30 g/mL、酶添加量1.6%、酶解温度67 ℃、提取时间90 min,多糖的得率达到7.91%。基于Fick第二定律,本文对其进行动力学研究,通过速率常数、相对萃余率等数据,说明在不同酶添加量的条件下,增加时间有助于多糖的溶出。根据热力学参数:Ea、ΔGm、ΔHm、ΔSm表示此过程是自发吸热的反应。通过体外抗氧化实验,DPPH 自由基和羟自由基的IC50值分别是:0.54、0.60 mg/mL,说明人工培育蝉花具有良好的抗氧化性。本实验首次利用酶法提取人工培育蝉花多糖,既解决低得率问题,又结合了酶提法的多效性,为进一步工业化开发人工培育蝉花多糖提供理论依据。

