乳酸胁迫对Pichia kudriavzevii 固态发酵特性的影响
潘婉舒,林晓芳,杨小平,徐 洋,侯 鑫
(1.宜宾学院农林与食品工程学部,四川宜宾 644000;2.四川省春源品悟酒业有限公司,四川成都 611530;3.玉蝉集团有限公司,四川泸州 646603)
发酵食品中,酵母与乳酸菌的相互作用一直是研究的热点[1],如:改善产品风味、改善食品益生特性与质构、提高酒类发酵效率等。浓香型白酒糟醅乳酸含量高达20~100 g/kg,可作为研究乳酸环境酵母生长代谢的范例。库德毕赤酵母(Pichia kudriavzevii)是浓香型白酒发酵过程中的优势酵母[2-5],可产有机酸、酯类和酚类等多种浓香型白酒风味物质,改善酒体风味[6-7],对浓香型白酒产量及品质有重要影响。
在浓香型白酒这一多微共酵发酵体系中,P.kudriavzevii的生长代谢受到多种生化及环境因子的影响,特别是乳酸。乳酸是浓香型白酒发酵糟醅中含量最高的有机酸[8-10],且其含量不仅与微生物产酸有关,还受蒸酒压力、时间的影响,故不同窖池乳酸含量存在差异[11-14]。Deng 等[11]研究发现乳酸会抑制白酒中核心酵母生长代谢,同时酵母可通过降解乳酸来适应此种乳酸胁迫。张勤等[15]筛选到2 株可在含68 g/L 乳酸中生长良好的耐酸酵母菌株,能够降解环境中的酸,说明酵母应对乳酸胁迫的重要机制为降解乳酸。还有研究发现一些耐乳酸酵母菌株具有较强维持细胞膜稳定性和积累海藻糖及麦角固醇的能力,这也是其对抗乳酸的重要作用机理[16]。乳酸的生成会影响发酵环境pH,不同酵母的最适产酒、产酯pH 存在差异,进而影响糟醅中酵母代谢产物[17],这种差异对糟醅中酵母的生长代谢有何影响,至今尚无定论。
本研究针对1 株分离自浓香型白酒糟醅、产香性能优良的P.kudriavzevi菌株,分别在不同乳酸浓度的YNB 培养基及五粮粉培养基培养P.kudriavzevi菌株,检测其在碳源和氮源利用率、耐高温以及代谢产物等方面的差异,探究乳酸胁迫对P.kudriavzevii菌株发酵性能的影响,为其生产应用提供数据支撑。
1 材料与方法
1.1 材料与仪器
Pichia kudriavzevii菌株PY1 分离自浓香型白酒糟醅,现保存于固态发酵资源利用四川省重点实验室;根霉粉 安琪酵母股份有限公司;发酵原料:五粮粉(高粱36%、大米22%、糯米18%、小麦16%、玉米8%)、糠壳 四川省春源品悟酒业有限公司;五粮固体培养基(100 g/18 mL):五粮粉80 g、糠壳20 g,混匀蒸制备用,补加18 mL 无菌水;五粮液体培养基(100 g/200 mL):五粮粉80 g、糠壳20 g,混匀蒸制备用,补加200 mL 无菌水;YNB-乳酸培养基:在YNB 培养基基础上,使用前按比例添加过0.22 μm滤膜的乳酸;WL 培养基、YPD 培养基、YNB 培养基青岛海博生物科技有限公司;乳酸、氯化钠、葡萄糖、蔗糖、麦芽糖、果糖、DNS 显色剂、D-半乳糖、L-赖氨酸、L-组氨酸、L 亮氨酸等 分析纯,天津科密欧化学试剂有限公司;维生素B1、维生素B2、维生素B6纯度≥98%,成都科龙试剂有限公司;糖化酶 夏盛酶生物技术有限公司。
SpectraMax M2 多功能酶标仪 美谷分子仪器(上海)有限公司);A91plus 气相色谱仪 常州磐诺仪器有限公司;Lynx6000 离心机 赛默飞世尔科技公司;MSDDR701 光学显微镜 迈时迪(东莞)科技有限公司;BSD-YX2200 摇床 上海沪粤明科学仪器有限公司等。
1.2 实验方法
1.2.1 菌株活化 将甘油保藏的PY1 酵母菌株无菌操作接种1 mL 至20 mL 的YPD 液体培养基中,28 ℃摇床培养2 d,采用平板划线法接种至WL 固体培养基,28 ℃培养2 d 分离,挑取适量纯培养菌株至WL 培养基重复划线接种,经3 次划线纯化后,复接种于YPD 液体培养基,28 ℃摇床培养2 d 后获得实验用菌液,放入4 ℃的冰箱中保藏备用。实验前挑取适量液体保存的PY1 酵母菌株至WL 培养基划线接种,获得PY1 酵母菌株单菌落。
1.2.2 乳酸对P.kudriavzevii菌株液、固态生长的影响 液态培养:将PY1 酵母菌株单菌落接种到不含乳酸的YNB 培养基中,进行不同乳酸浓度的连续培养(28 ℃ 2 d/阶段),阶段培养结束后按比例补加过0.22 μm 滤膜的乳酸,分别至乳酸浓度为20、40 g/L。阶段培养结束后检测酵母细胞存活率,再收集培养细胞,接种到不含乳酸(0 g/L)的YNB 培养基,28 ℃下培养2 d,检测酵母细胞存活率,探究不同浓度乳酸对酵母菌株存活率的影响,确定酵母菌株最大耐受乳酸添加量。
固态培养:将PY1 酵母菌株单菌落分别划线接种于无乳酸和最大耐受(40 g/L)乳酸添加量的WL固体培养基,28 ℃下培养2 d,观察并记录菌落形态变化。
存活率:液体和固体培养均采用无菌接种环挑取少许菌体于10 mL 无菌水中稀释,混合均匀后吸取0.2 mL 稀释液滴于血细胞计数板中央,添加1 滴美蓝染色剂,染色3 min,在光学显微镜下观察菌体菌落、细胞形态并记录死细胞数(染为蓝色)和总细胞数目,按照公式计算存活率,计算公式如下[18]:
1.2.3 乳酸对P.kudriavzevii菌株高温耐受性的影响 白酒糟醅发酵期间内部醅温可达到50 ℃,故出于实际应用考虑,评估PY1 酵母菌株的生长上限温度。将PY1 酵母菌株单菌接种到YNB 培养基,不同培养温度(44、46、48 ℃)培养2 d,以发酵结束后酵母菌数(OD560nm值)评估酵母菌株耐高温特性。
1.2.4 乳酸对P.kudriavzevii菌株碳源利用的影响将PY1 酵母菌株单菌落依次划线接种到添加20 g/L 乳酸和5 g/L 不同碳源(葡萄糖、D-半乳糖、麦芽糖、果糖、蔗糖)的YNB 培养基中,28 ℃下培养2 d,考查PY1 酵母菌株对不同碳源的利用情况。并设置不添加乳酸不同碳源YNB 培养基培养PY1酵母菌株作为对照组。发酵结束后,采用DNS 法[19]测定样品中剩余糖含量,评估乳酸对PY1 酵母菌株不同碳源利用情况的影响。
1.2.5 乳酸对P.kudriavzevii菌株生长因子作用效果的影响 五粮提取液制备:称取2 kg 五粮粉与4 L 水煮至开花,冷却至40 ℃左右,加入2.8 g 糖化酶搅拌均匀,用纱布过滤。将滤液4000 r/min 离心5 min 备用。将PY1 酵母菌株单菌落分别接种到添加20 g/L 乳酸的五粮提取液和YNB 混合培养基(1:1,v/v)中,参照文献[20]设置生长因子。分别添加0.5 g/L 不同生长因子(赖氨酸、组氨酸、亮氨酸、磷酸氢二钠、维生素B1、维生素B2、维生素B6),28 ℃下培养36 h,测定发酵过程中(0、12、24、36 h)酵母菌数(OD560nm值),并以酵母在560 nm 处的吸光度增加值(△OD增加值=OD测定值-OD0h),评估乳酸胁迫下PY1 酵母菌株对不同生长因子的利用情况。并设置不添加乳酸不同生长因子PY1 酵母菌株作为对照组。
1.2.6 乳酸添加量对P.kudriavzevii菌株液态发酵产挥发性代谢产物的影响 将PY1 酵母菌株单菌落分别接种到不同浓度乳酸(0、20、40 g/L、回0)的YNB-葡萄糖培养基(添加5 g/L 葡萄糖),28 ℃条件下培养36 h,采用气相色谱[13,21]的方法测定发酵液挥发性代谢产物。气相色谱检测采用Lzp 930 色谱柱(50 m×0.25 mm×0.25 μm),进样温度220 ℃,检测温度250 ℃,进样量 0.4 μL,载气为氮气,流速1 mL/min,分流比10:1,升温程序:55 ℃保持3 min,以3.5 ℃/min 升温至150 ℃,保持1 min,再以10 ℃/min 升温至200 ℃,保持2 min,再以20 ℃/min 升温至220 ℃,保持10 min。
1.2.7 乳酸胁迫下P.kudriavzevii菌株固液态发酵实验 固态发酵:参照文献[20]研究方法,将2%(m/m)根霉粉和2%(v/m)酵母菌液(OD560nm为0.5)混合依次接种到不同乳酸(0、20 g/L)添加量的五粮固体培养基,28 ℃发酵7 d,为酵母菌固态发酵实验组;设置不接菌和不添加乳酸的五粮固体培养基为对照组。
液态发酵:将2%(m/m)根霉粉和2%(v/m)酵母菌液(OD560nm为0.5)混合接种到不同乳酸(0、20 g/L)添加量的五粮液体培养基,28 ℃发酵7 d,为酵母菌固态发酵实验组;设置不接菌和不添加乳酸的五粮液体培养基为对照组。
1.2.8 检测方法 发酵结束后取10 mL 发酵液测定总酸含量[22];发酵结束后取100 g 固体(液体)参照文献[21]样品前处理方法采用气相色谱法[13]检测固液态发酵代谢产物。葡萄糖采用DNS[13]法测定;总酸含量测定采用酸碱滴定法[17]。
1.3 数据处理
所有处理组均设3 个重复,采用Excel 2019、SPSS 22.0、GraphPad Prism 9.1.2 处理数据。
2 结果与分析
2.1 乳酸对P. kudriavzevii 菌株生长的影响
图1 展示P.kudriavzevii菌落及细胞形态。在添加40 g/L 乳酸的情况下,PY1 酵母菌株菌落形态与细胞形态无明显变化。
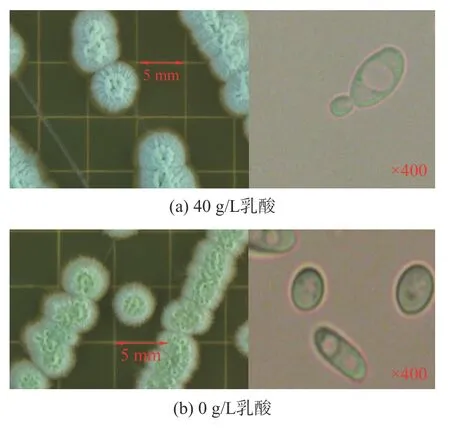
图1 P. kudriavzevii 菌落及细胞形态Fig.1 Morphology of P. kudriavzevii under lactic acid stress
图2 展示不同浓度乳酸对P.kudriavzevii存活率的影响,可以看出,乳酸胁迫会降低P.kudriavzevii存活率,解除乳酸胁迫后酵母菌存活率恢复到原有水平(P<0.05)。当乳酸浓度为20 g/L 时,酵母菌的存活率开始受到影响,当乳酸浓度升高到40 g/L 时,酵母菌存活率显著降低(P<0.05),为66.36%。重新解除乳酸胁迫后(乳酸添加量0 g/L),酵母菌存活率恢复到原有水平(P<0.05),为85.62%。表明这种抑制是可逆的,实际生产中也可通过降低糟醅过高的酸度一定程度恢复酵母的发酵活力。
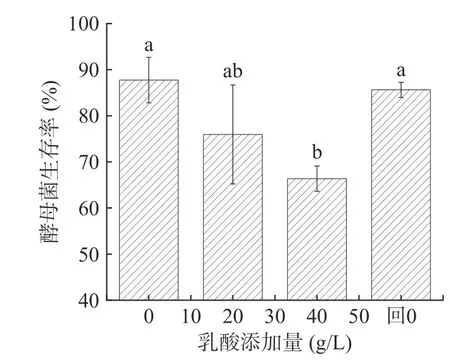
图2 乳酸浓度对P. kudriavzevii 菌株生长的影响Fig.2 Effects of lactic acid concentration on the growth of P.kudriavzevii
由图3 可知,乳酸浓度为20 g/L YNB 液体培养基中酵母的生存率下降且不显著,20 g/L 乳酸浓度对P.kudriavzevii菌株存活率影响较小;此外,浓香型白酒发酵过程中糟醅乳酸含量通常为10~20 g/kg[1]。因此,20 g/L 乳酸浓度可作为P.kudriavzevii菌株乳酸胁迫液体培养的适宜浓度。该浓度下固液态培养对酵母乳酸耐受性的响应差异。可以看出,添加20 g/L 乳酸的固态和液态培养基中,P.kudriavzevii菌株PY1 的存活率均有所下降,分别下降了11.80%和6.63%,但仅固态培养条件下的存活率下降达到显著水平,表明固态发酵条件下,P.kudriavzevii酵母对乳酸胁迫的响应更强,20 g/L 的乳酸已可显著抑制P.kudriavzevii生长。培养结束时,液态培养酵母菌菌落总数为107CFU/mL,固态培养为106CFU/g。
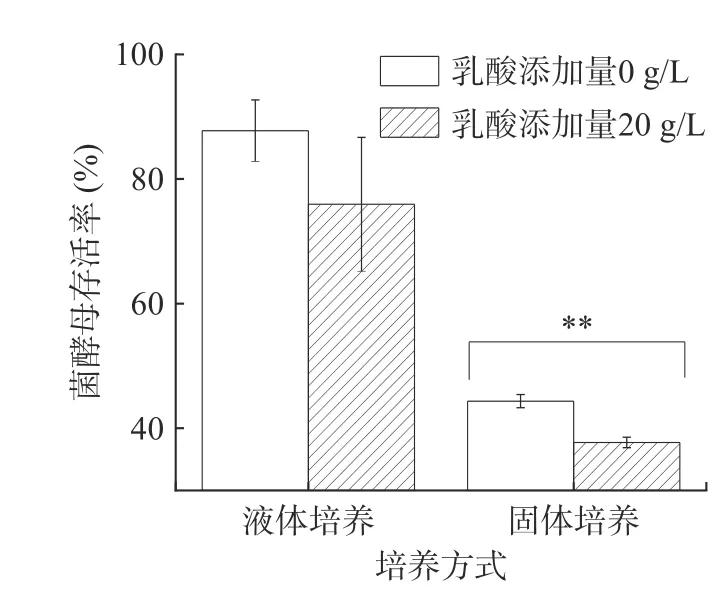
图3 乳酸胁迫下培养方式对P. kudriavzevii 酵母菌株生长的影响Fig.3 Effects of culture methods on the growth of P.kudriavzevii under lactic acid stress
2.2 乳酸与温度对P. kudriavzevii 生长的影响
白酒糟醅发酵期间窖内发酵最高温度可达50 ℃,能够耐受较高温度的酵母菌株更能适应浓香型白酒窖池内部环境[23]。图4 可以看出,在20 g/L乳酸、44 ℃高温共同作用下,P.kudriavzevii菌株仍能很好地生长(OD 值>0.5),表明该酵母能适应糟醅的高温高酸环境,但相较于对照组,20 g/L 的乳酸胁迫可显著抑制PY1 酵母菌株的生长(P<0.05);当温度升高至46 ℃以上,PY1 酵母菌株的生长受到明显抑制(OD 值<0.5),且这种抑制与是否存在20 g/kg 的乳酸胁迫无关,表明环境温度44 ℃以下,P.kudriavzevii的生长受乳酸和温度共同影响,且相同温度下乳酸胁迫可显著抑制酵母生长(P<0.05);温度超过一定范围时,P.kudriavzevii的生长主要受高温抑制,乳酸胁迫对其生长影响不显著。因此,浓香型白酒发酵应尽量控制糟醅温度低于44 ℃,乳酸浓度低于20 g/L。
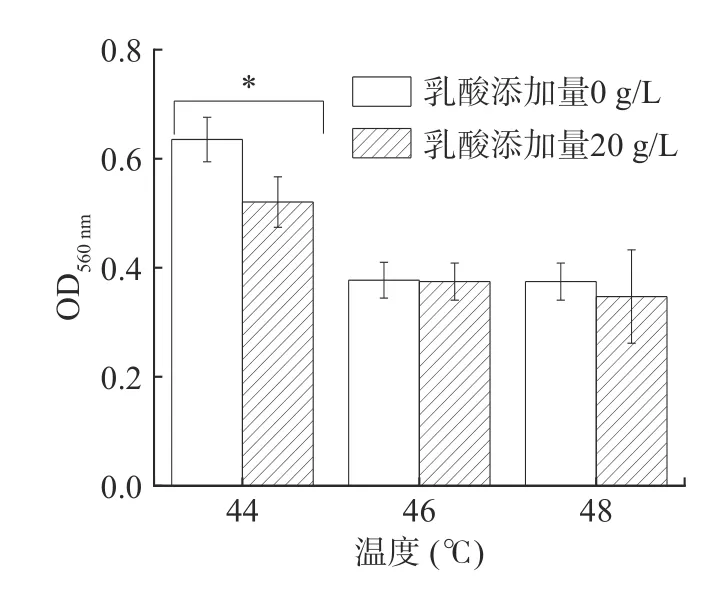
图4 乳酸胁迫下高温对P. kudriavzevii 菌株生长的影响Fig.4 Effect of high temperature on the growth of P.kudriavzevii under lactic acid stress
2.3 乳酸对P. kudriavzevii 菌株利用碳源的影响
由表1 可知,相同碳源乳酸胁迫下碳源利用率和对照组差异不显著;但乳酸胁迫下不同碳源利用率存在差异,其中D-半乳糖含量最低(3.27 g/L)、碳源利用率最高为34.60%。在添加20 g/L 乳酸胁迫条件下,P.kudriavzevii菌株对碳源的利用量均有不同程度的提升,其中葡萄糖利用率提高了1.2%、D-半乳糖提高了4.2%、麦芽糖提高了14.6%、果糖提高了6.2%、蔗糖提高了1.6%,可见乳酸胁迫对PY1 酵母菌株利用麦芽糖的影响最大,麦芽糖的利用率从9%上升到23.6%,表明乳酸胁迫可促进P.kudriavzevii菌株对碳源的利用,特别是对淀粉水解产物麦芽糖的利用,这有助于提升浓香型白酒糟醅的淀粉利用率,特别是在白酒发酵中后期随着乳酸菌的大量增殖,乳酸浓度逐渐上升[24],能够在乳酸环境下进一步利用各种碳源的P.kudriavzevii仍可持续发酵,榨干糟醅中的可发酵糖,这对提高浓香型白酒原料利用率有重要意义。
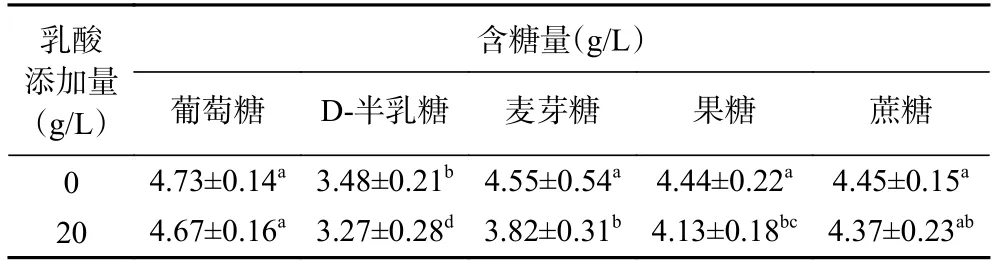
表1 乳酸胁迫对P. kudriavzevii 利用碳源的影响Table 1 Effect of lactic acid stress on carbon source utilization by P. kudriavzevii
2.4 乳酸胁迫下主要生长因子对P. kudriavzevii 菌株的促进作用
表2 为固态发酵条件下,不同生长因子对P.kudriavzevii菌株生长的促进作用(以酵母在560 nm处的吸光度增加值计)。结果显示7 种生长因子在有无乳酸胁迫的情况下均可促进P.kudriavzevii菌株生长,并且生长因子可在一定程度上削弱乳酸对P.kudriavzevii菌株生长的抑制作用,其中维生素B1对乳酸胁迫的纠正效果最明显(ΔOD560nm=0.342),表明添加维生素B1可能有助于改善发酵中后期优势酵母P.kudriavzeviiPY1 的生长情况,延长其发酵过程。

表2 生长因子对P. kudriavzevii 菌株生长的影响Table 2 Effects of growth factors on the growth of Pichia kudriavzevii
2.5 乳酸对P. kudriavzevii 菌株液态发酵主要挥发性代谢产物的影响
酵母菌在YNB 液体培养基中主要挥发性代谢产物的GC 分析结果如表3 所示。酵母菌发酵代谢产物与其利用的碳源有关,YNB 液体培养基不同于传统酿造环境可以用于酵母菌发酵前体物质较少,酵母菌在YNB 液体培养基中挥发性代谢产物种类较少,仅有甲醇、乙醛、乙醇、乙酸乙酯、异丁醇等几种,其中,乙酸乙酯含量随乳酸浓度的升高而降低,说明乳酸胁迫导致酵母菌的数量下降,已有研究发现,乙酸乙酯的生成与酵母菌关系密切[25-27],推测其为初级代谢产物,本研究也证实了这一点,可以看出,当乳酸添加量增加到40 g/L 时,乙酸乙酯含量最低(0.16 mg/L),乙酸乙酯的减量与酵母数量的减少有关,故该酵母菌株代谢产酯能力减弱。但在赋予P.kudriavzevii更丰富的发酵前体物质(五粮粉)后,P.kudriavzevii产酯能力明显提升,在同等条件下乙酸乙酯含量增加到1561.75 mg/L(表4)。随着乳酸胁迫作用的增强,异丁醇含量从0.34 mg/L 显著减少到0.13 mg/L(P<0.05),解除乳酸胁迫后异丁醇的含量减少,这也与表3 酵母菌株模拟生产应用结果相符,说明乳酸胁迫的作用可有效降低PY1 酵母的高级醇产量,有助于提升白酒的品质[28-29]。
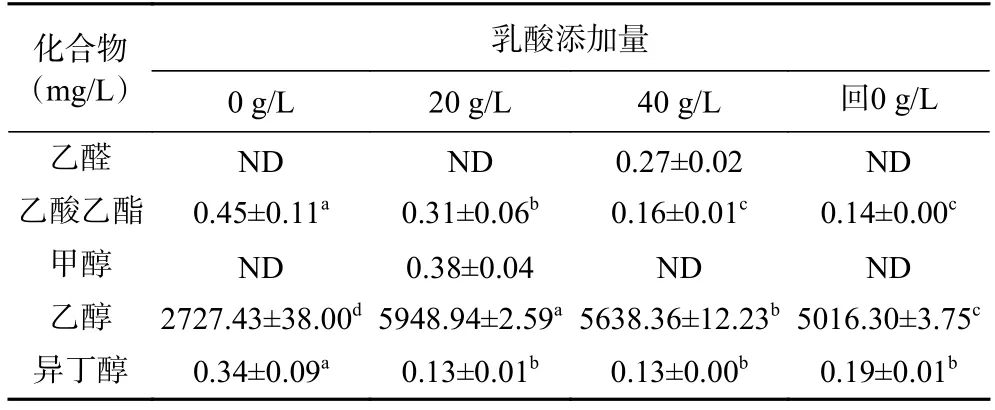
表3 乳酸对P. kudriavzevii 菌株YNB 培养基液态发酵主要挥发性代谢产物影响Table 3 Effects of lactic acid on volatile metabolites produced by YNB medium liquid fermentation of P. kudriavzevii
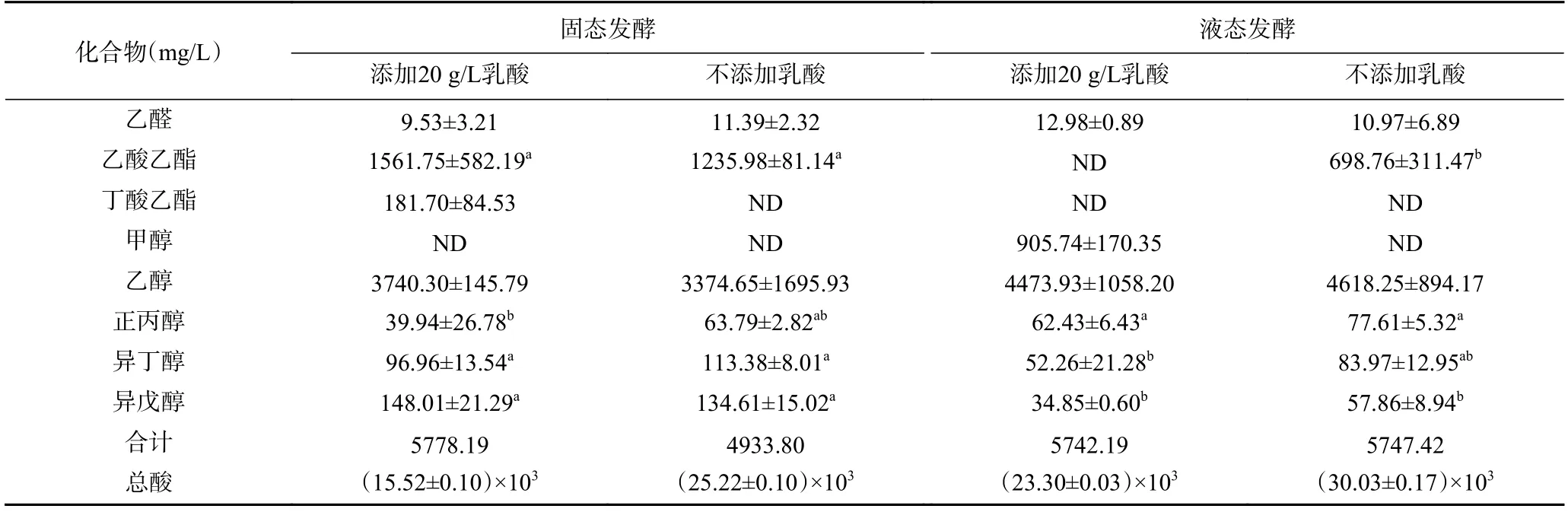
表4 P. kudriavzevii 菌株固液态发酵主要产物及含量Table 4 Main products and contents of solid and liquid fermentation of P. kudriavzevii
2.6 乳酸对P. kudriavzevii 菌株固态发酵主要挥发性代谢产物的影响
由表4 可知,添加乳酸的固、液态发酵结束时酸含量(以去除初始乳酸添加量计)分别为15.52 g/L和23.30 g/L,均低于不添加乳酸的对照组。说明20 g/L 乳酸胁迫的环境下,抑制了酸的产生,同时酵母菌株也将一部分代谢产生的酸类物质转化为酯类物质。主要产物气相色谱检测结果同见表4。
在乳酸胁迫情况下,固态发酵酵母菌株在乳酸胁迫的调控下,乙醛含量下降,有助于减少产品的刺激性气味且促进乙醇生成[29];P.kudriavzevii菌株固态发酵产乙醇3.740 g/L,较不添加乳酸的对照组增加了11%,产乙酸乙酯、丁酸乙酯分别为1561.75、181.70 mg/L,说明乳酸胁迫可提高P.kudriavzevii菌株固态发酵产乙醇及主要酯类香气成分的量,这也与其在YNB 培养基中的液态发酵结果一致。微生物多样性受到微生物数量和均匀度的影响,当某一微生物丰度较高时会影响其他种类微生物的生长,固态发酵低于其液态发酵乙醇含量,但固态发酵菌密度(106CFU/g)低于液态发酵(107CFU/mL),更有利于实现P.kudriavzevii菌株与其它微生物协同发酵。P.kudriavzevii菌株固态发酵均未检测出甲醇含量,兼具较高的安全性[30-31]。同时,该酵母菌株固态发酵产正丙醇、异丁醇、异戊醇的情况各有不同,对正丙醇,乳酸胁迫可显著增大固液态发酵糟醅中的正丙醇生成量差异,使固态发酵的正丙醇含量显著低于液态发酵;对异丁醇,该酵母固态发酵时的异丁醇生成量高于液态发酵,且乳酸可降低固液态发酵糟醅中的异丁醇生成量;而异戊醇的生成量则主要受发酵方式的影响,与是否存在乳酸胁迫无关。总体来看,乳酸胁迫对P.kudriavzevii产风味物质的影响因其发酵方式而不同,在液态发酵条件下,乳酸胁迫可显著降低P.kudriavzevii的乙酸乙酯产量,增加其甲醇产量;固态发酵条件下,乳酸胁迫对P.kudriavzevii产风味物质的影响相对较小,表明固态发酵方式可为乳酸胁迫提供更好的缓冲。
3 结论
本研究先通过P.kudriavzeviiPY-1 菌株存活率确定最适乳酸胁迫浓度20 g/L,且该浓度对酵母菌菌落形态与细胞形态无明显影响,但对细胞生长有一定抑制,在44 ℃温度以下,乳酸对温度均可抑制菌株生长,但在44 ℃以上,乳酸的影响不起主导作用。乳酸胁迫P.kudriavzevii菌株发酵特性影响结果如下:乳酸对P.kudriavzevii的可逆抑制作用可被一些生长因子削弱;乳酸胁迫也可提高酵母对葡萄糖、D-半乳糖、麦芽糖、果糖和蔗糖的利用率;菌株代谢产乙醇升高、异丁醇含量降低;应用此菌株模拟乳酸胁迫下白酒生产(固态发酵),酯类物质含量增高、高级醇含量降低,且均未检测出甲醇含量。P.kudriavzevii菌株兼具较高安全性和改善酒体品质的发酵潜能,有望成为一种极具商业潜力的白酒生产酵母。

