光动力技术对副溶血性弧菌的灭活作用
王晓迪,郑双芝,庞一,朱军莉,陆海霞
(浙江工商大学 食品与生物工程学院,浙江 杭州,310018)
副溶血性弧菌(Vibrioparahaemolyticus, Vp)广泛存在于鱼、虾、蟹和牡蛎等水产品中,是重要的水产品源致病菌[1-3]。传统热杀菌方式杀菌力强,但高温有时会对食品特别是水产品的营养、感官等方面产生不良影响。光动力技术(photodynamic technology, PDT)是一种新型的非热杀菌方法[4],当光敏剂被特定波长的光源激发后产生活性氧(reactive oxygen species, ROS)[5],ROS可以通过3种途径(生物膜破坏、蛋白质损伤、DNA损伤)导致细胞死亡[6]。姜黄素是从姜黄根茎中提取的叶黄素,在酸性至中性条件下较稳定,具有天然的光敏活性、高靶向性及分子识别功能,在蓝光(420~480 nm)下可被激活,因在人体中生物利用度低、安全无毒性被批准为食品添加剂[7-8]。由姜黄素介导的PDT绿色、安全、高效、杀菌谱广,可以杀灭单核增生李斯特菌[9]、腐败希瓦氏菌[10]、黄曲霉[11]、假单胞菌[12]、志贺氏菌[7]和诺如病毒[13]。
柠檬酸(citric acid, CA)是存在于柑橘类水果中的可食用酸,是食品、医药等领域应用最广泛的有机酸之一。柠檬酸本身抗菌活性较弱,常与其他技术结合达到协同抗菌作用[14]。柠檬酸结合蓝光光照对大肠杆菌O157∶H7、鼠伤寒沙门氏菌、单核细胞增生李斯特菌和金黄色葡萄球菌均可造成显著的损伤,但是需要光照处理7.5 h,pH值低至4.5[15],此方法尽管可以杀灭食品表面致病菌,但所需时间长,而且添加量高会对食品口感造成影响。
姜黄素PDT协同低浓度柠檬酸处理的优势在于柠檬酸进入细菌细胞后分解生成酸根离子(ROO-)和质子(H+),降低细胞内的pH值,影响细胞膜的渗透性和代谢机制,从而增加光敏剂对细胞的渗透率和细菌对姜黄素的敏感性,可以在更短时间(光照时间≤10 min)内达到更好的杀菌效果,同时不会过多降低食品pH值(pH 5.6),也可以降低姜黄素染色效应带来的的不良影响,而且姜黄素和柠檬酸都是安全的食品添加剂。因此本研究采用姜黄素介导的光动力杀菌协同柠檬酸处理灭活Vp,研究其灭菌机理,为其在食品领域的应用提供理论依据。
1 材料与方法
1.1 菌种与试剂
1.1.1 菌株
副溶血弧菌 ATCC 17802(Vp17802)购于上海保藏生物技术中心:http://www.shbcc.org.cn/。
1.1.2 试剂
食品级姜黄素(纯度>95%),陕西省宝鸡市扶风慈缘生物科技有限公司;柠檬酸(99.5%),阿拉丁试剂公司;LB肉汤、胰酪大豆胨琼脂(tryptose soya agar,TSA)、3% TSA、Baird-Parker琼脂、硫代硫酸盐-柠檬酸盐-胆盐-蔗糖(thiosulfate-citrate-bilesalts-sucroseagarmedium,TCBS)琼脂,杭州微生物试剂有限公司;活性氧(reactive oxygen species,ROS)、ROS荧光探针(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA,1 mmol/L),北京索莱宝生物技术有限公司;超微量腺苷三磷酸酶(ATPase)测试盒、碱性磷酸酶(alkaline phosphatase,AKP)测定试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒、总蛋白测定试剂盒,南京建成生物工程公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司。
1.1.3 仪器与设备
LED蓝光灯(波长429.5 nm,辐照度18.34 mW/cm2,灯管长度1.2 m),华宸照明;SpectraMax iD3 多功能酶标仪,杭州宝诚生物技术有限公司;SIGMA3-30K 高速冷冻离心机,美国Sigma公司;BIO-RAD 核酸电泳仪,伯乐生命医学产品(上海)有限公司;JS-680D全自动凝胶成像分析仪,上海培清科技有限公司;Nano Pro 2020超微量紫外可见分光光度计,北京鼎昊源科技有限公司,Hitachi SU-8010 扫描电子显微镜(scanning electron microscope,SEM),日立公司。
1.2 菌悬液、光敏剂及柠檬酸母液的制备
1.2.1 菌悬液的制备
将Vp划线于TCBS和Baird-Parker平板上,37 ℃培养24 h后挑取单菌落到含3 g/100 mL NaCl的LB肉汤中,37 ℃,180 r/min摇床振荡培养16 h至稳定期。取1.5 mL菌液10 000 r/min,4 ℃离心5 min弃上清液,沉淀用无菌生理盐水洗涤3次后加生理盐水重悬至1 mL,使菌悬液对数浓度为8~9 lg CFU/mL。
1.2.2 姜黄素及柠檬酸母液的配制
按照檀利军等[16]的方法制备4 000 μmol/L的姜黄素母液和1 000 μmol/L的姜黄素储备液。母液与储备液均4 ℃避光保存。柠檬酸母液:称取1 g柠檬酸用10 mL无菌水配制成0.1 g/mL的母液。
1.3 姜黄素PDT协同柠檬酸处理对Vp的杀菌效果
取100 μL菌悬液加入无菌生理盐水中,使菌液浓度为7~8 lg CFU/mL。在24孔板中加入姜黄素、100 μL菌液、柠檬酸溶液以及PBS/LB肉汤使孔板中溶液总体积为1 mL。在室温、黑暗条件下孵育10 min后,用LED蓝光灯照射,然后将菌液梯度稀释涂布于30 g/L NaCl TSA平板上,培养24 h后计数。
设置空白对照组(L-M-C-)、PDT组(L+M-C-)、酸处理组(L-M-C+)、姜黄素处理组(L-M+C-)、姜黄素加酸处理组(L-M+C+)和姜黄素PDT协同酸处理组(L+M+C+)。为考察介质及pH值对杀菌效果的影响分别在PBS缓冲液和30 g/L NaCl肉汤培养基中进行处理,具体如下:
PBS中:姜黄素摩尔浓度为0.5、2 μmol/L,光照时间为0.5、1、2 min。
LB肉汤(30 g/L NaCl)中:姜黄素摩尔浓度为2、4 μmol/L,光照时间为1、5、10 min。
CA处理组:添加CA至其质量浓度为0.5 mg/mL。
1.4 ROS的测定
取100 μL Vp菌悬液与姜黄素溶液(最终摩尔浓度分别为0、2、4、20 μmol/L)、柠檬酸溶液(终质量浓度为0或0.5 mg/mL)混合,加PBS使24孔板中溶液总体积为1 mL,黑暗条件下孵育10 min,分别光照0、5、10 min后,4 ℃、10 000 r/min离心5 min弃上清液,用PBS重悬,加入10 μL荧光探针DCFH-DA(终摩尔浓度为10 μmol/L),颠倒混匀使探针和细胞充分接触,37 ℃培养 20 min。用PBS洗涤3次后立即在485 nm激发波长、525 nm发射波长下测定荧光强度[17]。设置3组试验:L-M-C-、L-M+C+和L+M+C+。
1.5 姜黄素PDT协同柠檬酸处理对细胞中抗氧化酶的影响
过夜活化的菌液振荡均匀后,取100 μL菌悬液加入30 g/L NaCl的LB肉汤中,使菌体浓度为8 lg CFU/mL。设置4组试验:L-M-C-、L-M+C+、L-M-C+和L+M+C+,蓝光照射时间10 min。
1.5.1 CAT活性测定
样品分组处理后,加入钼酸铵迅速终止CAT分解H2O2的反应,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,在405 nm处测定其生成量,可计算出CAT的活力。同时测定各样品中蛋白质含量。定义反应体系中每毫升菌液每秒催化1 μmol H2O2为1个酶活力单位(U/mL)。
1.5.2 SOD活性测定
样品分组处理后,用WST-1法[18]测定细菌SOD活力(U/mg prot)。单位定义:在本反应体系中SOD抑制率达50%时所对应的酶量为一个SOD活力单位(U)。
1.6 姜黄素PDT协同柠檬酸处理对细菌细胞壁、膜结构和通透性的影响
1.6.1 ATPase活力测定
样品处理同1.5节,处理后的菌悬液用PBS洗涤重悬,超声细胞破碎仪破碎后测定ATPase活力。用超微量ATPase试剂盒测定各细胞破碎液中的ATPase活性,同时用考马斯亮蓝试剂测定各组样品中蛋白质含量[19]。
1.6.2 AKP活力测定
样品处理同1.5节,处理后的菌悬液2 500 r/min离心10 min,取上清液用超微量AKP试剂盒测定各样品AKP活性,同时测定各组样品中蛋白质含量。AKP活性用King unit/100 mL表示,定义为100 mL菌液与基质作用15 min产生1 mg酚为1金氏单位(King unit)。
1.6.3 SEM观察细菌形态变化
菌液经处理后移取至1.5 mL EP管中,10 000 r/min离心4 min,弃上清液,迅速用固定液(2.5%戊二醛)充分固定后在4 ℃冰箱放置过夜。经梯度体积分数(30%,50%,70%,80%,90%,95%和100%)乙醇连续脱水、临界点干燥、镀膜后SEM观察。
1.7 姜黄素PDT协同柠檬酸处理对细菌DNA的影响
将过夜活化的菌液振荡均匀后,取100 μL加入30 g/L NaCl LB肉汤中,使菌体浓度达到8 lg CFU/mL,设置5组试验:L-M-C-、L+M-C-、L-M-C+、L-M+C+和L+M+C+。用细菌基因组DNA提取试剂盒提取细菌的总DNA,进行琼脂糖凝胶电泳。
1.8 数据处理与统计分析
每组样品均设置3个平行,所得数据为3次平行试验结果的平均值。采用Origin 2019b软件作图并分析,通过SPSS Statistics 26软件进行单因素方差分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 姜黄素PDT协同柠檬酸处理对Vp的杀菌效果

a-PBS;b-3 g/100 mL NaCl LB肉汤图1 姜黄素介导的PDT协同柠檬酸处理对PBS和 30 g/L NaCl LB肉汤中Vp的杀菌效果Fig.1 The inactivation effect of curcumin- mediated PDT combined with citric acid on V.parahaemolyticus in PBS and 30 g/mL NaCl LB 注:“-”的表示无相应处理,“+”表示进行相应处理; 不同字母表示差异显著(P<0.05)(下同)。
姜黄素PDT协同柠檬酸处理对PBS/LB两种介质中Vp的影响如图1所示。菌悬液加柠檬酸后,PBS和30 g/L NaCl LB肉汤中的pH值分别从7.4、7.0下降至5.6、4.8。结果表明,L+M-C-,L-M-C+,L-M+C-3组单一因素和姜黄素协同柠檬酸(L-M+C+)处理后 Vp菌落总数与空白对照组(L-M-C-)无显著差异(P<0.05);姜黄素介导PDT(L+M+C-)杀菌效果增强,且随姜黄素浓度增加而增强;姜黄素介导PDT协同柠檬酸(L+M+C+)处理组显著杀灭Vp(P<0.05),杀菌效果随姜黄素浓度的增加和光照时间延长而增强,同时与柠檬酸表现出协同作用,在PBS中Vp下降了7.43 lg CFU/mL。在LB肉汤中要达到与在PBS中类似的杀菌效果则需提高姜黄素的浓度并延长光照时间,添加柠檬酸同样有显著协同效应,但是在LB肉汤中Vp耐受性更强,主要是因为LB培养基中的营养物质干扰姜黄素对蓝光的吸收,降低了光动力的杀菌效率。但同时LB肉汤缓冲pH的作用没有PBS强,而Vp对酸较敏感,有研究表明柠檬酸饮料对弧菌有强烈的抑制作用,一是pH值的影响,二是其阴离子具有独特的杀菌功能[20]。因此添加柠檬酸对LB肉汤中Vp的协同杀菌效果极为显著。由此可见,延长光照时间、增加光敏剂浓度、协同柠檬酸处理均可以增强PDT灭活效果。本研究中柠檬酸对PDT杀菌的增强作用可能来自两方面:1)增加细菌对光敏剂姜黄素的敏感性;2)提高姜黄素本身的光活性。柠檬酸降低细胞内pH值并影响细胞质环境[21],增强姜黄素的渗透以及细菌对姜黄素光活性的敏感性,产生更强的抗菌光活性。而且从另一个角度来看,酸性环境还可以提高姜黄素在水中的稳定性和溶解度,直接增强了姜黄素的抗菌光活性[22]。LI等[23]研究了姜黄素壳聚糖对金黄色葡萄球菌及其在不锈钢表面生物膜的光动力学杀菌效果,结果也表明,姜黄素浓度、孵育和光照时间是影响细菌光动力失活的主要因素。DE OLIVEIRA等[24]用姜黄素结合长波黑斑效应紫外线(ultraviolet radiation A)灭活大肠杆菌O157∶H7和李斯特菌,通过添加柠檬酸来增强杀菌效果,使姜黄素溶液pH值从6降到2.5,再经UV-A光照5 min后,大肠杆菌O157∶H7和单增李斯特菌都减少了5 lg CFU/mL,说明酸性环境有利于姜黄素的杀菌。另有研究表明,没食子酸和乳酸也能影响大肠杆菌O157∶H7的细胞膜渗透性和代谢机制,与UV-A光结合,可以导致细菌失活[25]。
2.2 姜黄素PDT协同柠檬酸处理诱导产生ROS及对细菌抗氧化酶活性的影响
光敏剂吸收光子被激发后到达三重态的激发态,通过Ⅰ型和Ⅱ型光动力反应生成超氧阴离子(·O2-)、H2O2、羟自由基(·OH)等ROS和单线态氧(1O2),使细胞死亡[6],如图2-a所示。L-M+C+组与空白对照组相比ROS水平没有显著提升,说明姜黄素必须被蓝光激发才能产生ROS。提高姜黄素的浓度(2、4 μmol/L)、延长光照时间(5、10 min)、加柠檬酸(0.5 mg/mL)等都会导致体系中 ROS的水平显著提高(P<0.05)。FREITAS等[26]用姜黄素光动力处理金黄色葡萄球菌,发现姜黄素浓度不变时,随光照时间的延长,ROS生成量增加。ROS量与菌落计数结果呈负相关,即随姜黄素浓度增加、光照时间延长及柠檬酸的添加,菌体内ROS水平不断升高,菌落总数不断降低。
CAT和SOD都是细菌体内重要的抗氧化酶,这些抗氧化酶共同作用,防止细胞内ROS水平过高[27]。Vp的CAT活力如图2-b所示。是否协同柠檬酸处理对CAT活力影响更大,高浓度姜黄素PDT协同柠檬酸处理后,Vp的CAT完全失活(P<0.05)。Vp的SOD活力如图2-c所示。SOD活力受姜黄素浓度影响更显著,SOD活力与姜黄素浓度呈剂量依赖性。低浓度姜黄素PDT处理Vp使SOD活力略微增加,这是SOD对少量ROS的应激响应[28],但随着姜黄素浓度的升高SOD活力最高下降了89.75%。由此可知:PDT处理时,提高姜黄素浓度及添加柠檬酸会使SOD和CAT活力下降,高浓度姜黄素协同柠檬酸处理时酶活力下降更显著(P<0.05)。
KHAN等[29]用核黄素作为光敏剂光动力处理大肠杆菌时也发现类似现象,与只核黄素处理和单光照处理的样品相比,暴露于光照下核黄素处理的样品中SOD和CAT显著降低。韩启明等[30]研究发现低浓度姜黄素光动力处理大肠杆菌和金黄色葡萄球菌会导致两种菌SOD活力略微上升,但随着光敏剂浓度上升酶活力又会下降,这是酶对适量ROS的应激响应及因氧化爆发超过细菌抗氧化能力,最终破坏酶的空间结构,与本文结果一致。

a-ROS量;b-CAT活力;c-SOD活力图2 姜黄素介导的PDT协同柠檬酸处理对Vp细胞中产生的ROS量、体内CAT活力、SOD活力的影响Fig.2 Effects of curcumin- mediated PDT combined with citric acid on concentration of ROS and activities of CAT or, SOD in V.parahaemolyticus
2.3 姜黄素PDT协同柠檬酸处理对细胞壁、膜通透性的影响
2.3.1 对细胞壁、膜通透性的影响
ATPase是生物膜上的一种极其重要的蛋白酶,对维持细胞的正常生理功能起着必不可少的作用。当细胞受损或死亡时,ATP含量迅速下降,可通过测定细胞中ATPase活性来反映细胞膜的损伤[31]。由图3-a可以看出,PDT处理后Vp的ATPase活性均显著降低(P<0.05)。PDT处理时,提高姜黄素浓度和添加柠檬酸会使ATPase活力下降,在高浓度姜黄素PDT协同柠檬酸处理时ATPase活性下降最多,细胞膜损伤更严重。L+M+C+处理组与空白对照组相比Vp的Na+/K+-ATPase和Ca2+/Mg2+-ATPase活性分别下降了97.98%和97.34%。细菌中的AKP通常位于细胞膜和细胞壁中间,只有当细胞壁受损时,才会泄漏到胞外。因此,可通过测定上清液中AKP含量反映细菌细胞壁的完整性。由图3-b可知,与空白对照组相比,添加柠檬酸的处理都可以显著增加Vp细胞壁通透性(P<0.05)。不光照仅姜黄素联合柠檬酸处理后,与对照组相比两种菌的AKP活性都有上升,甚至高于姜黄素光动力处理组,但仍比姜黄素PDT协同柠檬酸处理组的AKP活性低(P<0.05),表明这些处理均对细胞壁造成损伤。经高浓度姜黄素PDT协同柠檬酸处理10 min后,与空白对照组相比AKP活性上升了0.28 King unit/100 mL。由此可知,PDT处理时,提高姜黄素浓度和添加柠檬酸会使上清液中AKP活力上升,在高浓度姜黄素PDT协同柠檬酸处理时,上清液中AKP活性上升最多,细胞壁损伤最严重。
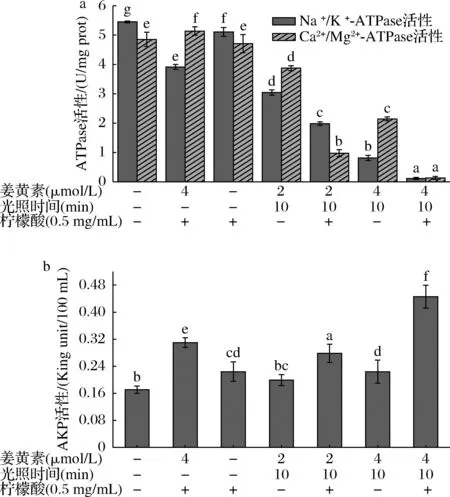
a-姜黄素介导的PDT复合柠檬酸处理后对Vp ATPase活性的影响; b-姜黄素介导的PDT复合柠檬酸处理后对Vp上清液中 AKP活性的影响图3 姜黄素介导的PDT协同柠檬酸处理后对 Vp细胞中ATPase和上清液中AKP活性的影响Fig.3 Effects of curcumin-mediated PDT combined with citric acid on ATPase activity in V.parahaemolyticus and AKP activity in supernatant
2.3.2 SEM观察细胞微观结构
为进一步探究PDT各处理对Vp的作用机理,通过SEM对细菌形态进行观察,结果如图4所示。与空白对照组相比,经姜黄素PDT处理后,Vp发生形变,出现更深的凹槽和褶皱(图4-b)。再协同柠檬酸处理,由于细胞膜被破坏导致内容物流失严重,Vp呈现扁平破损状态(图4-c)。

a-L-M-C-;b-L+M+C-;c-L+M+C+图4 姜黄素介导的PDT协同柠檬酸处理对Vp 细胞形态的影响Fig.4 Effects of curcumin-mediated PDT combined with citric acid on cell morphology of V.parahaemolyticus 注:光照时间均为10 min(图5同)。
2.4 姜黄素PDT协同柠檬酸处理对细菌DNA的损伤
光动力处理后 Vp基因组 DNA 琼脂糖凝胶电泳如图5所示。与对照组相比,低浓度姜黄素PDT组的 DNA条带稍微变暗,高浓度姜黄素PDT组的DNA条带变暗更明显,从总体水平来看,Vp经过姜黄素PDT处理后,DNA均有损伤(图5)。高浓度姜黄素PDT协同柠檬酸处理后A3泳道已经没有条带出现说明Vp已完全受损,与计数结果相吻合。有研究发现,PDT会导致某些细菌DNA的严重损伤,包括Vp、大肠杆菌、铜绿假单胞菌和单核细胞增生李斯特氏菌等[32]。

A1-2 μmol/L姜黄素;A2-4 μmol/L姜黄素; A3-4 μmol/L姜黄素+0.5 mg/mL CA图5 姜黄素介导的PDT协同柠檬酸处理前后 Vp DNA琼脂糖凝胶电泳图谱Fig.5 DNA agarose gel electrophoresis map of V.parahaemolyticus before and after treatment by curcumin-mediated PDT combined with citric acid
3 结论
姜黄素介导的PDT杀菌效果具有姜黄素浓度和光照时间依赖性,同时姜黄素介导的PDT协同柠檬酸处理表现出更好的杀菌效果,当姜黄素PDT协同低浓度柠檬酸共同处理时,既避免了在实际应用到食品中时高浓度的姜黄素对食品的颜色造成影响,也解决了姜黄素在食品基质中的溶解度低影响杀菌效果的问题,还不会因添加过高的柠檬酸使食品的pH值降低太多。PDI协同CA处理对Vp的灭活机理主要是姜黄素吸收430 nm的蓝光被激发到更高的能量状态,通过电子转移和能量转移产生具有强氧化性ROS,进而破坏细胞壁、膜、DNA,改变酶活力(ATPase、抗氧化酶CAT、SOD活力下降,AKP活力上升等),扰乱细胞的正常生理功能,并最终导致细胞壁、膜破损进而裂解死亡。同时PDT协同柠檬酸处理可以有效清除Vp生物被膜。
本研究为姜黄素介导的PDT协同CA处理应用于控制不适合或不进行热杀菌的食品中Vp的污染提供了理论依据。