疏花蔷薇花总多酚提取工艺优化及其抗氧化活性
郭瑛,赵文惠,李安林,冯倩倩,田莉,3*
(1.新疆医科大学中医学院,新疆乌鲁木齐 830011;2.新疆医科大学中心实验室,新疆乌鲁木齐 830011;3.新疆名医名方与特色方剂学重点实验室,新疆乌鲁木齐 830017)
疏花蔷薇(RosalaxaRetz.)属于蔷薇科灌木植物,在新疆阿尔泰山区、额敏河谷平原、准噶尔山区以及沿天山一带广泛分布,其多生于海拔500~1 200 m 的平原荒漠、砾质河滩地、灌丛、戈壁荒地、盐碱地、干沟边或河谷旁[1]。疏花蔷薇耐干旱、耐瘠薄、耐寒、抗病虫、抗逆性强,其株型优美,净化空气能力强,同时花开繁密、色白清雅,现为新疆一种主要的园林景观灌木[2]。疏花蔷薇的花蕾或初开的花可以作为茶饮,具有清热解毒、活血、止痛等功效,可用于治疗感冒、发烧、延缓衰老和癫痫发作[3]。目前,疏花蔷薇花作为新疆特色植物资源尚未被有效开发利用。
多酚类化合物广泛分布于自然界植物中,包括酚酸类、黄酮类、花色苷类等芳环上连有多个酚羟基的化合物,其所含酚羟基易与自由基发生反应具有抗氧化作用[4]。鞣花酸是广泛存在于植物中的一种天然多酚成分,具有良好的抗氧化特性,被广泛应用于食品、医药领域[4⁃6]。本课题组前期研究发现,疏花蔷薇花含有鞣花酸、没食子酸、儿茶素等多酚成分,其中鞣花酸含量最高,目前,对疏花蔷薇花的化学成分及药效研究尚无文献报道。本研究采用单因素试验结合响应面法优化疏花蔷薇花总多酚的提取工艺,以疏花蔷薇花总多酚、鞣花酸和浸膏得率的综合评分为考察指标,并评价其抗氧化活性,以期为该资源的开发研究提供参考。
1 材料与方法
1.1 材料与试剂
疏花蔷薇花:2022年6月采自于乌鲁木齐市雅玛里克山,经新疆医科大学徐海燕教授鉴定为蔷薇科(Rosaceae)植物疏花蔷薇(RosalaxaRetz.)的花,置于阴凉通风处阴干。
鞣花酸、没食子酸(纯度>98%):成都曼思特公司;维生素C:成都市科龙化工试剂厂;1,1⁃二苯基⁃2⁃三硝基苯肼(1,1⁃diphenyl⁃2⁃picrylhydrazyl radical,DPPH)、2,2′⁃联氮⁃双⁃3⁃乙基苯并噻唑啉⁃6⁃磺酸[2,2′⁃azino⁃bis(3⁃ethylbenzothiazoline⁃6⁃sulfonic acid),ABTS]:上海麦克林生化科技有限公司;铁氰化钾、三氯乙酸、三氯化铁:天津市盛奥化学试剂有限公司;磷酸缓冲液:武汉赛维尔生物科技有限公司;无水乙醇:天津市致远化学试剂有限公司;无水甲醇、甲酸(均为色谱纯):中国湖北弗顿科学技术有限公司。除特殊说明外,均为分析纯。
1.2 仪器与设备
SL⁃200 高速多功能粉碎机:浙江省永康市松青五金厂;1200 高效液相色谱仪:美国安捷伦科技公司;722S可见分光光度计:上海菁华科技仪器有限公司;XS105电子天平:瑞士梅特勒⁃托利多仪器有限公司;KQ⁃5200DE数控超声波清洗仪:昆山市超声仪器有限公司。
1.3 方法
1.3.1 总多酚含量测定
疏花蔷薇花经高速多功能粉碎机粉碎,过80 目筛,制得疏花蔷薇花粉末。参照文献[7⁃8]的方法测定疏花蔷薇花粉末中总多酚的含量。
1.3.2 鞣花酸含量测定
1.3.2.1 对照品溶液的制备
精密称取鞣花酸对照品10.00 mg,加入甲醇溶解,稀释至浓度为1.00 mg/mL 的鞣花酸对照品储备液。
1.3.2.2 鞣花酸的色谱条件
色谱柱为ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 µm);流动相为甲醇(A)⁃0.1% 甲酸水(B),等度洗脱:0~10 min,50%A;检测波长:254 nm;流速1.0 mL/min;柱温30 ℃;进样量为10µL。
1.3.2.3 线性考察
精密吸取1.3.2.1 项下鞣花酸对照品储备液适量,用甲醇稀释制成质量浓度分别为5、10、25、50、75、100 µg/mL 的系列浓度溶液,按照1.3.2.2 项下条件测定,记录峰面积。以鞣花酸的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.2.4 精密度、重复性和稳定性考察
取1.3.2.3 项下溶液,按照1.3.2.2 项下条件重复测定6 次,记录峰面积,并计算相对标准偏差(relative standard deviation,RSD)值,考察仪器的精密度。
称取疏花蔷薇花粉末约2.000 0 g,平行6 份,按照1.3.2.2 项下条件测定,记录峰面积,并计算RSD 值,考察样品的重复性。
取疏花蔷薇花供试品溶液,按照1.3.2.2 项下条件分别在0、4、8、12、16、20、24 h 测定,记录峰面积,并计算RSD 值,考察鞣花酸的稳定性。
1.3.2.5 加样回收率
精密称取疏花蔷薇花约2.000 0 g,平行6 份,加入一定量的鞣花酸,按照1.3.2.2 项下条件测定,计算加样回收率。
1.3.3 供试样品提取方法考察
精密称取疏花蔷薇花粉末约2.000 0 g,平行9 份,分为3 组,3 份/组,考察浸渍、超声和回流3 种提取方法的提取效率。以50% 乙醇为提取溶剂,料液比1∶20(g/mL),分别按照浸渍提取12 h、超声辅助提取60 min、回流提取60 min,提取液均过滤,续滤液蒸干,称重;再分别称取适量浸膏,用50%乙醇溶液复溶,分别按1.3.1 和1.3.2.2 项下方法测定总多酚和鞣花酸的含量,按下列公式计算浸膏得率和综合评分。
p=m/M×100
C=(x/X)×0.4×100+(y/Y)×0.4×100+(p/P)×0.2×100
式中:p为浸膏得率,%;m为浸膏质量,g;M为药材质量,g;C为综合评分;x为总多酚含量,mg/g;X为最大总多酚含量,mg/g;y为鞣花酸含量,mg/g;Y为最大鞣花酸含量,mg/g;P为最大浸膏得率,%。
1.3.4 样品回流次数的选择
精密称取疏花蔷薇花粉末约2.000 0 g,平行12份,分为4 组,3 份/组,以50% 乙醇为回流提取溶剂,料液比1∶20(g/mL),回流提取60 min,分别回流提取1、2、3、4 次,所得提取液以总多酚含量、鞣花酸含量及浸膏得率的综合评分为考察指标,考察不同回流次数的提取效果。
1.3.5 疏花蔷薇花总多酚提取工艺单因素试验
以总多酚含量、鞣花酸含量及浸膏得率的综合评分为指标,分别考察回流时间(30、60、90、120、150 min)、乙醇体积分数(20%、35%、50%、65%、80%)、料液比[1∶15、1∶20、1∶25、1∶30、1∶35(g/mL)]对综合评分的影响[9⁃11]。
1.3.6 响应面优化疏花蔷薇花总多酚提取工艺试验
根据单因素试验结果,确定响应面的自变量范围。精密称取疏花蔷薇花粉末约2.000 0 g,采用Box⁃Benhnken 试验设计,以响应面试验优化疏花蔷薇花总多酚提取工艺参数[12⁃13],因素水平见表1。

表1 试验因素与水平Table 1 Factors and levels of experiment
1.3.7 工艺验证
精密称取疏花蔷薇花粉末约2.000 0 g,平行3 份,按1.3.6 项下提取优化工艺参数进行工艺验证,按照1.3.3项下公式计算综合评分,并与模型拟合值进行比较。
1.3.8 疏花蔷薇花总多酚提取物的抗氧化活性研究
精密称取疏花蔷薇花总多酚提取物和维生素C 适量,以55%乙醇溶解,分别制得0.002 0、0.006 0、0.010 0、0.020 0、0.050 0、0.100 0、0.200 0 mg/mL 系列浓度供试品溶液。
1.3.8.1 DPPH 自由基清除能力
分别精密量取0.1 mg/mL DPPH 溶液1.0 mL 和系列浓度供试品溶液1.0 mL,混匀,作为样品溶液;取55% 乙醇1.0 mL 与系列浓度供试品溶液1.0 mL,混匀,作为自身对照溶液;取无水乙醇1.0 mL 与DPPH溶液1.0 mL,混匀,作为空白对照溶液。样品溶液、自身对照溶液、空白对照溶液均常温避光反应30 min,在517 nm 波长处测定,吸光度依次为A1、A2、A0,均重复测定3 次,取平均值,并以相同浓度的VC作为阳性对照,计算DPPH 自由基清除率(X,%)[14]和IC50值,公式如下。
X=[A0-(A1-A2)]/A0×100
1.3.8.2 ABTS+自由基清除能力
精密量取7 mmol/L 的ABTS 溶液10 mL 和2.45 mmol/L 的K2S2O8溶液10 mL,混匀,室温避光条件放置12 h,制得ABTS 母液;再用无水乙醇稀释ABTS 母液直至其在734 nm 波长处的吸光度为0.70±0.02,制得ABTS 工作液。分别精密量取ABTS 工作液2 mL 与系列浓度供试品溶液0.15 mL,混匀,作为样品溶液;取55% 乙醇2 mL 与和系列浓度供试品溶液0.15 mL,混匀,作为自身对照溶液;取ABTS 工作液2 mL 与无水乙醇0.15 mL,混匀,作为空白对照溶液。样品溶液、自身对照溶液、空白对照溶液均常温避光反应15 min,在734 nm 波长处测定,吸光度依次为A1、A2、A0,均重复测定3 次,取平均值,并以相同浓度的VC作为阳性对照,计算ABTS+自由基清除率(Y,%)[15]和IC50值,公式如下。
Y=[A0-(A1-A2)]/A0×100
1.3.8.3 还原能力
分别量取系列浓度供试品溶液1.0 mL,依次加入磷酸盐缓冲液(0.2 mol/L,pH6.6)2.5 mL,1% 铁氰化钾溶液2.5 mL,混匀,50 ℃水浴20 min,加入10%三氯乙酸2.5 mL,5 000 r/min 离心5 min,取2.5 mL 上清液,依次加入3% 三氯化铁溶液0.5 mL 和纯水2.5 mL。在700 nm 波长处测定吸光度,重复测定3 次,取平均值,以相同浓度的VC溶液作为阳性对照,用吸光度表示还原力的大小[16]。
1.4 数据处理
采用Design Expert 13.0.1 分析数据,并对试验结果进行多元回归拟合。
2 结果与分析
2.1 总多酚含量的方法学考察
2.1.1 线性关系考察
以没食子酸对照品溶液浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,回归方程为y=110x+0.000 2(r=0.999 6),表明在1.5~7.5µg/mL 浓度范围内线性关系良好。
2.1.2 精密度、稳定性、重复性试验和加样回收率试验
精密度测定的RSD 为0.20%,表明仪器精密度良好;稳定性RSD 为1.34%,表明供试品溶液在1 h 内稳定性良好;重复性RSD 为0.35%,表明方法的重复性良好;加样回收率RSD 为2.07%,表明本检测方法准确。
2.2 鞣花酸含量的方法学考察
2.2.1 专属性考察
在建立的色谱条件下,鞣花酸与相邻色谱峰分离度大于1.5,对称因子在0.95~1.05,理论塔板数不低于5 000,色谱图见图1。
2.2.2 线性关系考察
以鞣花酸对照品溶液的质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,回归方程为y=14.92x-15.62(r=0.999 9),在5~100 µg/mL 范围内线性关系良好。
2.2.3 精密度、稳定性、重复性试验
精密度RSD 为1.41%,结果表明仪器精密度良好;稳定性RSD 为1.61%,表明供试品溶液在24 h 内稳定;重复性RSD 为3.48%,表明本法重复性符合要求。
2.2.4 加样回收率试验
鞣花酸加样回收率的RSD 为2.32%,表明该检测方法准确,加样回收率见表2。

表2 加样回收率结果Table 2 Results of sample adding recovery
2.3 提取方法选择
不同提取方法对提取综合评分的影响见表3。

表3 提取方法测定Table 3 Extraction method determination
由表3 可知,回流提取法的综合评分最高,因此采用回流提取法提取样品。
2.4 回流次数选择
不同回流次数对综合评分的影响见表4。
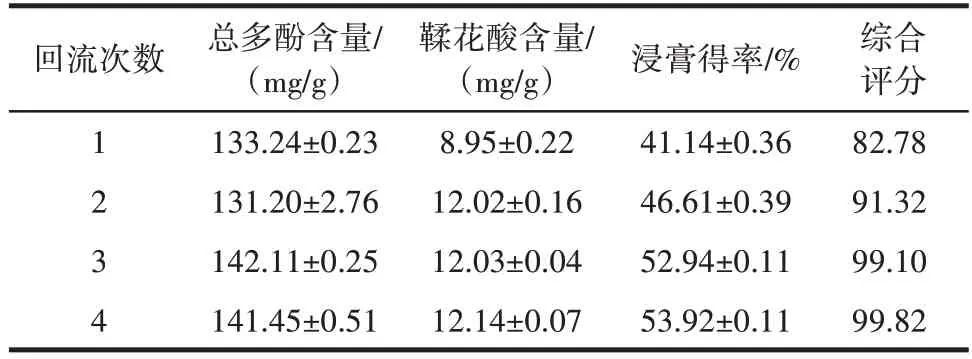
表4 回流次数考察Table 4 Number of withdrawals examined
由表4 可知,为了综合考虑能耗、试剂损耗以及工作时间,确定回流次数为2 次。
2.5 单因素试验结果
各因素提取疏花蔷薇花总多酚的综合评分见图2。
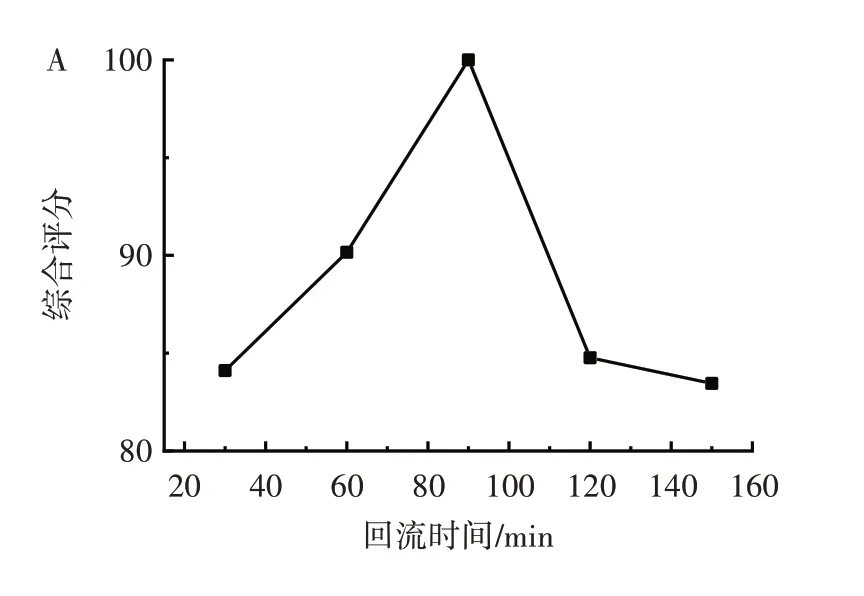
图2 各因素提取疏花蔷薇花总多酚的综合评分Fig.2 Comprehensive score of total polyphenol extraction effi⁃ciency of Rosa laxa Retz.flowers
由图2 可知,当回流时间为30~90 min 时,综合评分随时间延长而持续增加,继续延长回流时间,综合评分随时间延长明显下降,回流提取90 min 时综合评分最高[17]。当乙醇体积分数从20%升至50%,综合评分明显上升,之后再增大乙醇体积分数,综合评分下降,乙醇体积分数为50% 时综合评分最高[18]。当料液比从1∶15(g/mL)增大到1∶20(g/mL)时,综合评分随之增加,之后再增大料液比,其综合评分缓慢降低[19],确定料液比为1∶20(g/mL)时综合评分最高。
2.6 响应面试验结果及分析
2.6.1 响应面试验结果
疏花蔷薇花提取工艺的响应面试验设计结果见表5。

表5 响应面试验设计与结果Table 5 Experimental design and results of response surface method
2.6.2 模型拟合及方差分析
采用Box⁃Benhnken 13.0.1 软件拟合各因素,根据已确立的模型,绘制各影响因素对综合评分影响的3D响应面及等高线,如图3所示。响应面回归模型方差分析见表6。
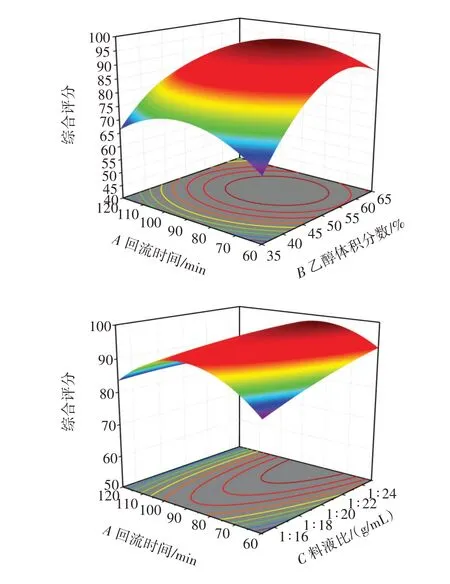
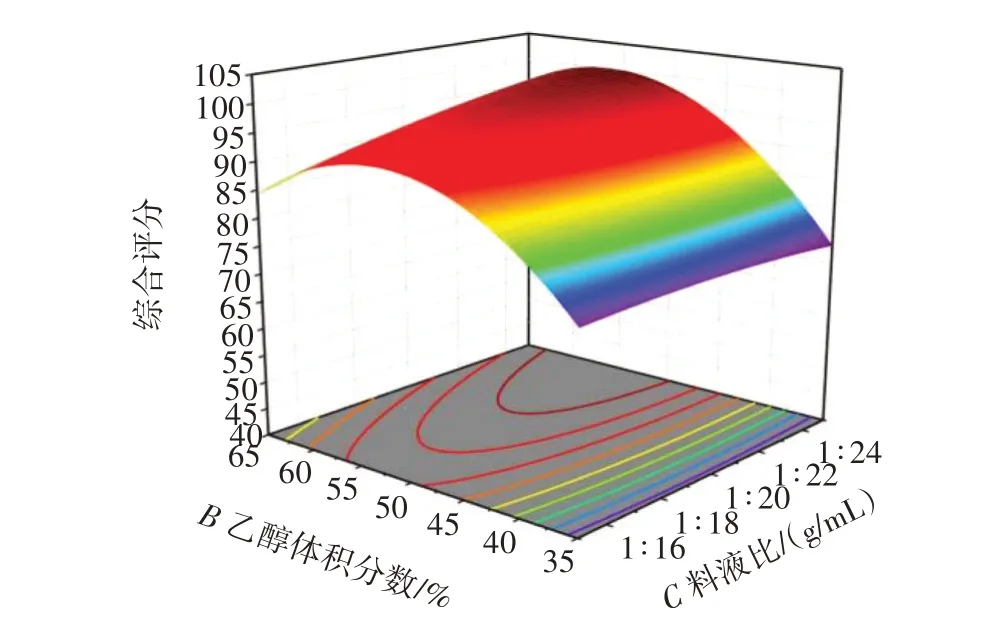
图3 各因素交互作用对综合评分影响的响应面图Fig.3 Response surface diagram of the influence of each element interaction on comprehensive score

表6 响应面回归模型方差分析Table 6 Variance analysis of response surface regression model
所得二项式回归模型为综合评分=96.09-1.79×A+8.11B+2.64C-3.34AB-2.76AC+3.11BC-9.98A2-13.26B2-0.987 0C2,由方差分析结果和拟合后的二次多项回归方程系数显著性检验可知,模型一次项B极显著(P<0.01),C显著(P<0.05),A不显著;二次项A2、B2极显著(P<0.01),C2不显著;交互项AB、BC显著(P<0.05),AC不显著。从F值可知单因素的影响顺序B>C>A,即乙醇体积分数>回流时间>料液比。
2.6.3 响应面优化预测
利用Design Expert 13.0.1 软件,优选疏花蔷薇花总多酚提取各影响因素的最佳取值为乙醇体积分数55.189%、料液比1∶23.849(g/mL)、回流提取88.881 min。为便于实际操作,调整提取工艺参数为乙醇体积分数55%,料液比1∶25(g/mL),回流提取2 次,90 min/次。
2.6.4 3批样品工艺验证
疏花蔷薇花总多酚提取结果显示,浸膏得率为(51.36±0.78)%,总多酚含量为(141.36±2.07)mg/g,鞣花酸含量为(13.46±0.14)mg/g,综合得分为98.56,RSD值为1.05%,与预测值99.76 的平均偏差为1.20%,表明验证结果与预测值吻合良好。
2.7 抗氧化结果及分析
疏花蔷薇花总多酚提取物对DPPH 自由基和ABTS+自由基的清除能力及还原能力如图4所示。

图4 疏花蔷薇花总多酚提取物的抗氧化能力Fig.4 Antioxidant capacity of total polyphenol extracts from Rosa laxa Retz.flowers
由图4A 可知,疏花蔷薇花总多酚提取物浓度在0.002~0.05 mg/mL 时,随着浓度增加,其对DPPH 自由基清除率明显增加,呈较强的剂量依赖性[20⁃22];当浓度超过0.05 mg/mL 时,清除率增长趋势变缓。疏花蔷薇花总多酚提取物的DPPH 自由基清除能力略低于VC,两者的IC50值分别为0.02 mg/mL 和0.01 mg/mL。
由图4B 可知,疏花蔷薇花总多酚提取物浓度在0.002~0.100 mg/mL 时,随着浓度增加,其对ABTS+自由基的清除率明显增加,呈较强的剂量依赖性,当浓度超过0.100 mg/mL 时,清除率增长趋势变缓[16]。疏花蔷薇花总多酚提取物的ABTS+自由基清除能力略低于VC,两者的IC50值分别为0.03 mg/mL 和0.02 mg/mL。
由图4C 可知,随着浓度增加,疏花蔷薇花总多酚提取物的还原能力不断增强,并呈明显的剂量依赖性[23]。相同浓度下(0.04~0.16 mg/mL),VC的还原能力明显高于疏花蔷薇花总多酚提取物。
综上所述,疏花蔷薇花总多酚提取物的抗氧化能力存在明显的剂量关系,与VC相比,具有较强的抗氧化活性。
3 结论
本研究在单因素试验的基础上,采用响应面法优化疏花蔷薇花总多酚和鞣花酸的提取工艺条件,最终确定疏花蔷薇花总多酚的最佳提取工艺参数为回流提取2 次、每次90 min、乙醇体积分数为55%、料液比为1∶25(g/mL),同时在最优工艺的下进行了3 次工艺验证,浸膏得率为(51.36±0.78)%、总多酚含量为(141.36±2.07)mg/g、鞣花酸含量为(13.46±0.14)mg/g,综合评分为为98.56。疏花蔷薇花对DPPH 自由基和ABTS+自由基清除率最高值分别为92.06% 和98.65%,还原能力较强。结果表明,疏花蔷薇花具有较好的体外抗氧化活性,具有重要的食用价值。

