芪冬活血饮通过干扰素调节因子5抑制肺组织M1 巨噬细胞募集治疗急性肺损伤的作用机制研究
王维斯 陈 晔 张丽婷 凌明珠 马兆娟 叶柏春
急性肺损伤(acute lung injury,ALI)是由多种致病因素引起的临床综合征,包括急性肺炎、败血症、严重创伤和急性胰腺炎等,该综合征最初以肺部炎症和微血管通透性为特征,最终发展为急性呼吸窘迫综合征[1]。尽管机械通气改善了患者预后,但急性呼吸窘迫综合征的死亡率仍高达35%~55%,缺乏有效的治疗会使病情进一步恶化[2]。临床研究表明,芪冬活血饮对ALI 有良好的治疗效果[3]。芪冬活血饮由黄芪、麦冬、虎杖、当归、大黄共五味药物组成,以清热解毒、祛瘀通腑、益气养阴为治疗原则,具有抗炎、抗肺水肿等多种作用[4]。然而,其在ALI 治疗过程中发挥作用的分子机制尚未明确。因此,本研究使用脂多糖(lipopolysaccharide,LPS)诱导ALI 小鼠模型,以探究芪冬活血饮对抑制肺组织M1 巨噬细胞募集从而治疗ALI 的作用及其分子机制。
1 材料与方法
1.1 主要试剂 芪冬活血饮:黄芪20 g,麦冬12 g,虎杖20 g,当归12 g,大黄9 g,购自浙江中医药大学附属第二医院中药房(浙江天道医药有限公司)。药材用8 倍水浸泡30min,将煎得药汁浓缩至含生药1 g/mL和2 g/mL 药汁,分装灭菌后低温保存。
PBS 缓冲液(批号72013561)、二甲苯(批号40091060)、乙醇(批号100092008)购自国药集团化学试剂有限公司;苏木精(批号G1080)、伊红(批号G1100)购自索莱宝生物科技有限公司;小鼠肿瘤坏死因子α(TNF-α)(批号PMTA00B)、白细胞介素6(IL-6)(批号M6000B-1)、白细胞介素1β(IL-1β)(批号MLB00C)酶联免疫吸附试验(ELISA)试剂盒购自美国R&D System 公司;原位末端转移酶标记技术(TUNEL)试剂盒(批号40306ES50)购自翌圣生物科技(上海)股份有限公司;TRIzol 试剂(批号15596026)、HiFiScript cDNA 合 成 试 剂 盒(批 号CW2569)、SYBR Green PCR Matser Mix (批 号CW0955)购自北京康为世纪生物科技有限公司;放射免疫沉淀法缓冲液(RIPA)(批号P0013B)、BCA 蛋白测定试剂盒(批号P0009)、TBST(批号ST673)、增强型化学发光法(ECL)显影液(批号P0018M)购自碧云天生物技术有限公司;牛血清蛋白(BSA)(批号V900933) 购自美国Sigma 公司;氨水(批号M10542301)、中性树脂(批号M10086901)购自国药集团化学试剂有限公司。实验所用干扰素调节因子5(IRF5)引物购自上海生工生物工程有限公司,引物序列:Forward 5'-CAGTGGG-TCAACGGGGAAAA GAAAC-3';Reverse 5'-CTTTA-GCCCAGGCCTTGAAGATGG-3'。实验所用抗体:流式抗体PE-CD11c(批号#117307)、FITC-CD206(批号#141706)购自BIOLEGEND(北京)生物科技有限公司;蛋白质免疫印迹抗体:半胱氨酸天冬氨酸蛋白酶3 剪切体(cleaved caspase3)(批 号ab214430)、B 淋 巴 细 胞瘤-2 蛋白(Bcl-2)(批号ab182858)、BCL2 相关X 蛋白(Bax)(批号ab32503)、甘油醛-3-磷酸脱氢酶(GAPDH)(批号ab9485)和羊抗兔免疫球蛋白(IgG)(批号ab150077)购自美国Abcam 公司。免疫荧光抗体:IRF5(批号ab181553)、羊抗兔IgG H&L(批号ab150077)购自美国Abcam 公司。
1.2 主要仪器 EG1150H 组织包埋机、RM2235 组织切片机购于上海徕卡仪器有限公司;C2500-R-230V 型微型高速离心机购于Labnet 公司;Multiskan MK3 型全自动酶标仪购于Thermo scientific 公司;ChemiDocTMXRS+凝胶成像系统为Bio-rad 公司产品;UltraVIEW VoX& IX81 激光共聚焦显微镜成像系统及BX53 正置荧光显微镜均购于Olympus 公司;NanoDrop 2000 型超微量分光光度计购于Thermo公司。
1.3 动物模型
1.3.1 实验动物 24 只8 ~10 周龄野生型雄性C57BL/6 小鼠购自杭州医学院实验动物中心[许可证号:SYXK(浙)2019-0011]。在SPF 级环境中,将小鼠置于12∶12 h 明暗循环下,给予标准饮食和自由饮水。所有涉及动物的程序均获得浙江省实验动物中心实验动物福利伦理委员会批准(伦理批号:ZJCLAIACUC-20040158)。
1.3.2 分组与造模 将24 只小鼠,按照随机数字表法分为四组:空白组、模型组、芪冬活血饮低剂量组和芪冬活血饮高剂量组,每组6 只。通过鼻内滴入LPS(5 mg/kg,溶于50 μL 生理盐水)诱导ALI[5]。空白组小鼠鼻内滴入等量生理盐水。
1.3.3 给药方式[6]芪冬活血饮低剂量组和芪冬活血饮高剂量组:诱导ALI 前4 d、诱导ALI 当日及诱导ALI 次日分别以1 g/mL 和2 g/mL 浓度芪冬活血饮每日灌胃0.2 mL,共计6 次;空白组和模型组每日灌胃0.2 mL 生理盐水,共计6 次。
1.3.4 动物组织取材与处理 所有小鼠末次灌胃2 h后安乐死,打开胸腔,右肺用于肺泡灌洗液制备:右肺注入1 mL 生理盐水,轻轻按摩右肺30 s,抽回右肺内液体,间隔10 min 反复3 次,回收液体3000 r/min离心10 min,取上清。取1/3 左肺,10%多聚甲醛固定24 h,石蜡包埋切片进行后续实验。剩余肺组织-80 ℃保存,用于实时荧光定量聚合酶链式反应(qRT-PCR)和流式细胞术测定。
1.4 苏木素-伊红(HE)染色[7]HE 染色观察各组小鼠肺组织形态。将肺组织切片,二甲苯脱蜡,100%、90%和70%梯度乙醇水合。然后用苏木精染色7 min,用95%乙醇水化5 s。随后将切片在氨水中浸泡30 s,直至呈蓝色。切片用伊红染色约1 min,100%、95%、75%、50%梯度乙醇水合2 次(每次2 min),二甲苯漂洗2 次(每次5 min)。中性树脂封片后,显微镜下观察不同肺组织的组织病理学改变。
1.5 ELISA 采用小鼠IL-6、IL-1β、TNF-α ELISA试剂盒检测小鼠支气管肺泡灌洗液中IL-6、IL-1β、TNF-α 的水平。按照试剂盒说明书进行检测。采用全自动酶标仪测定450 nm 处吸光度值。
1.6 原位末端转移酶标记技术(TUNEL) 将各组小鼠肺组织切片与蛋白酶K 孵育后根据TUNEL 检测试剂盒说明书进行操作。用荧光共聚焦显微镜观察样本。
1.7 流式细胞术 用抗表面蛋白的抗体对各组小鼠肺组织细胞进行免疫标记。收集各组小鼠肺组织,剪碎后加入0.5%胶原蛋白酶和0.25%胰酶,37 ℃孵育1 h。将肺组织细胞悬液离心、漂洗、重悬后,4 ℃与PE-CD11c 和FITC-CD206 抗体避光孵育30 min,然后用PBS 洗涤。采用流式细胞仪采集数据,采用FlowJo 软件进行分析。
1.8 qRT-PCR 使用TRIzol 试剂从各组小鼠肺组织中提取总RNA。根据HiFiScript cDNA 合成试剂盒的说明书,等量的RNA 在八联管中逆转录。采用SYBR Green PCR Matser Mix 进行实时聚合酶链反应。
1.9 蛋白质免疫印迹 使用含有蛋白酶抑制剂混合物的RIPA 缓冲液提取总蛋白。BCA 蛋白测定法测定蛋白浓度。总蛋白(30 μg)通过SDS-PAGE 分离,并湿转至PVDF 膜上。在TBST 中用5%BSA 封闭后,与特异性一抗在4 ℃孵育过夜,随后,将膜分别与HRP 标记的山羊抗兔IgG 在室温下孵育1 h。使用ECL 试剂显影,并在ECL 成像系统上检测信号。
1.10 免疫荧光检测 各组小鼠肺组织切片脱蜡水合后,在3%BSA 中封闭1 h,然后与特异性IRF5 抗体反应过夜。随后用Alexa Fluor 488 山羊抗兔IgG避光孵育1 h。用PBS 洗涤后,切片用DAPI 染色10 min,用PBS 洗涤,并添加抗荧光猝灭剂,然后安装到显微镜载玻片上,中性树脂封片。使用激光共聚焦显微镜对切片进行观察。
1.11 统计学方法 应用GraphPad Prism 8.0 软件进行图形和统计学分析。计量资料均符合正态分布,以均数±标准差(±s)表示。两组间比较采用独立样本t 检验。P<0.05 认为差异有统计学意义。
2 结 果
2.1 芪冬活血饮对小鼠肺组织病理的影响 对各组小鼠肺组织进行HE 染色,结果见图1。空白组肺泡结构清晰完整,偶见部分部位较少炎性细胞。模型组大部分肺泡壁增宽伴水肿,肺泡腔塌陷,肺泡壁及肺泡腔内可见大量炎症细胞浸润及红细胞渗出。经芪冬活血饮治疗后,低剂量组小鼠肺泡壁稍增宽,炎症细胞浸润、红细胞渗出症状减轻。高剂量组小鼠肺组织损伤情况较模型组更显著,较低剂量组更轻。这说明芪冬活血饮能促进小鼠恢复LPS 诱导的ALI。
2.2 芪冬活血饮抑制小鼠肺组织细胞凋亡 对各组小鼠肺组织切片进行TUNEL 染色,模型组荧光强度显著高于空白组,芪冬活血饮低剂量组和高剂量组小鼠肺组织荧光强度显著低于模型组,且高剂量组荧光强度低于低剂量组(见图2A)。同时,提取各组小鼠肺组织总蛋白,使用蛋白质免疫印迹实验检测凋亡相关蛋白表达情况,显影结果显示,促凋亡蛋白cleaved caspase3、Bax 在模型组中表达量显著高于空白组,凋亡抑制蛋白Bcl-2 在模型组中表达量显著低于空白组;与模型组比较,芪冬活血饮低剂量组和高剂量组中cleaved caspase3、Bax 蛋白表达量均显著低于模型组、Bcl-2 表达量均显著高于模型组,且高剂量组中cleaved caspase3、Bax 表达量较低剂量组更低、Bcl-2 表达量较低剂量组更高(见图2B)。以上结果说明芪冬活血饮能抑制小鼠肺组织细胞凋亡。
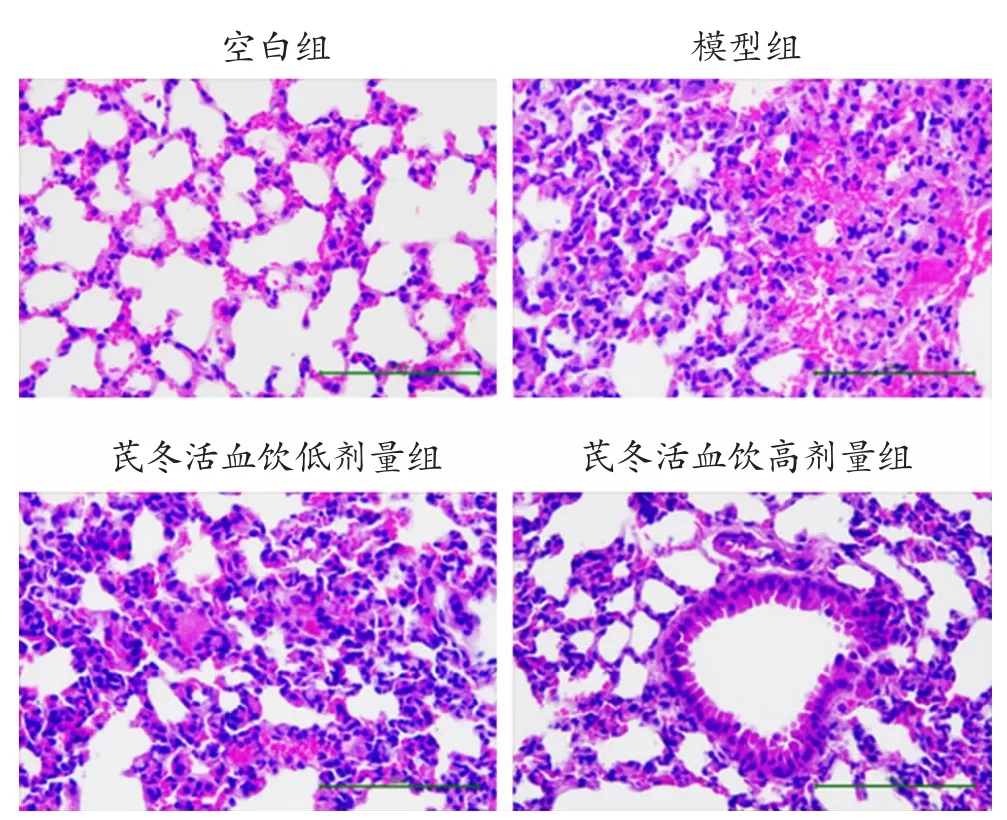
图1 芪冬活血饮对小鼠肺组织形态的影响(HE 染色,×400)注:芪冬活血饮低剂量组每日灌胃1 g/mL 芪冬活血饮0.2 mL;芪冬活血饮高剂量组每日灌胃2 g/mL 芪冬活血饮0.2 mL;空白组和模型组每日灌胃生理盐水0.2 mL
2.3 芪冬活血饮抑制小鼠肺组织炎症反应 使用ELISA 检测各组小鼠肺泡灌洗液中炎症因子的表达情况。模型组中IL-6、IL-1β、TNF-α 表达量均显著高于空白组(P<0.01),芪冬活血饮低、高剂量组中IL-6、IL-1β、TNF-α 表达量均显著低于模型组(P<0.05 或P<0.01),且呈剂量依赖,见表1。
2.4 芪冬活血饮抑制M1 巨噬细胞极化和募集 流式细胞术检测CD11c 和CD206 标志物,以判断小鼠组织中M1 巨噬细胞的极化和募集情况。模型组中M1 巨噬细胞占比显著高于空白组,芪冬活血饮低、高剂量组小鼠肺组织中M1 巨噬细胞占比均显著低于模型组,且高剂量组中M1 巨噬细胞占比低于低剂量组,见图3。
2.5 芪冬活血饮抑制IRF5 的表达 使用qRT-PCR和免疫荧光分别检测IRF5 mRNA 和蛋白表达情况。qRT-PCR 结果显示,模型组中IRF5 mRNA 表达显著高于空白组(P<0.01),芪冬活血饮低、高剂量组中IRF5 mRNA 表达量显著低于模型组,且呈剂量依赖(P<0.05 或P<0.01)(见表2)。免疫荧光结果显示,各组小鼠肺组织切片中IRF5 蛋白表达与mRNA 表达趋势一致,见图4。
3 讨 论
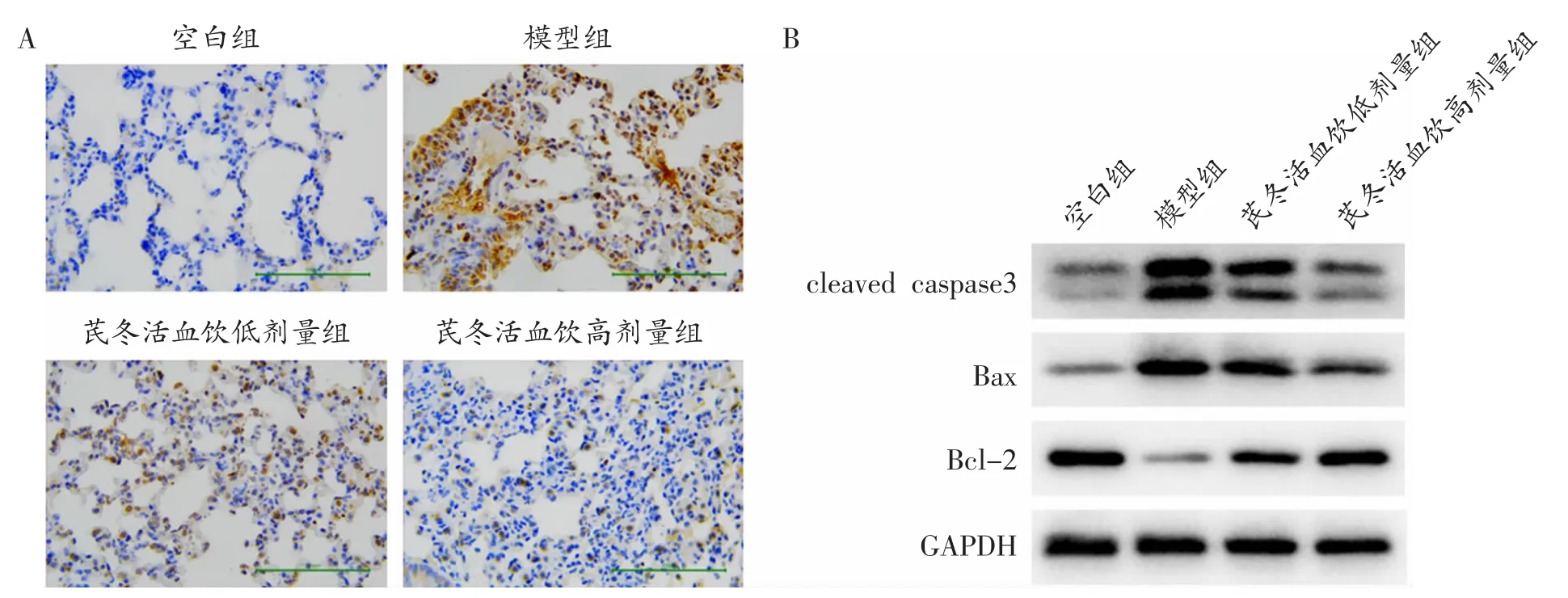
图2 芪冬活血饮抑制小鼠肺组织中细胞凋亡
表1 各组小鼠肺泡灌洗液炎症因子表达情况(pg/mL,±s)
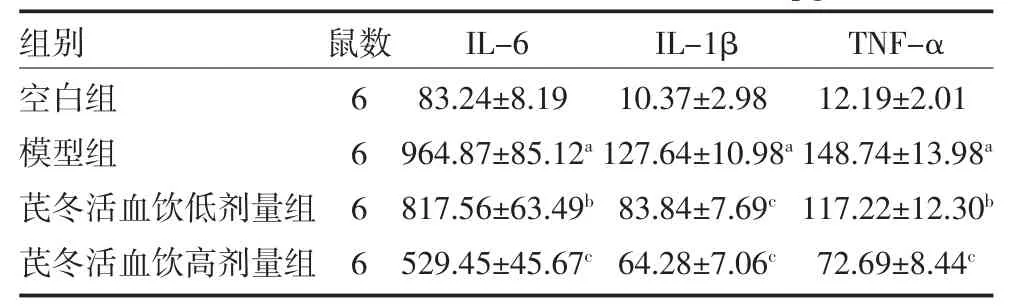
表1 各组小鼠肺泡灌洗液炎症因子表达情况(pg/mL,±s)
注:芪冬活血饮低剂量组每日灌胃1 g/mL 芪冬活血饮0.2 mL;芪冬活血饮高剂量组每日灌胃2 g/mL 芪冬活血饮0.2 mL;空白组和模型组每日灌胃生理盐水0.2 mL;IL-6 为白细胞介素-6;IL-1β 为白细胞介素-1β;TNF-α 为肿瘤坏死因子α;与空白组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别空白组模型组芪冬活血饮低剂量组芪冬活血饮高剂量组鼠数6666 IL-6 83.24±8.19 964.87±85.12a 817.56±63.49b 529.45±45.67c IL-1β 10.37±2.98 127.64±10.98a 83.84±7.69c 64.28±7.06c TNF-α 12.19±2.01 148.74±13.98a 117.22±12.30b 72.69±8.44c
中医认为,ALI 病因可归于“热、毒、痰、瘀”,发病于肺,多由邪毒、创伤等引发,以致肺气虚损、肺失宣降、气机阻滞。因此中医往往遵循“清热解毒、祛痰化瘀”之方剂来治疗ALI[8]。芪冬活血饮主要由黄芪20 g,麦冬12 g,虎杖20 g,当归12 g,大黄9 g 组成,其中黄芪益气固表、补益脾肺、敛疮生肌;麦冬补气养阴、益胃生津;虎杖清热解毒、活血化瘀;当归味甘性温、补血活血;大黄荡涤胃肠、攻下泻火、清热解毒、安和五脏。全方配伍益气扶正,活血化瘀,标本兼顾[9-10]。多项研究表明,芪冬活血饮对ALI 有良好的治疗效果,如芪冬活血饮通过调控巨噬细胞细菌LPS 的受体Toll 样受体4(TLR4)/核因子κB(NF-κB)炎性信号通路从而影响ALI[11];芪冬活血饮还可基于窖蛋白-1(Cav-1)/NF-κB 炎性反应信号通路治疗ALI 模型大鼠[12]等。在本研究中,芪冬活血饮对ALI 模型小鼠也呈现良好的治疗效果,对模型小鼠肺组织恢复有显著帮助,这与前人研究结果一致。

图3 流式细胞术检测芪冬活血饮抑制M1 巨噬细胞极化和募集
大量研究表明,ALI 过程与细胞凋亡相关:桑黄酚A(Hispolon)通过调节TLR4/磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)和Kelch 样ECH 关联蛋白1(Keap1)/核因子红细胞2 相关因子2(Nrf2)/血红素加氧酶1(HO-1)通路,抑制氧化应激介导的内质网应激诱导的细胞凋亡和自噬,减轻脂多糖诱导的小鼠ALI[13];线粒体定向辅酶Q(MitoQ)通过调控Nrf2/线粒体动力相关蛋白1(Drp1)通路抑制细胞凋亡减轻LPS 介导的ALI[14];秋水仙碱通过抑制炎症、细胞凋亡和氧化应激改善重症急性胰腺炎大鼠ALI[15]。也有一些证据表明,在ALI 发生和发展过程中,M1 巨噬细胞极化和募集起到了关键作用:中性粒细胞外泌体miR-30d-5p 诱导M1 巨噬细胞极化并引发巨噬细胞焦亡,加剧脓毒症相关ALI[16];伪麻黄碱联合大黄素通过血管活性肠肽(VIP)/环腺苷酸(cAMP)/蛋白激酶A(PKA)通路调节巨噬细胞M1/M2 极化,改善LPS 诱导的ALI[17];褪黑素通过激活载脂蛋白E(ApoE)/低密度脂蛋白受体(LDLR)途径抑制甲型流感ALI 中巨噬细胞M1极化和活性氧(ROS)介导的焦亡[18]。在本研究中,我们同样也观察到,随着ALI 的改善,细胞凋亡水平下降,M1 巨噬细胞占比下降,提示芪冬活血饮可能通过调控细胞凋亡和M1 巨噬细胞募集的途径来缓解小鼠ALI。
表2 各组小鼠肺组织IRF5 mRNA 表达情况(±s)
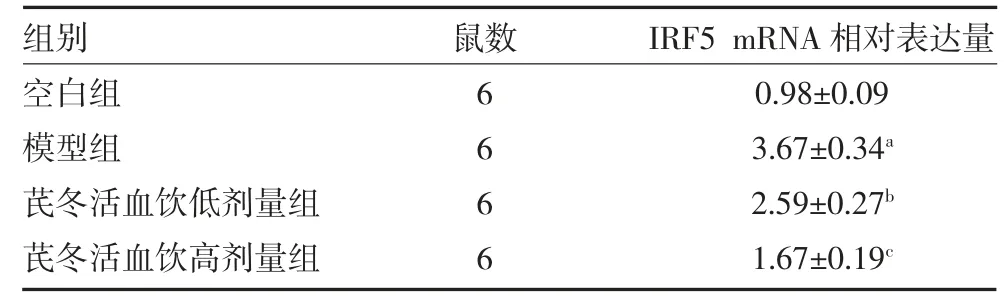
表2 各组小鼠肺组织IRF5 mRNA 表达情况(±s)
注:芪冬活血饮低剂量组每日灌胃1 g/mL 芪冬活血饮0.2 mL;芪冬活血饮高剂量组每日灌胃2 g/mL 芪冬活血饮0.2 mL;空白组和模型组每日灌胃生理盐水0.2 mL;IRF5 为干扰素调节因子5;与空白组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
组别空白组模型组芪冬活血饮低剂量组芪冬活血饮高剂量组鼠数6666 IRF5 mRNA 相对表达量0.98±0.09 3.67±0.34a 2.59±0.27b 1.67±0.19c
IRF5 可能与巨噬细胞M1 极化和细胞凋亡相关。有报道显示,IKAROS 家族锌指蛋白1(IKZF1)-IRF4/IRF5 轴调控骨髓瘤相关巨噬细胞的极化[19];槲皮素通过影响NF-κB p65 和IRF5 活性调节M1/M2巨噬细胞极化改善肾损伤和纤维化[20];IRF5 参与其他信号通路,包括B 细胞中的IgG 转换、巨噬细胞极化和凋亡,从而影响系统性红斑狼疮的进展[21];IRF5的缺失可保护造血干细胞免受DNA 损伤诱导的凋亡,并抑制γ 辐照诱导的胸腺淋巴瘤发生[22]。仅有极少数研究探讨了IRF5 在ALI 中的作用:IRF5 siRNA负载叶酸修饰的阳离子脂质体可用于ALI 治疗[23];IRF5 促进巨噬细胞M1 极化,IRF5 阻断可以改善包括肺损伤在内的急性炎症[24]。在本研究中,ALI 模型小鼠肺组织中IRF5 表达显著升高(P<0.01),经过芪冬活血饮治疗后小鼠肺组织中IRF5 表达显著降低(P<0.05 或P<0.01),提示芪冬活血饮可能通过调控IRF5 影响细胞凋亡和巨噬细胞M1 极化,最终缓解ALI 症状。
综上所述,芪冬活血饮在ALI 治疗中具有良好的效果和应用前景。本研究通过LPS 诱导的小鼠ALI 模型,发现芪冬活血饮可能通过IRF5 抑制肺组织M1 巨噬细胞募集和细胞凋亡,从而治疗ALI。但是IRF5 相关的芪冬活血饮治疗ALI 的具体分子机制及量效关系值得更深入的研究。
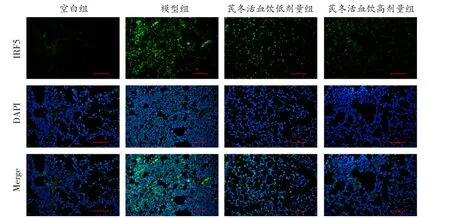
图4 免疫荧光检测各组小鼠肺组织中IRF5 蛋白表达情况

