hsa-circ-002179 靶向miR-143-3p 调控自噬-凋亡平衡在胃癌5-氟尿嘧啶化疗耐药性中的作用研究
陶克龙 张振兴 徐关根 陶 锋
胃癌是全球最常见的五大癌症之一,也是第三大高致死率癌症[1]。5-氟尿嘧啶(5-Fu)是嘧啶类抗代谢药物,临床常用于治疗胃癌。在治疗初期,大部分胃癌细胞对5-Fu 敏感,肿瘤体积减小,但由于耐药性的产生,5-Fu 并不能清除所有肿瘤细胞,严重影响胃癌的总体治疗效果,并限制了其临床的有效应用。环状非编码RNA(circular RNA,circRNA)是一种主要由一个以上外显子构成的环形RNA 分子,大量存在于真核细胞,是RNA 领域的最新研究热点。大量的circRNA 在肿瘤发生及发展中发挥重要调控作用[2],并且circRNA 已被发现参与胃癌细胞的增殖、凋亡、迁移和侵袭等重要过程[3]。此外,已有研究发现circRNA 可以影响胃癌细胞对多种化疗药物的敏感性,例如circCUL2 可以通过miR-142-3P/Rock2 轴调节胃癌的顺铂耐药性[4]。因此,研究circRNA 对胃癌细胞药物敏感性的功能和机制,有助于改善化疗效果。本实验从细胞水平探究了hsa-circ-002179 靶向miR-143-3p 调控自噬-凋亡平衡对于胃癌细胞5-Fu 化疗耐药性的调控作用,旨在为胃癌治疗提供新的靶点和实验依据。
1 实验材料
1.1 细 胞 人类胃癌细胞系(AGS)(批号CL-0022),购自武汉普诺赛生命科技有限公司。
1.2 药物和试剂 自噬抑制剂氯喹(CQ)(Sigma 公司,美国,批号C6628)、TRIzol(Thermo 公司,美国,批号12183555)、Lipofectamine 2000(Invitrogen 公司,美国,批号11668019)、CCK8 细胞检测试剂盒(Dojindo,日本,批号CK04)、Annexin V-FITC/PI 细胞凋亡检测试剂盒(碧云天公司,中国,批号C1062S)、胎牛血清(Gibco 公司,美国,批号30067334)、RPMI 1640 培养基(Gibco 公司,美国,批号11875093)、TaqMan MicroRNA 逆转录试剂盒(Applied Bio 公司,美国,批号4366596)、Revertaid 逆转录试剂盒(Thermo Fisher Scientific,美国,批号K1691)、Magna RIP RNA Binding Protein Immunoprecipitation 试剂盒(Millipore 公司,美国,批号17-700)、实时定量聚合酶链反应(qRT-PCR)试剂盒(Sigma 公司,美国,批号71978-3CN)、PrimeScript RT Reagent 试 剂 盒(TaKaRa Bio 公司,中国,批号RR047A);LC3 抗体(批号ab192890)、Beclin-1 抗体(批号ab207612)、p62 抗体(批号ab109012)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(批号ab8245)、二抗、AGO2 抗体(批号ab287205)、IgG 抗体(批号ab172730)均购自美国Abcam 公司;阴性对照小干扰RNA(si-NC)、hsacirc-002179 小 干 扰RNA (si-002179)、hsa-circ-002179 过 表 达 质 粒(OE-002179) 均 由 中 国GenePharma 公司合成;5-Fu(批号F6627) 购自MedChemExpress;hsa-circ-002179 野生型荧光素酶质粒(002179-WT)、hsa-circ-002179 突变型荧光素酶质粒(002179-MUT)均由中国RiboBio 公司合成;引物均由中国上海生工生物公司合成;miR-143-3p抑制剂和miR-143-3p 模拟物购自中国GenePharma公司。
1.3 主要仪器 酶标仪(MK-3,赛默飞世尔科技上海有限公司);流式细胞仪(C6,美国BD);实时荧光定量PCR 仪(CFX-96TOUCH,美国伯乐);成像系统(日本尼康);CO2细胞培养箱(赛默飞Thermo Fisher,USA);高速离心机(上海安亭)。
2 实验方法
2.1 细胞处理与分组 AGS 细胞使用含10%胎牛血清的RPMI 1640 培养基、置于37 ℃、5%CO2细胞培养箱中培养。在AGS 细胞培养基中添加并逐渐升高5-Fu 的浓度(0~30 μg/mL),连续6 个月,以构建AGS/5-Fu 耐药细胞模型。
细胞分为对照组、耐药组、耐药+si-NC 组、耐药+si-002179 组、002179-WT 组、0002179-MUT 组、耐药+OE-002179 组、耐药+si-002179+miR-143-3p抑制剂组、耐药+CQ 组、耐药+CQ+OE-002179 组、耐药+CQ+OE-002179+miR-143-3p 模拟物组。按照不同的组别,使用Lipofectamine 2000 进行相应的转染。
2.2 CCK8 检测细胞活性 将AGS 细胞接种到96孔板,每孔加入10 μL CCK-8 试剂,置于37 ℃培养箱内1 h,使用酶标仪检测450 nm 处吸光度。
2.3 流式细胞术检测细胞凋亡 使用预冷磷酸缓冲盐溶液(PBS)清洗细胞,离心后去除上清液,在沉淀中加入结合缓冲液,对细胞沉淀进行重悬,按照Annexin V-FITC/PI 细胞凋亡检测试剂盒说明书步骤进行检测。
2.4 Western blot 检测相关蛋白表达 向细胞中加入RIPA 裂解液,提取总蛋白,通过SDS-PAGE 电泳分离蛋白并转移到PVDF 膜上,并加入5%脱脂奶粉溶液封闭2 h,分别使用LC3 抗体(1∶1000)、Beclin-1抗体(1∶1000)、p62 抗体(1∶1000)、GAPDH 抗体(1∶1000)稀释液在4 ℃孵育24 h,TBST 清洗后,加入二抗稀释液(1∶1000)孵育1 h,TBST 清洗后,滴加ECL,进行显影。
2.5 qRT-PCR 检测细胞中hsa-circRNA 002179 和miR-143-3p 的表达 使用TRIzol 提取细胞总RNA,根据相应试剂盒说明书获得cDNA。反应体系:2 μL cDNA、10 μL Real-Time Master Mix,正反向引物各1 μL,加RNase-Free ddH2O 至20 μL 总体积;反应条件:95 ℃,2 min;95 ℃,15 s;60 ℃,1 min;72 ℃,30 s(40 个循环)。hsa-circ-002179 以GAPDH为内参,miR-143-3p 以U6 为内参,hsa-circ-002179和miR-143-3p 的相对表达量采用2-ΔΔCt法进行计算。引物序列如下:hsa-circ-002179 F:5'-CGACTCTTAGCTTGTCGGGG-3',R:5'-GCATTGCCAATCTGGACACC-3';miR-143-3p F:5'-AAGCGCCTTGAGATGAAGCACT-3',R:5'-ATCCAGTGCAGGGTCCGAGG-3';U6 F:5'-CTCGCTTCGGCAGCACA-3',R:5'-AACGCTTCACGAATTTGCGT-3';GAPDH F:5'-GATCATCAGCAATGCCTCCT-3',R:5'-TGTGGTCATGAGTCCTTCCA-3'。
2.6 免疫共沉淀(RIP)检测 根据Magna RIP RNA Binding Protein Immunoprecipitation 试剂盒说明书步骤进行RIP 实验。将免疫沉淀的RNA 进行逆转录,并使用PrimeScriptTMRT 试剂盒进行RT-PCR。利用特异性引物检测免疫沉淀物中的miR-143-3p、hsa-circ-002179 水平。
2.7 双荧光素酶报告实验检测靶向关系 StarBase预测结果显示,hsa-circ-002179 与miR-143-3p 存在结合位点。构建含有结合位点的002179-WT、结合位点突变的002179-MUT,分别将miR-NC 和miR-134-4p mimic 共转染进AGS 细胞,在37 ℃、5%CO2培养箱中培养24 h 后,检测相对荧光素酶活性。
2.8 统计学方法 应用SPSS 21.0 统计学软件进行数据分析,数值以均数±标准差(±s)表示,采用单因素方差分析进行多组间比较,采用独立样本t 检验进行两组间比较,P<0.05 表示差异具有统计学意义。
3 结 果
3.1 hsa-circ-002179 在AGS/5-Fu 细胞中表达上调0~30 μg/mL 的5-Fu 处理后,耐药组的IC50升高,并且对5-Fu 的敏感性降低(见表1)。进一步使用20 μg/mL 的5-Fu 处理AGS 和AGS/5-Fu 细胞后,与对照组比较,耐药组的细胞活性升高 [(172.33±9.53)%比(106.00±6.16)%,P<0.01],凋亡率降低(20.5%比43.8%,P<0.01),自噬水平增强(见图1)。与对照组比较,hsa-circ-002179 在耐药组细胞中的表达升高[(4.46±0.34)比(1.05±0.66),P<0.01]。这说明hsa-circ-002179 在AGS 的5-Fu 化疗耐药性中可能发挥重要作用。
表1 不同浓度5-氟尿嘧啶处理后的各组细胞活性比较(OD,±s)

表1 不同浓度5-氟尿嘧啶处理后的各组细胞活性比较(OD,±s)
注:与对照组比较,aP<0.05,bP<0.01
浓度0 μg/mL 5 μg/mL 10 μg/mL 15 μg/mL 20 μg/mL 25 μg/mL 30 μg/mL孔数3333333对照组108.33±5.35 87.00±2.94 70.33±4.99 99.67±3.86 55.33±4.50 43.33±2.86 43.33±3.40耐药组109.00±3.56 99.67±3.30a 99.67±4.92b 94.67±3.68b 88.00±3.74b 84.67±2.86b 83.67±3.30b
3.2 下调hsa-circ-002179 增加了AGS/5-Fu 细胞的药物敏感性 为了探究hsa-circ-002179 对AGS/5-Fu 细胞药物敏感性的影响,在AGS/5-Fu 细胞中转染si-002179,进而敲低hsa-circ-002179 的表达水平[(0.45±0.05)比(1.05±0.10),P<0.01]。与耐药+si-NC 组比较,耐药+si-002179 组的细胞活性降低[(80.00±2.45)%比(102.67±7.13)%,P<0.05]、凋亡水平升高(3.13%比21.8%,P<0.05),对5-Fu 的敏感性升高,见图2。

图1 AGS/5-氟尿嘧啶细胞中hsa-circ-002179 的表达

图2 下调hsa-circ-002179 对AGS/5-氟尿嘧啶细胞凋亡率的影响
3.3 hsa-circ-002179 靶向miR-143-3p 为了进一步探究hsa-circ-002179 在AGS/5-Fu 细胞中的作用机制,通过StarBase 数据库分析发现hsa-circ-002179 能够靶向吸附miR-143-3p(见图3)。如表2和表3 所示,hsa-circ-002179 与miR-143-3p 存在结合作用。与对照组比较,耐药组中miR-143-3p 的表达显著降低[(0.38±0.05)比(1.04±0.07),P<0.01]。如表4 显示,与耐药+NC 组比较,敲除hsa-circ-002179 后细胞中miR-143-3p 水平升高(P<0.01),而过表达hsa-circ-002179 后细胞中miR-143-3p 水平降低(P<0.01)。这说明has-circ-002179 靶向抑制miR-143-3p。
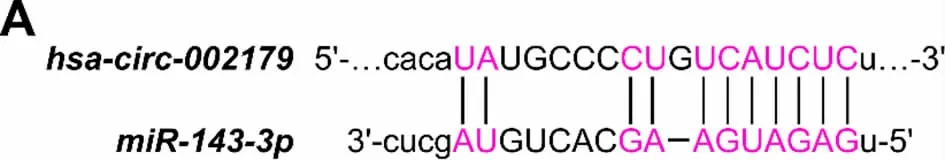
图3 StarBase 预测hsa-circ-002179 与miR-143-3p 的结合位点
表2 各组细胞中hsa-circ-002179 与miR-143-3p 的结合水平(%,±s)

表2 各组细胞中hsa-circ-002179 与miR-143-3p 的结合水平(%,±s)
注:与同组IgG 比较,aP<0.01
组别hsa-circ-002179 组miR-143-3p 组孔数33 IgG 1.33±0.47 1.33±0.47 Ago2 20.67±1.70a 39.67±2.05a
3.4 hsa-circ-002179 靶向miR-143-3p 调控AGS/5-Fu 细胞的自噬 为了进一步探究hsa-circ-002179 靶向miR-143-3p 在AGS/5-Fu 细胞中的作用机制,本研究分析了hsa-circ-002179 靶向miR-143-3p 对于AGS/5-Fu 细胞自噬的影响。如表5~6所示,与耐药组比较,耐药+si-002179 组的hsa-circ-002179 表达水平降低(P<0.01),而miR-143-3p 表达升高(P<0.01)。与耐药+si-002179 组比较,耐药+si-002179+miR-143-3p 抑制剂组的hsa-circ-002179 表达无显著变化,而miR-143-3p 表达水平降低(P<0.01)。图4 显示,与耐药组比较,耐药+si-002179 组的LC3Ⅱ和Beclin-1 蛋白表达降低,而p62 表达增加,自噬水平显著降低,而si-002179 对AGS/5-FU 细胞自噬产生的影响能够被miR-143-3p抑制剂部分逆转。这说明hsa-circ-002179 可以通过靶向miR-143-3p 调控AGS/5-Fu 细胞自噬。
表3 各组细胞内双荧光素酶酶活性比较(%,±s)

表3 各组细胞内双荧光素酶酶活性比较(%,±s)
注:与同组miR-NC 比较,aP<0.01
组别002179-WT 组002179-MUT 组孔数33 miR-NC 1.17±0.12 1.10±0.08 miR-143-3p mimic 0.50±0.08a 1.2.0±0.08a
表4 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)
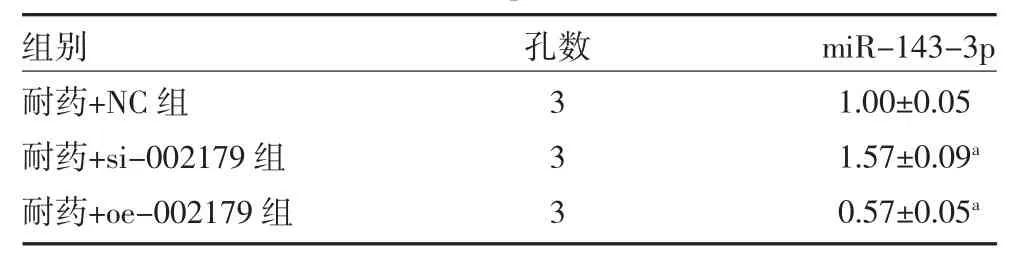
表4 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)
注:与耐药+NC 组比较,aP<0.01
组别耐药+NC 组耐药+si-002179 组耐药+oe-002179 组孔数333 miR-143-3p 1.00±0.05 1.57±0.09a 0.57±0.05a
表5 各组细胞中hsa-circ-002179 相对表达量比较(2-ΔΔCt,±s)

表5 各组细胞中hsa-circ-002179 相对表达量比较(2-ΔΔCt,±s)
注:与耐药组比较,aP<0.01
组别耐药组耐药+si-002179 组耐药+si-002179+miR-143-3p 抑制剂组孔数333 hsa-circ-002179 0.99±0.03 0.49±0.03a 0.48±0.02
3.5 hsa-circ-002179 靶向miR-143-3p 调控自噬-凋亡平衡影响AGS/5-Fu 细胞的药物敏感性 接下来,本研究验证hsa-circ-002179 靶向miR-143-3p通过调控自噬-凋亡平衡对AGS/5-Fu 细胞药物敏感性产生影响。如表7~8 显示,与耐药组比较,CQ 处理对于hsa-circ-002179 和miR-143-3p 的表达水平没有显著影响;与耐药+CQ+OE-002179 组比较,耐药+CQ+OE-002179+miR-143-3p mimic 组中miR-143-3p 的表达被上调(P<0.01)。图5 以及表9 显示,与耐药组比较,耐药+CQ 组自噬被抑制,并且细胞活性降低(P<0.01),凋亡增加。与耐药+CQ 组比较,耐药+CQ+OE-002179 组的自噬增加,并且细胞活性(P<0.05)和凋亡水平随之变化。在CQ+OE-002179 处理的耐药细胞中进一步转染miR-143-3p mimic,结果发现与耐药+CQ+OE-002179 组比较,CQ+OE-002179+miR-143-3p mimic 组的自噬和细胞活性降低(P<0.05)、凋亡升高,5-Fu 药物敏感性有所恢复。
表6 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)

表6 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)
注:与耐药组比较,aP<0.01;与耐药+si-002179 组比较,bP<0.01
组别耐药组耐药+si-002179 组耐药+si-002179+miR-143-3p 抑制剂组孔数333 miR-143-3p 1.06±0.09 1.54±0.06a 0.65±0.05b
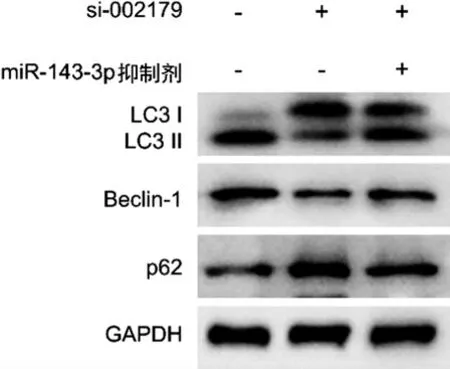
图4 Western blot 检测hsa-circ-002179 靶向miR-143-3p对AGS/5-氟尿嘧啶细胞中自噬相关蛋白表达的影响
表7 各组细胞中hsa-circ-002179 相对表达量比较(2-ΔΔCt,±s)

表7 各组细胞中hsa-circ-002179 相对表达量比较(2-ΔΔCt,±s)
注:CQ 为自噬抑制剂;与耐药+CQ 组比较,aP<0.01
组别耐药组耐药+CQ 组耐药+CQ+OE-002179 组耐药+CQ+OE-002179+miR-143-3p mimic 组孔数3333 hsa-circ-002179 1.03±0.07 1.06±0.06 3.21±0.17a 3.16±0.14
表8 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)

表8 各组细胞中miR-143-3p 相对表达量比较(2-ΔΔCt,±s)
注:CQ 为自噬抑制剂;与耐药+CQ 组比较,aP<0.05;与耐药+CQ+OE-002179 组比较,bP<0.01
组别耐药组耐药+CQ 组耐药+CQ+OE-002179 组耐药+CQ+OE-002179+miR-143-3p mimic 组孔数3333 miR-143-3p 1.07±0.10 1.04±0.08 0.82±0.02a 2.19±0.11b
表9 各组细胞活性比较(%,±s)

表9 各组细胞活性比较(%,±s)
注:CQ 为自噬抑制剂;与耐药组比较,aP<0.01;与耐药+CQ 组比较,bP<0.05;与耐药+CQ+OE-002179 组比较,cP<0.05
组别耐药组耐药+CQ 组耐药+CQ+OE-002179 组耐药+CQ+OE-002179+miR-143-3p mimic 组孔数3333细胞活性102.00±3.56 71.00±2.94a 81.33±3.40b 72.33±2.05c
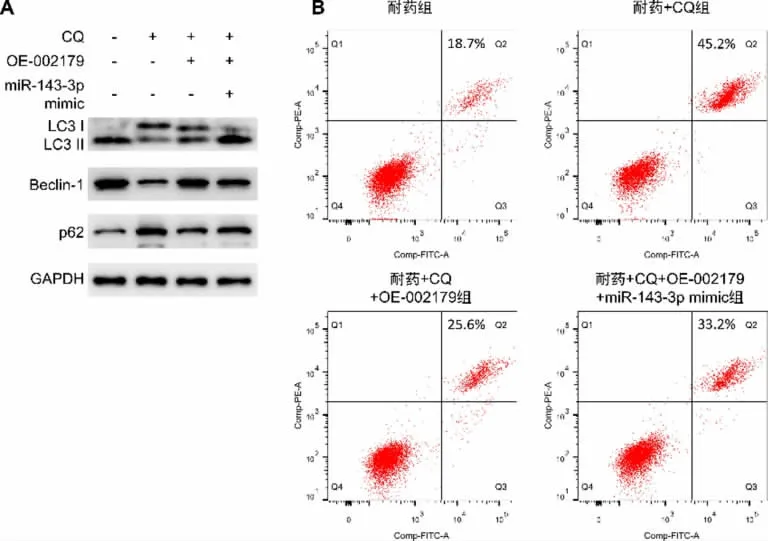
图5 hsa-circ-002179 靶向miR-143-3p 调控自噬-凋亡平衡对AGS/5-氟尿嘧啶细胞药物敏感性的影响
4 讨 论
胃癌是全球最常见的高死亡率消化道恶性肿瘤[6-7]。5-Fu 化疗是最常用的胃癌临床治疗手段,然而,胃癌细胞对5-Fu 的耐药性会限制其临床疗效[8],甚至导致化疗失败。因此,深入研究5-Fu 获得性耐药的机制对了解临床化疗耐药及提供肿瘤治疗的新策略十分重要。
大量的circRNA 已被发现作为抑癌基因或促癌基因参与胃癌的发生发展进程。Wang 等[9]研究发现,circ-10029 可以通过miR-29b-3p/ITGA11 轴调控胃癌细胞的增殖和侵袭;Yuan 等[10]发现,上调circ-102231 可以促进胃癌进展,然而在胃癌中,hsa-circ-002179 的作用及其机制研究较少。
自噬有助于维持组织内稳态和新陈代谢,但自噬的改变也会导致细胞正常功能受损[11]。有研究显示,低氧、饥饿等多种应激刺激时,细胞将启动自噬机制降解受损细胞器,从而防止触发凋亡途径,避免细胞凋亡或坏死[12]。自噬和凋亡在抗肿瘤治疗中具有相互影响的关系。凋亡是肿瘤细胞死亡的主要途径之一。自噬和细胞凋亡在肿瘤中具有协同和拮抗的双层作用[13]。有研究显示,肿瘤治疗中产生的阿霉素耐药可以通过调节自噬来逆转[14]。Hu 等[15]提到,调控自噬有助于改善卵巢癌治疗中的顺铂耐药。王婷[16]研究显示,抗肿瘤药物曲古霉素A 可以诱导卵巢癌细胞系SKOV3 产生活性氧使细胞内保护性自噬增加,从而使细胞凋亡率降低,而抑制活性氧的产生可以降低自噬水平,使细胞凋亡率增加。控制肿瘤细胞中自噬和凋亡之间的串扰,是治疗癌症的一个关键点[17]。然而目前hsa-circ-002179 对于胃癌细胞中自噬-凋亡平衡的影响尚不清楚。本研究显示,相比于AGS细胞,AGS/5-Fu 细胞的凋亡率降低、自噬水平升高,并且hsa-circ-002179 也明显升高。而敲除hsa-circ-002179 后,耐药细胞对于5-Fu 的敏感性增加,并且细胞凋亡水平升高。这说明AGS 细胞对5-Fu 作用的敏感性很可能与hsa-circ-002179 具有密切关联。
circRNA-miRNA 作用机制在胃癌细胞的化疗药物耐受中也发挥着重要作用,Huang 等[18]提出,circ-AKT3 通过抑制miR-198 来升高胃癌细胞的顺铂耐药性。本研究通过starbase 数据库分析和相关实验,验证了hsa-circ-002179 可以通过靶向吸附miR-143-3p。miR-143-3p 是一种重要的肿瘤调控基因[19-21]。并且在胃癌中也发挥调控作用,Wang 等[22]研究发现,miR-143-3p 在幽门螺杆菌阳性胃癌中的表达上调,并通过直接靶向AKT2 抑制肿瘤的生长、迁移和侵袭。Wu 等[23]证明,miR-143-3p 可以通过靶向环氧化酶-2(COX-2)抑制胃癌细胞生长并促进其凋亡。miR-143-3p 还可以作为circRNA 的靶点在胃癌的发生、发展过程中发挥作用,例如,circ-0006089 可以通过调控miR-143-3p/PTBP3/PI3K/AKT 途径促进胃癌进展[24]。circ-FOXO3 可以通过靶向miR-143-3p 来上调USP44 进而促进胃癌细胞增殖和迁移[25]。然而,目前miR-143-3p 在胃癌细胞的5-Fu 化疗耐药性中的作用和机制尚不清楚。本研究发现,hsacirc-002179 靶向吸附miR-143-3p 对AGS/5-Fu 自噬的上调,会导致AGS/5-Fu 细胞凋亡水平降低,造成自噬-凋亡失衡,进而降低了AGS 细胞的5-Fu 药物敏感性。
综上所述,本研究阐述了hsa-circ-002179 靶向miR-143-3p 对AGS 细胞的5-Fu 药物敏感性的调控机制,hsa-circ-002179 通过靶向miR-143-3p 影响自噬-凋亡平衡以升高AGS 细胞对于5-Fu 的耐药性。因此,hsa-circ-002179 有可能成为改善胃癌治疗中5-Fu 化疗耐药性的新靶点。

