气相色谱法测定坚果中16 种有机氯、拟除虫菊酯类农药残留量
李 娜,朱文峰,程国栋,江婷婷,王 婷,冀常菲
(安徽中创食品检测有限公司,安徽芜湖 241000)
坚果中含有不饱和脂肪酸、蛋白质、矿物质、维生素、纤维素、以及帮助催化脂肪的其他微量元素,具有保护心脏、美肌,抗氧化、改善视力、补脑等特殊的功能[1-2]。美国食品药品监督管理局(Food and Drug Administration,FDA)在2007 年向全球提出将坚果食品列为B 级健康食品[3-4]。坚果果树生长过程中容易受到病虫害的侵害,喷洒农药是果树的病虫害防治重要手段之一。以六六六、滴滴涕、五氯硝基苯为代表的有机氯杀虫剂为坚果禁用农药,但因具备杀虫种类多,高效、低毒、经济效益好等特点,容易在坚果果树的病虫害防治过程中被果农误用;菊酯类农药可以高效杀灭鳞翅目幼虫,可喷洒防治蝽象类害虫。喷洒到果树上的农药需要一定周期降解,果农对喷洒农药的时间掌握不准或违规使用,容易造成果实中农药残留出现超标的现象的发生,加之随着人们生活水平的提高,坚果的质量安全问题越来越受到人们的重视[5-6],我国GB 2763-2014《食品安全国家标准食品中农药最大残留限量》标准中对各类坚果农药残留限量作出了明确规定。
目前,关于有机氯及拟除虫菊酯农药多残留检测方法主要有气相色谱(gas chromatography,GC)、高效液相色谱-质谱法(high performance liquid chromatography-mass spectrography,HPLC-MS)[7-11]、气相色谱-质谱法(gas chromatography-mass spectrography,GC-MS)等[12-13],前处理方法有凝胶渗透[14]、固相萃取[15-17]、QuECHERS[16-18]等方法。GC-MS和HPLC-MS 相对GC 来说,设备价格、后期维护成本较高、对人员的基本操作专业技能有比较高的要求,其次,因电子捕获检测器(electron capture detector,GC-ECD)对电负性强的化合物有响应,可以用来测定有机氯和拟除虫菊酯类农药,所以本研究选择GC-ECD 进行有机氯、拟除虫菊酯检测[19]。前处理方面采用浓硫酸磺化样本提取液能够达到有效净化杂质目的,避免污染进样口、石英毛细管柱。采用硫酸磺化处理相对于固相萃取和QuECHERS 进行前处理[20],避免了农药残留在浓缩、换相过程中的损失,提升检测效率、节约检测成本。
因此,本研究以坚果为实验对象,丙酮:正己烷(V:V=3:7)为提取溶剂,运用磺化法进行样本净化,GC-ECD 检测有机氯和拟除虫菊酯。以期为检测人员准确测定坚果中有机氯和拟除虫菊酯类农药残留量提供技术参考。
1 材料与方法
1.1 材料与仪器
乙腈、正己烷 色谱纯,天津市富宇精细化工有限公司;丙酮、无水硫酸钠、硫酸 分析纯,国药集团化学试剂有限公司;标准溶液:α-六六六、β-六六六、γ-六六六、δ-六六六、p,p’-滴滴滴(p,p’-DDD)、p,p’-滴滴伊(p,p’-DDE)、p,p’-滴滴涕(p,p’-DDT)、o,p’-滴滴涕(o,p’-DDT)、α-硫丹、β-硫丹、甲氰菊酯、氯氟氰菊酯、氯菊酯、氰戊菊酯、溴氰菊酯、五氯硝基苯 100 μg/mL,坛墨质检科技股份有限公司;开心果、澳洲坚果、紫皮腰果、碧根果、核桃、巴旦木各500 g,三只松鼠股份有限公司。
GC-7890B 气相色谱仪 配备ECD 检测器及Agilent OpenLAB CDS 工作站、DB-17MS、DB-1701石英毛细管色谱柱 30 m×0.32 mm,0.25 μm,美国安捷伦公司;AUW220D 电子分析天平(精度0.01 mg)
日本岛津公司;N1-28 全自动氮吹浓缩仪 上海屹尧仪器科技发展有限公司;XK80-A 涡旋混合器 江苏新康医疗器械有限公司;T25 均质器 德国IKA公司;Milli-Q Direct 8 超纯水机 美国默克公司;TDZ5-WS 低速离心机、TG16-WS 高速离心机 湖南湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 有机氯、拟除虫菊酯类农药混合标准溶液的配制 分别移取100 μg/mL 的α-六六六、β-六六六、γ-六六六、δ-六六六、p,p’-DDD、p,p’-DDE、p,p’-DDT、o,p’-DDT、五氯硝基苯、硫丹(α-硫丹、β-硫丹)、甲氰菊酯、氯氟氰菊酯、氯菊酯、氯菊酯、氰戊菊酯、氰戊菊酯、溴氰菊酯标准储备液100 μL 于10 mL 容量瓶中,用正己烷定容至刻度,配制成浓度为1.0 μg/mL 的有机氯、拟除虫菊酯类农药混合标准溶液,将混合标准溶液用正己烷稀释成质量浓度为0.01、0.02、0.05、0.10、0.20 μg/mL 的系列标准溶液。
1.2.2 样品前处理 称取2.0 g(精确到0.01 g)粉末状坚果(去壳研磨成粉状过80 目筛)样品置于50 mL塑料离心管中,分别加入2.0 mL 水、1.0 g 无水硫酸钠,振荡混匀后加入丙酮:正己烷(3:7,V:V)试剂10 mL,置振荡器上剧烈振荡5 min,1342×g 离心3 min,取全部上清液,将上清液置于氮吹仪中,40 ℃水浴氮吹至近干,将浓缩溶液用正己烷定容至1.0 mL,定容液中加入0.2 mL 硫酸除去脂质等杂质,弃去硫酸,有机相用2 mL 2%硫酸钠溶液清洗,以2683×g 离心3 min,有机相过0.45 μm 有机系滤膜上机供GC-ECD 测定。
1.2.3 条件优化
1.2.3.1 提取溶剂的选择 选择乙腈、丙酮、正己烷、乙腈:丙酮(1:9、3:7、5:5、7:3、9:1 V:V)、乙腈:正己烷(1:9、3:7、5:5、7:3、9:1 V:V)、丙酮:正己烷(1:9、3:7、5:5、7:3、9:1 V:V)不同比例提取溶剂,考察对有机氯、拟除虫菊酯类农药的提取率的影响。
1.2.3.2 提取次数的选择 为了实现对坚果样品中农残的充分提取,使用相同提取试剂对坚果样品中农残的提取次数分别为1、2、3 次,考察对检测结果的影响。
1.2.3.3 氮吹温度的选择 为了考察氮吹温度对检测结果的影响,分别使用40、50、60、70 ℃对坚果样品进行氮吹。
1.2.3.4 定容试剂的选择 本文用丙酮:正己烷(3:7 V:V)提取,为了考察定容试剂对提取率的影响,分别用丙酮、正己烷对坚果样品进行最终定容。
1.2.3.5 磺化试剂体积的选择 考虑到定容后会有杂质产生,污染进样口、检测器等,研究使用0.5、1.0、2.0 mL 浓硫酸对样本进行磺化净化。
1.2.4 色谱条件 检测器:ECD;进样器温度:250 ℃;检测器温度:300 ℃;进样量:1.0 μL;不分流进样;载气:N2(纯度≥99.999%);流速:1 mL/min。升温程序为初始温度设置为100 ℃,保留1 min,以15 ℃/min升温至160 ℃,保留1.5 min,再以5 ℃/min 升温至280 ℃,保留10 min。
1.2.5 提取率的计算
式中:W 表示有机氯和拟除虫菊酯提取率,%;C样表示样品中有机氯和拟除虫菊酯的质量浓度,mg/mL;V样表示样品最终定容体积,mL;C标表示添加标品中有机氯和拟除虫菊酯的质量浓度,mg/mL;V标表示添加标品体积,mL。
1.3 数据处理
本实验数据经Origin Pro 9.0 绘图软件分析处理作出相应色谱图,采用WPS 2022 软件处理提取率、相对标准偏差等相关实验数据。
2 结果与分析
2.1 样品前处理条件的优化
2.1.1 提取溶剂的选择 农药残留分析中,根据农药极性、样本性质的不同选择不同极性的提取剂,常用的提取剂有乙腈、甲醇、丙酮、二氯甲烷、正己烷、石油醚。分别用乙腈、丙酮、正己烷,乙腈:丙酮(1:9、3:7、5:5、7:3、9:1 V:V)、乙腈:正己烷(1:9、3:7、5:5、7:3、9:1 V:V)、丙酮:正己烷(1:9、3:7、5:5、7:3、9:1 V:V)不同比例进行提取,考虑到使用正己烷提取样品时,提取率低,不能有效提取坚果组织中的残留农药;使用丙酮提取坚果样本时,提取油脂较多,不利于样本的下一步净化;乙腈能够有效提取多种农药残留,但价格相对较贵,且浓缩时间长,为了克服单一提取溶剂提取样本的不足,且正己烷:乙腈、丙酮:乙腈组合试剂提取率没有丙酮:正己烷组合试剂好,提取率为65.2%~115.7%,72.1%~116.3%,而丙酮:正己烷混合提取剂在后续的氮吹、净化效果,提取率方面均有较好的表现且通过数据得知用丙酮:正己烷(3:7,V:V)为提取试剂时,16 种有机氯、拟除虫菊酯类农药残留量提取率为93.5%~103.5%,相对标准偏差(relative standard deviation,RSDs)值为1.11%~3.62%。提取溶剂是确保样品中各类农药残留提取效率、准确度的关键因素[21-23],本文最终选择丙酮:正己烷(3:7,V:V)为提取试剂,具体结果如图1。

图1 不同提取试剂的提取率(n=6)Fig.1 The extraction rate of different extraction reagents (n=6)
2.1.2 提取次数的选择 采用丙酮:正己烷(V:V=3:7)对坚果样品提取1、2、3 次,考察提取次数对检测结果的影响。结果显示,提取1 次的提取率为93.9%~104.6%,RSDs 为1.11%~5.71%;提取2 次的提取率为93.1%~102.6%,RSDs 为1.21%~5.51%;提取3 次的提取率为93.5%~106.4%,RSDs 为1.0%~5.9%。具体结果见图2。提取次数的选择是16 种农药残留的提取效率的关键控制点[24],但随着提取次数的增加,提取液里面的杂质也显著上升,为后续除杂过程增加难度,且从成本,效率上考虑,试剂、人员花费时间较多,结合综合情况考虑将样品提取次数确定为1 次。
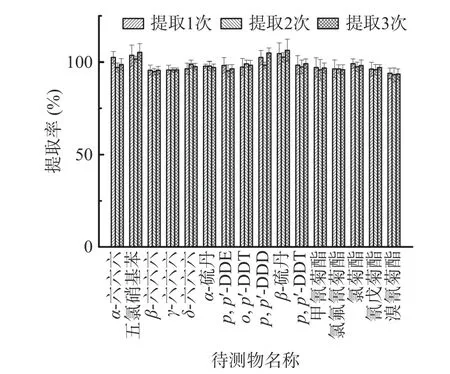
图2 提取次数对提取率的影响(n=6)Fig.2 Effects of extraction times on extraction rate (n=6)
2.1.3 氮吹温度的选择 本实验分别考察40、50、60、70 ℃氮吹温度对检测结果的影响,结果显示不同氮吹温度对坚果中有机氯、拟除虫菊酯的农药残留影响较大,40、50 ℃氮吹温度对有机氯影响不大,提取率为92.2%~107.9%,RSDs 为1.22%~4.91%,但随着温度的升高提取率有着明显的降低,拟除虫菊酯类农药残留在40 ℃氮吹温度下提取率均在92.4%~97.5%之间,RSDs 为1.11%~5.22%,在50、60、70 ℃氮吹温度提取率随着温度的升高越来越低,50 ℃提取率为85.1%~89.5%,60 ℃提取率为69.8%~77.4%,70 ℃提取率只有62.5%~67.4%,在较高温度氮吹下所检测物质可能发生分解,影响检测结果的准确性。不同氮吹温度的选择是16 种农药残留的提取效率的关键控制点[25],控制提取温度在40 ℃左右时,提取效果明显提升,但超过该温度后,提取效果相差较大[26]。所以研究选择40 ℃氮吹温度。具体实验结果见图3。

图3 不同氮吹温度对提取率的影响(n=6)Fig.3 Effects of different nitrogen blowing temperature on extraction rate (n=6)
2.1.4 定容试剂的选择 研究分别考察丙酮、正己烷作为样品上机定容试剂对检测结果的影响。用丙酮定容提取率为93.1%~112.6%,RSDs 为1.50%~5.31%;用正己烷定容提取率为92.9%~107.5%,RSDs为1.30%~5.14%,结果显示两者作为定容试剂,结果无差异。定容试剂的选择是16 种农药残留复溶提取的关键控制点[27-28],同时也影响实验色谱柱的使用寿命,常用的定容剂有丙酮、乙酸乙酯、正己烷、石油醚等。但是丙酮极性相对较大,对色谱柱损伤较大,对坚果中其他杂质也有很好的溶解效果,且与浓硫酸发生反应。所以研究选用正己烷作为定容试剂。具体结果见图4。
2.1.5 磺化试剂体积的选择 研究使用0.2、0.5、1.0 mL 浓硫酸对样本进行磺化处理,经不同体积浓硫酸磺化后,样本色谱峰无明显差异,杂质均能有效去除,提取率均能达到80%以上。磺化试剂体积的选择是16 种农药残留净化技术的关键控制点[29-30],添加体积较多的浓硫酸时,16 种农药残留的提取率没有明显提升,而过多的浓硫酸对色谱柱和仪器有较大的伤害,SN/T 0145-2010《进出口植物产品中六六六、滴滴涕残留量测定方法 磺化法》需要2~3 次磺化,六六六和滴滴涕提取率范围在77.8%~104.0%,而本实验选用0.2 mL 的浓硫酸作为磺化试剂体积一次磺化,且提取率在83.2%~101.1%。单样品检测时间短,提高了16 种农药残留检测效率。具体结果见图5。
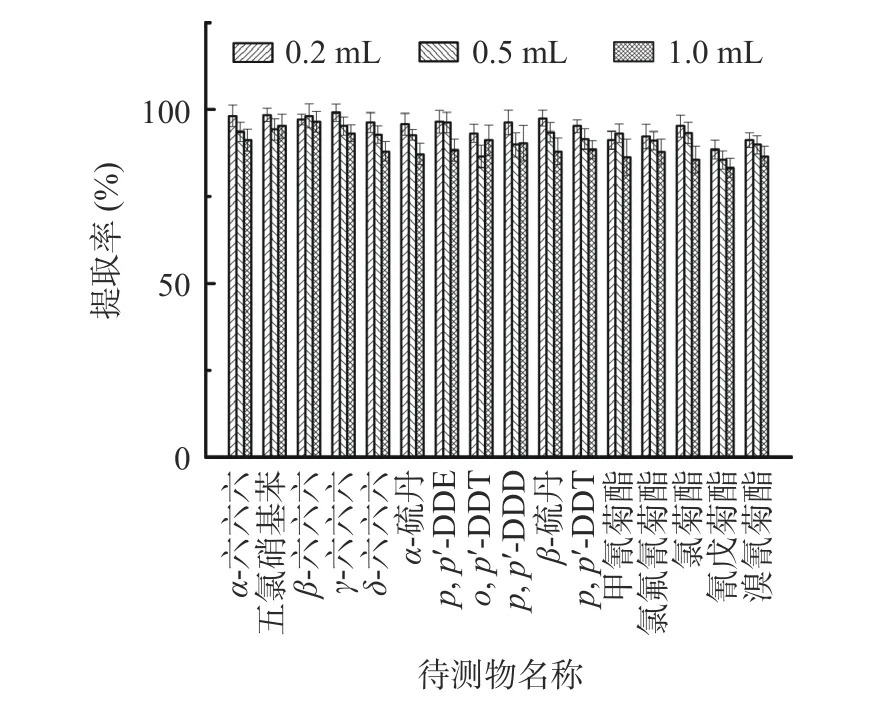
图5 不同体积浓硫酸磺化样本对检测结果的影响(n=6)Fig.5 Effects of sulfonated samples with different volumes of concentrated sulfuric acid on test results (n=6)
2.2 方法学验证
2.2.1 线性关系与检出限 本研究采用在空白基质坚果样品中添加经逐级稀释的混合标准工作液进行加标实验,以各农药的质量浓度(X,μg/mL)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。考察16 种有机氯、有机磷、拟除虫菊酯类的农药残留。在相应线性范围内,各农药分离效果较好,结果见图6,且线性关系良好,决定系数(r2)均在0.996 以上。结果按照3 倍信噪比(S/N=3)计算方法检出限满足检测的要求。计算得出本方法中的各物质检出限在0.1~0.4 μg/kg 之间,结果见图6 和表1。结果表明基于GC 检测坚果中的16 种农药残留具有较高的灵敏度,检出限较低,具有较强的可行性。

图6 16 种有机氯、拟除虫菊酯类农药混合标准色谱图(0.10 μg/mL)Fig.6 Standard chromatograms of 16 organochlorine and pyrethroid pesticides (0.10 μg/mL)
2.2.2 加标提取率及精密度 为了考察方法的准确性,分别于开心果、澳洲坚果、紫皮腰果、碧根果、核桃、巴旦木基质的空白样品中加入不同浓度水平的混合标准溶液,分别制备得到为10、40、100 μg/kg不同质量浓度的3 个加标样品,每个加标浓度分别制备6 个平行样品,计算其平均提取率及精密度。检测结果显示样品检测提取率为81.6%~119.5%,RSDs 为1.03%~5.36%,满足GB/T 27404-2008《实验室质量控制规范 食品理化检测》附录F.1 和F.3相关要求,采用本研究方法与GB/T 5009.19-2008《食品中有机氯农药多组分残留量的测定》、GB/T 5009.110-2003《植物性食品中氯氰菊酯、氰戊菊酯和溴氰菊酯残留量的测定》、SN/T 0145-2010《进出口植物产品中六六六、滴滴涕残留量测定方法 磺化法》、NY/T 761-2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》方法进行对比实验,本研究方法检测开心果、澳洲坚果、紫皮腰果、碧根果、核桃和巴旦木平均提取率为87.2%~103.5%,国家标准方法的提取率范围为82.6%~105.1%,结果优于国家标准方法。表明本方法的准确度和精密度较好,能够用于坚果中16 种有机氯、拟除虫菊酯类农药残留量的测定。具体数据见表2、图7。

表2 不同基质的加标提取率和精密度(n=6)Table 2 Spiked extraction rates and RSDs of spiked standard in different matrices (n=6)

图7 不同检测方法提取率对比(n=3)Fig.7 Comparison of extraction rates of different detection methods (n=3)
2.2.3 准确度 本研究的准确度采用GB/T 27404-2008 附录F.5 中提出的“重复分析标准物质(实物标样)或水平测试品,测定含量(经提取率校正后)平均值与真值的偏差”的方法进行评定。由于寻找16 种农残质控样较为困难,所以实验采样空白样品加标的方式,约定理论加标量为真值。实验制备20 μg/kg加标样品,进行6 次平行检测,同时检测样品的提取率,计算平均值,经提取率校正后得到测定值,测定值与约定真值的偏差范围在-6.5%~+9.0%,满足GB/T 27404-2008 附录F.5 中规定的测定真值在0.010~10.000 mg/kg 范围内,偏差范围为-20%~+10%的要求,说明本方法检测结果准确、可信,具体结果见表3。
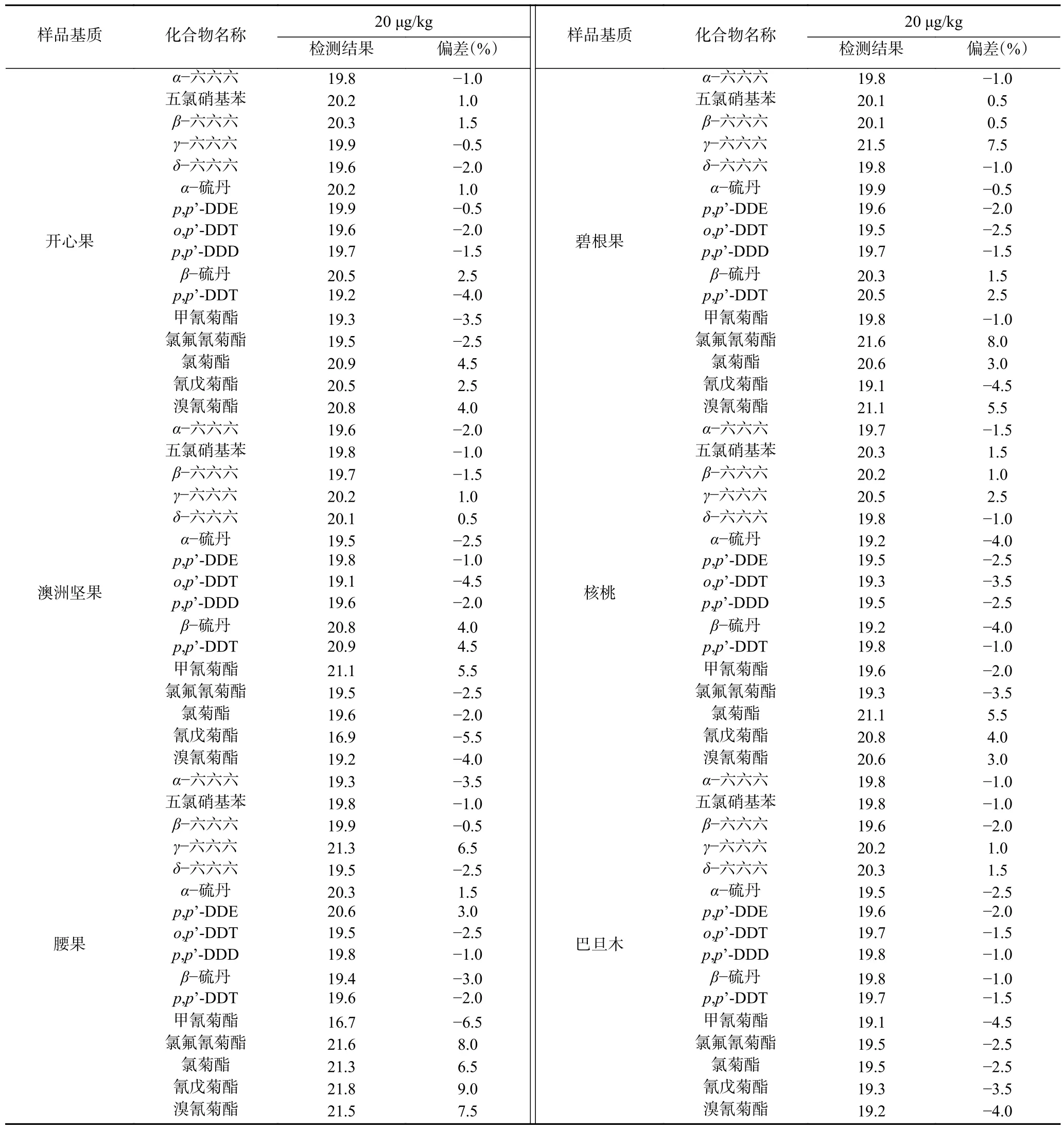
表3 检测结果与约定真值的偏差(n=6)Table 3 Detection deviations of measured values and the conventional true value (n=6)
2.3 实际样品的测定
从市面上购买开心果、澳洲坚果、紫皮腰果、碧根果、核桃、巴旦木各5 份样品采用本研究方法进行检测,均未检出上述16 种有机氯、拟除虫菊酯类农药残留,检测结果均符合GB 2763-2014 要求。
3 结论
本研究基于浓硫酸磺化净化技术,建立了一种气相色谱法测定坚果中16 种有机氯、拟除虫菊酯类农药残留量的分析方法。通过对样品提取条件的优化,采用丙酮:正己烷(3:7,V:V)提取坚果中16 种有机氯、拟除虫菊酯类农药残留,对6 种坚果样品提取1 次,用40 ℃氮吹温度,最终用正己烷定容,0.2 mL浓硫酸磺化净化,探索出适用于16 种有机氯、拟除虫菊酯类农药残留检测方法。有机氯、拟除虫菊酯类农药残留在35 min 内达到完全分离,本研究方法16 种物质的检测限在0.1~0.4 μg/kg 之间,决定系数(r2)均大于0.996,提取率为81.6%~119.5%,RSDs为1.03%~5.36%。本研究方法前处理简单高效、提取率、精密度良好,可作为坚果企业实验室农药残留检测筛查参考方法,能够满足科学研究、监管监测要求,具有较高的实际应用价值。

