可溶性共刺激分子在自身免疫性皮肤病中的研究进展
陈 璐 张晓艳 胡 颖 姚昱旭 季 江 焦晴晴
1苏州大学附属第二医院皮肤性病科,苏州,215004;2苏州大学附属第一医院皮肤性病科,苏州,215006
自身免疫性皮肤病是一组临床表现复杂,机体产生病理性自身免疫应答,引起皮肤甚至其他器官组织损害或功能异常的疾病[1]。常见的疾病有系统性红斑狼疮(systemic lupus erythematosus, SLE)、硬皮病(scleroderma)、白塞病(behcet disease, BD)、白癜风(vitiligo)、皮肌炎(dermatomyositis, DM)和自身免疫性大疱性皮肤病(autoimmune bullous diseases,AIBD)等。共刺激分子(costimulatory molecules)为免疫细胞的活化提供共刺激信号,参与机体免疫应答和免疫耐受的建立,与自身免疫性皮肤病的免疫调控和发生发展密切相关[2]。大部分共刺激分子都存在可溶性形式,这些可溶性共刺激分子(soluble costimulatory molecules)参与共刺激信号的传递并发挥重要的自我调控作用。本文主要对可溶性共刺激分子在自身免疫性皮肤病中的研究进展作一综述。
1 可溶性共刺激分子的概述
可溶性共刺激分子(soluble costimulatory molecules)是共刺激分子的可溶性形式,存在于血清和血浆中。这些可溶性共刺激分子一般通过两种途径产生:mRNA选择性剪接途径,膜结合共刺激分子的mRNA剪接掉跨膜区和胞内区部分后再翻译形成可溶性共刺激分子;膜结合分子酶切脱落途径,膜结合共刺激分子的胞外段通过蛋白酶的作用脱落即形成可溶性共刺激分子[3]。也有些可溶性共刺激分子的产生途径尚不明确,还需进一步研究。可溶性共刺激分子具备重要的免疫调控功能,它们可以与细胞表面的共刺激受体相结合,直接产生共刺激信号,作用于效应细胞;或者与共刺激配体相结合,阻断共刺激信号的传递,抑制效应细胞的功能;也可以与游离的可溶性共刺激受体或配体结合,阻止其与膜结合共刺激分子结合[2]。因此,共刺激分子的可溶性形式既可以发挥与膜形式相同的功能,也可发挥相反的功能。可溶性共刺激分子在膜结合共刺激分子基础上,增加了共刺激分子的功能多样性。部分研究结果显示,在病理状态下,可溶性共刺激分子水平会有异常增高或降低,并与临床特征有明显相关性,且可溶性共刺激分子的表达情况会影响膜结合共刺激分子的表达水平[4]。
2 可溶性共刺激分子与自身免疫性皮肤病
2.1 免疫球蛋白超家族(immunoglobin superfamily,IGSF)
2.1.1 CD28 CD28是共刺激受体,广泛分布于T细胞表面。B7-1(CD80)和B7-2(CD86)是CD28的两个主要配体,主要在抗原提呈细胞(antigen presenting cell, APC)表面表达。可溶性CD28可以通过膜结合CD28裂解产生,也可以通过选择性剪接mRNA翻译产生。体外实验表明,与膜结合CD28不同,可溶性CD28可以抑制T细胞的反应。可溶性CD28的浓度在多种自身免疫性皮肤病患者中升高,并与疾病的严重程度及活动度相关。在系统性红斑狼疮患者血清中,sCD28水平升高,CD8+CD28+T细胞亚群减少,且与疾病活动指数(SLEDAI)呈负相关[5]。与健康受试者相比,系统性硬皮病(systemic sclerosis, SSc)患者的可溶性CD28水平显著升高,且和混合性结缔组织病相关的SSc患者的可溶性 CD28水平显着高于孤立性SSc患者[6]。此外,CD28可能通过激活T细胞增加了促炎和促纤维化细胞因子的产生,如TNF、IL-2、IL-6和IL-10,从而参与系统性硬皮病的发病。同时,在干燥综合征患者和白塞病患者中也发现血清sCD28 水平升高,并与疾病严重程度和活动度呈正相关[7]。研究推测,膜结合CD28的可溶性脱落是一种抑制CD28/B7激活途径的调控机制[3]。
2.1.2 CTLA-4 CTLA-4是共抑制受体,表达于活化的T细胞和调节性T细胞表面。CTLA-4对B7-1/B7-2的亲和力比CD28强,可竞争性结合B7-1/B7-2,抑制T细胞功能。CTLA-4的可溶性形式已被发现,通过选择性剪接mRNA产生,保留了与APC上B7-1/B7-2配体结合的能力,并具有免疫调节功能。体外研究表明,sCTLA-4可以抑制抗原特异性增殖以及IFN-γ、IL-17等促炎因子分泌,同时增加TGF-β、IL-10等免疫抑制因子分泌。研究发现, SLE患者的血清sCTLA-4水平相对升高。在狼疮相关自身抗原衍生肽刺激下,SLE患者的IL-10表达升高,而健康对照组IFN-γ、IL-17表达升高。天然免疫抑制剂sCTLA-4可以抑制抗原特异性细胞因子反应,通过抗体阻断其活性会增强对照组和SLE患者的细胞因子反应。sCTLA-4血清水平在系统性硬皮病患者中也显著升高,并与疾病严重程度正相关[7]。阻断CTLA-4会抑制M2巨噬细胞分化,而促纤维化M2型巨噬细胞是导致硬皮病患者疾病持续的重要因素。可溶性CTLA-4在自身免疫性皮肤病中的生物学功能尚未完全明确,可能起着双重作用。一方面,sCTLA-4 通过阻断CD28与B7-1/B7-2相互结合提高T细胞共刺激的阈值,从而特异性地抑制T 细胞早期活化;另一方面,较高水平的 sCTLA-4 可以在T淋巴细胞激活后期与膜结合CTLA-4 竞争性结合 B7-1/B7-2,导致抑制性信号传导减少[6,7]。sCTLA-4的这种双重特性可能会在自身免疫性皮肤病的发病进程中引起不同的结果,进而影响自身免疫性皮肤病的发展和预后。Abatacept是第一个可溶性CTLA-4免疫球蛋白融合蛋白,已批准用于类风湿性关节炎,在银屑病、皮肌炎、系统性红斑狼疮、硬皮病、干燥综合征等自身免疫性皮肤病方面也有相关研究[8]。其他CTLA-4相关药物,如Belatacept、MEDI5256、XPro9523等也在开发并用于临床研究[2]。
2.1.3 ICOS ICOS是共刺激受体,在结构上与CD28相似,在活化的T细胞上表达,与其配体 ICOSL(B7RP1)结合,对滤泡辅助性T细胞(follicular helper T cell, Tfh)的形成和功能维持、生发中心的形成、T细胞的扩增、T细胞依赖性抗体的产生和B细胞的同型转换至关重要。sICOS和sICOSL在自身免疫性皮肤病的免疫调节中,既可以作为拮抗单体,也可以作为激动性二聚体。研究发现,系统性硬皮病患者的血清 sICOS 水平显著升高,且sICOS水平不仅与皮肤纤维化的程度相关,也与间质性肺炎的患病率和严重程度相关,同时早期SSc患者的sICOS水平显着高于晚期SSc患者,提示sICOS水平可能是评估SSc疾病活动度及严重程度的有效生物标志物[9]。活化的T细胞中ICOS过度表达可诱导促炎(IFN-γ、IL-17)和促纤维化(IL-4)细胞因子合成,从而促进成纤维细胞活化和细胞外基质合成。目前,ICOSL阻断抗体,如Prezalumab(AMG 557)和AMG 570,已在系统性红斑狼疮等自身免疫性疾病方面展开研究[10]。
2.1.4 PD-1 PD-1是共抑制受体,在活化的T细胞、部分调节性T细胞、B细胞、髓样树突状细胞和单核细胞表面稳定表达。PD-1与其配体PD-L1(B7-H1,CD274)和PD-L2(B7-DC,CD273)连接,提供抑制信号维持T细胞活化、耐受和免疫应答的平衡。可溶性PD-1和PD-L2主要通过对由五个外显子组成的全长 PD-1 mRNA进行选择性剪切而产生,而可溶性PD-L1则主要由膜结合蛋白的蛋白裂解产生。T细胞的体外活化已显示可产生sPD-1,并且发挥重要的免疫调节作用,且在多种自身免疫性疾病中观察到sPD-1和sPD-L水平异常。可溶性PD-L1保留了其结合能力和抑制特性,能够抑制T细胞激活,减少IFN-γ的分泌和诱导T细胞凋亡。此外,sPD-1、sPD-L1还可以通过阻断细胞或外切体膜上表达的膜结合PD-1、PD-L1的抑制功能来发挥受体拮抗剂作用。多项研究显示,系统性红斑狼疮患者sPD-1和 sPD-L的血清水平相对于健康对照组显著升高,并与疾病活动度、严重程度及相关实验室指标密切相关,且发现sPD-1与sPD-L的表达水平之间呈正相关,此外血清中sPD-1的水平随着治疗后疾病的改善而显著降低[11]。同时,PD-1和sPD-L1的相互交联显示了其在系统性红斑狼疮患者T细胞的增殖和细胞因子的产生中起抑制作用。sPD-1和sPD-L2的血清水平在系统性硬皮病患者中也升高,且皮肤弥漫性SSc(diffuse cutaneous systemic sclerosis,dcSSc)比皮肤局限性SSc(limited cutaneous systemic sclerosis,lcSSc)更明显。此外,sPD-1、sPD-L2的表达水平与皮肤凹痕、肺纤维化等发生呈正相关。与健康对照组相比,寻常型天疱疮(bullous pemphigoid,PV)患者的sPD-1血清水平显著降低,且活动期患者的sPD-1水平比缓解期患者更低,同时sPD-1血清水平与疾病的严重程度呈负相关[12]。免疫性血小板减少性紫癜(immune thrombocytopenic purpura, ITP)患者的sPD-1血清浓度显着高于对照组,且与血小板计数呈负相关,可用于评估 ITP 的严重程度。体外研究显示,使用sPD-L1激活PD-1/PD-L1通路可以改善ITP患者免疫细胞亚型的失衡[13]。针对PD-1/PD-L通路,在癌症治疗中通过阻断PD1途径增强免疫反应,已有较成熟方案,而在自身免疫治疗方面则通过激动PD-1以引起免疫抑制,相关药物(如CC-90006)的临床开发还处于早期阶段[2]。因此,sPD-1、 sPD-L与自身免疫性皮肤病的严重程度、疾病进展及免疫异常相关,有望成为潜在的生物标志物及免疫治疗靶点。
2.1.5 TIM-3 Tim-3是新一代共抑制受体,属于TIM家族的成员,主要在Th1和Th17细胞、调节性T(Treg)细胞、先天免疫细胞等多种免疫细胞上表达。TIM-3与其配体Galectin-9相互作用提供抑制信号,参与机体免疫应答。可溶性Tim-3通过膜结合Tim-3的蛋白裂解产生,目前没有已知的人类TIM-3前mRNA的选择性剪接。研究显示,系统性红斑狼疮患者的sTim-3和sGalectin-9表达水平与对照组相比显著升高,并在清除凋亡细胞中发挥抑制作用,且与SLE疾病活动度和有无器官受累呈正相关。同时,sTim-3和sGalectin-9的血清水平有助于评估SLE疾病活动度随治疗的变化[14]。系统性硬皮病患者的sTim-3和血清水平也显著升高,且与皮肤硬化程度呈正相关,也与较高的死亡率和严重的器官受累有关。同时,sGalectin-9的表达水平在大疱性类天疱疮患者中也显著升高[15]。与大疱性类天疱疮(bullous pemphigoid,BP)相比,寻常性天疱疮患者的的sTim-3水平显著降低[16]。此外,类固醇治疗可以显著降低血清sTIM-3水平。
2.1.6 其他 BTLA是共抑制受体,主要在B细胞和T细胞中表达,在先天免疫细胞中也有表达。HVEM是人类细胞中唯一可检测到的已识别配体,属于肿瘤坏死因子超家族,可以以顺式异构或反式异构的方式与BTLA相互作用。在SLE患者中,BTLA抑制T细胞激活的能力下降,并发现CD4+T细胞的BTLA功能受损与疾病活动度[17]。针对SLE患者的BTLA抗体已获得专利,可能会进一步开发相关药物。LAG3是共抑制受体,在多种免疫细胞中表达,可与MHC II类分子结合传递抑制信号。可溶性LAG3通过蛋白酶切脱落产生,不与膜结合LAG3竞争性结合MHC II分子,并在体内迅速降解,但其对提高T细胞功能是必不可少的。因为阻止可溶性LAG3脱落的LAG3突变体会降低T细胞功能,表现为增殖减少以及IL-2和IFN-γ的表达降低[18]。GSK2831781 是一种抗LAG3的单克隆抗体,已在I/Ib期临床试验中发现了可改善银屑病的早期证据,并在溃疡性结肠炎患者中也进行了相关临床研究[19]。SLAMF3、SLAMF6属于SLAM家族,在SLE患者T细胞上表达升高,并与疾病严重程度相关。同时,其配体SAP家族成员也参与了SLE的致病过程。
2.2 肿瘤坏死因子超家族(tumor necrosis factor Superfamily,TNFSF)
2.2.1 CD40 CD40是共刺激受体,可在免疫和非免疫细胞上表达。CD40与其配体CD40L(CD154)的相互作用在促进生发中心形成和抗体产生方面发挥着关键作用。可溶性CD40和CD40L可由两种形式产生,即mRNA选择性剪接和TNF-α转换酶蛋白水解切割。sCD40 可以通过与B淋巴细胞表面的CD40L结合抑制其产生免疫球蛋白,这表明sCD40可以调节CD40/CD40L之间的相互作用。sCD40的裂解和释放依赖于细胞接触,这可能是其调节B细胞活化的机制。研究显示,系统性红斑狼疮患者可溶性CD40水平显著高于对照组,且高水平sCD40与SLE的组织损害有关[20]。系统性硬皮病患者的sCD40和sCD40L水平也显著高于对照组,且可能与血管并发症的发生相关,如肺动脉高压、手指溃疡和破坏性外周微血管病等[21]。同时,CD40L在预测SSc治疗反应方面也存在潜在价值。针对CD40/CD40L共刺激通路,免疫治疗方面既有抗CD40单克隆抗体也有抗CD40L单克隆抗体正在研发并进行临床研究中。在自身免疫性皮肤病方面,Dapirolizumab pegol是抗CD40L单克隆抗体,目前正在进行治疗SLE的Ⅲ期临床试验[22]。Iscalimab(CFZ533)是抗CD40抗体,可改善原发性干燥综合征患者的临床结局,但其疗效仍然需要在更大的临床试验中进行评估[23]。
2.2.2 OX40 OX40是共刺激受体,主要在活化的T 细胞表面表达。OX40L(CD252、CD134L、gp34)是OX40的配体,主要表达于抗原呈递细胞表面。OX40/OX40L在增强效应T细胞的功能、维持其稳定和抑制其凋亡方面发挥关键作用。可溶性OX40以类似于TNF受体超家族其他成员的方式,通过膜结合蛋白脱落、mRNA选择性剪接或两者同时产生。可溶性OX40可以与APC细胞上的OX40L结合,干扰其对OX40+T细胞的正性共刺激信号传输,从而抑制T细胞的激活。此外,可溶性OX40L可以促进T细胞的晚期增殖和活化,但不影响早期增殖及活化,其与活化T细胞上的膜结合OX40结合,并允许T细胞接收持续的正性共刺激信号。可溶性OX40的表达水平在各种自身免疫性和炎症性疾病中均表达异常。系统性硬皮病患者的sOX40和sOX40L血清水平显著升高,并提示可以预测皮肤和肺纤维化的恶化程度。研究显示,系统性红斑狼疮患者的sOX40L血清浓度高于健康对照组,且与疾病活动指数(SLEDAI)呈正相关[24]。此外,免疫性血小板减少性紫癜患者血浆sOX40L浓度也明显升高,且与血小板计数相关,同时抗血小板自身抗体阳性患者的sOX40L水平明显高于阴性患者[25]。目前的临床数据表明,靶向OX40/OX40L通路可能安全且耐受良好,但尚不清楚是否已实现完全通路阻断,或对促炎和抗炎免疫细胞的影响是否会影响疗效。在自身免疫性皮肤病方面,GBR 830是中度至重度成人特应性皮炎的有效治疗选择,但仍需要进一步的大规模研究[26]。
2.2.3 CD137 CD137是共刺激受体,主要在活化的T细胞和NK细胞上表达。CD137与其配体CD137L相互作用可以刺激T细胞活性。可溶性CD137通过mRNA选择性剪接产生,保留了膜结合CD137的胞外结构域,同时也保留了与 CD137L结合的能力。CD137 /CD137L系统中存在双向信号传导,sCD137可以通过两种机制拮抗膜结合CD137的活性。其一,可以与膜结合CD137竞争性结合CD137L;其二,可以插入到膜结合CD137的一个三聚体中,从而破坏该三聚体的信号传导能力。研究显示,系统性红斑狼疮患者的sCD137和sCD137L血清水平升高,但其临床意义尚不明确[27]。在小鼠模型中,易患SLE小鼠的sCD137水平较野生型小鼠升高,且拮抗sCD137会上调小鼠脾脏中IL-10和IL-12的产生,表明sCD137在促炎免疫反应方面发挥了重要的调节作用[28]。
2.2.4 其他 TNFR/TNF通路已被广泛应用于自身免疫性疾病,针对TNFR1、TNFR2及其配体TNF的生物制剂已被批准用于包括银屑病,银屑病性关节炎等在内的自身免疫性疾病。可溶性TNFR1还可作为系统性红斑狼疮和狼疮性肾炎疾病活动度的血清标志物[29]。相关研究显示,CD30也可能参与系统性红斑狼疮及硬皮病的发病机制。此外,BAFFR、TACI和 BCMA与BAFF和APRIL相互作用也参与多种自身免疫性皮肤病的发病机制,并有相关药物正处于临床研究中。其中,Ianalumab(VAY736)是一种抗BAFFR抗体,在原发性干燥综合征的IIb期临床试验中具有良好的耐受性和安全性,并在系统性红斑狼疮和寻常型天疱疮等自身免疫性皮肤病中进行相关临床研究[30]。
3 小结
随着对可溶性共刺激分子的不断探索,越来越多的证据表明,可溶性共刺激分子与自身免疫性皮肤病的发病机制和疾病进展密切相关,并可通过靶向共刺激分子治疗自身免疫性皮肤病。在临床诊疗方面,可溶性共刺激分子可作为自身免疫性皮肤病严重程度及活动度的评价指标,也可以作为疾病发展的预测指标,以及用来评估治疗的有效性。并且,通过血浆或血清测定可溶性共刺激分子具有更加便捷、成本低和无创等优势。在免疫治疗方面,共刺激通路是自身免疫治疗的天然靶点,通过靶向共刺激通路来改变T细胞的免疫环境是治疗自身免疫性皮肤病的一个主要目标。可溶性共刺激分子作为免疫干预治疗的潜在靶标,应进一步考虑其作为能够影响配体功效的潜在共靶点的应用价值。靶向共刺激分子在癌症治疗中已取得较明确成果,在自身免疫性疾病的治疗中也有相关药物问世,并取得较好的疗效。此外,大量针对共刺激分子的治疗方法正在被开发并投入临床试验中。可溶性共刺激分子在自身免疫性皮肤病中的研究前景可观,不断有新型共刺激分子被挖掘,部分共刺激分子及其可溶性形式在自身免疫性疾病中的研究还处于初步阶段,相关应用也还不成熟,但相信随着技术发展及研究深入,会为临床研究者和患者提供更多可能性。
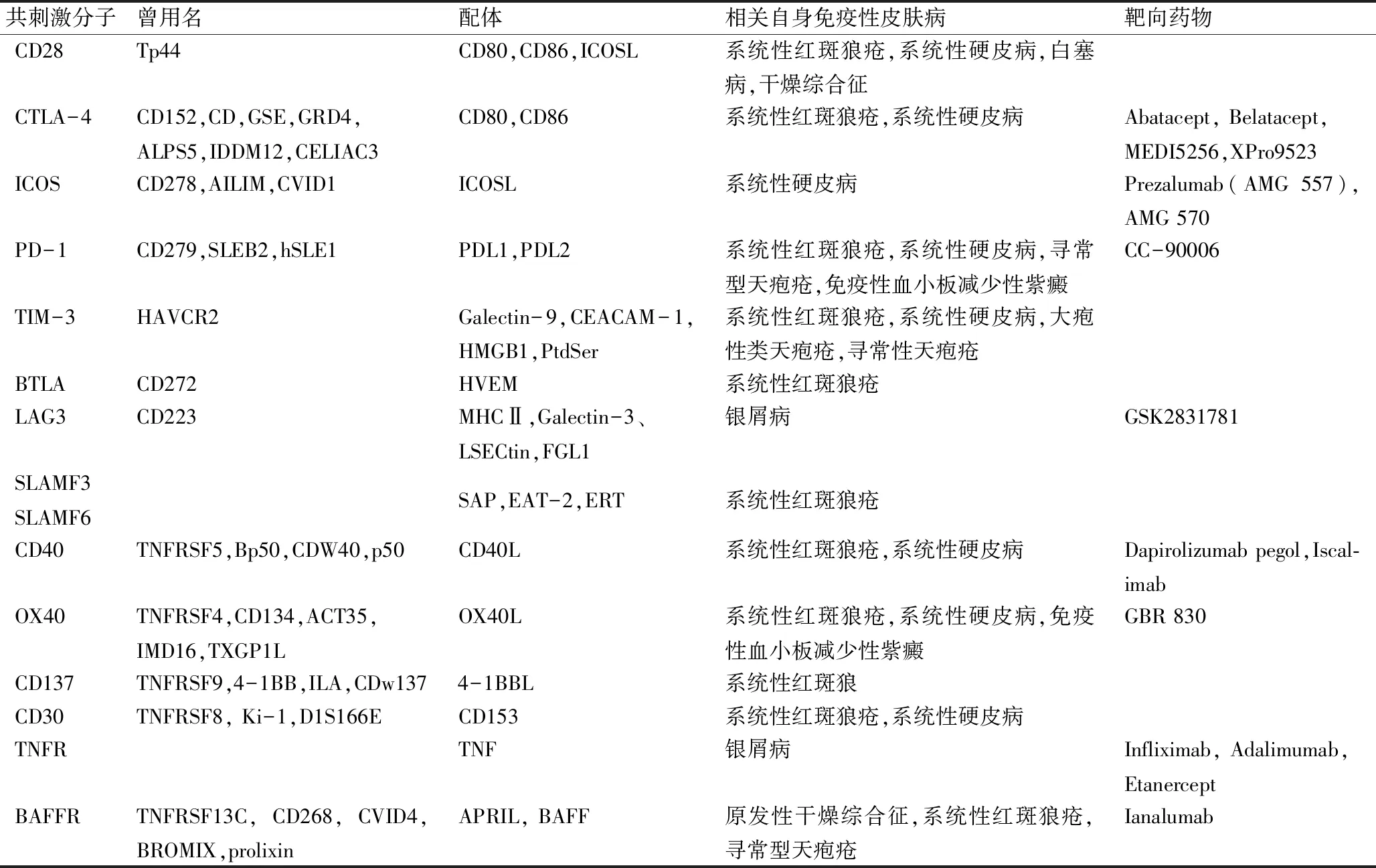
表1 可溶性共刺激分子在自身免疫性皮肤病中的作用

