饲料中添加白术提取物对日本沼虾生长、健康和抗病力的影响
白茹雪 花罗海刘昊昆 张月星朱晓鸣杨云霞韩 冬金俊琰张志敏田继业解绶启
(1.浙江海洋大学国家海洋设施养殖工程技术研究中心,舟山 316022;2.中国科学院水生生物研究所鱼类生理生态实验室,武汉 430072;3.保定冀中生物科技有限公司,保定 071000)
白术(Atractylodes macrocephalaKoidz)是菊科植物白术的干燥根茎,归脾、胃经,味苦、甘而性温,具有健脾益气,燥湿利水等功效[1]。白术中的有效成分包括内酯类、挥发油及多糖等[2],具有多种药理作用,包括调节免疫、改善胃肠道功能、调节肠道菌群、促进肠道黏膜溃疡和伤口愈合、抗炎、抑菌、改善糖代谢等[3]。白术提取物中的主要成分是白术多糖,白术多糖因具有降糖、抗氧化、抗肿瘤、抗病毒、促进生长和增强机体免疫维护肠道健康等作用而被广泛使用[4]。研究发现,白术可作为绿色添加剂,改善养殖动物的生产性能。岭南黄鸡日粮中添加400 mg/kg的白术多糖,显著降低其采食量和料重比,并且增强其机体的免疫能力[5];仔猪日粮中添加微粉白术可显著提高其日增重,并降低其料重比和腹泻率[6]。在黄颡鱼(Pelteobagrus fulvidraco)的研究中发现饲料中添加250和500 mg/kg白术多糖可以改善豆粕替代鱼粉带来的肠道损伤[7],大口黑鲈(Micropterus salmoides)上的研究表明饲料中添加400 mg/kg白术多糖具有提高生长性能、改善肠道健康的作用[8],在凡纳滨对虾(Litopenaeus vannamei)的研究发现,饲料中添加含有0.0325%白术多糖的益生元具有提高凡纳滨对虾血清中酚氧化酶和溶菌酶活性的能力,还能提高哈维氏弧菌(Vibrio harveyi)攻毒后存活率[9]。仔猪[10,11]和樱桃谷鸭[12]的研究也发现白术多糖具有促进生长、降低料重比及增强免疫的作用。
日本沼虾(Macrobrachium nipponense)又名青虾、河虾,主要生活在江河、湖泊及池塘等淡水水域中,在中国、日本和东南亚国家广泛养殖[13]。2021年我国日本沼虾养殖总产量达到22.44万吨[14]。尽管日本沼虾养殖的发展迅速,但随着养殖密度的不断增加、养殖水环境恶化,以及病害防治不规范等因素,日本沼虾面临的病害问题日趋严重,导致产量下降。嗜水气单胞菌(Aeromonas hydrophila)是一种广泛分布在水体环境中的革兰氏阴性菌;它是一种条件致病菌,能够导致养殖鱼虾大量死亡,有文献报道2019年在上海虾类养殖区,嗜水气单胞菌感染造成虾病害的死亡率达到50%—100%[15]。Ramadan 等[16]发现从水生动物中分离出的嗜水气单胞菌,普遍出现多重耐药的现象。
为了预防和控制细菌性疾病,抗生素被应用于水产养殖中,但养殖过程中存在乱用药、用药不当、用药过度等情况。滥用抗生素产品会导致药物残留,还会促进耐药性,破坏水环境生态平衡。中草药具有抗病菌、抗病毒的作用,不易产生抗药性,并且具有促进动物生长方面和提高免疫力的作用。已有多种中草药作为饲料添加剂[17],部分已应用于水产养殖生产。中草药作为饲料添加剂在生产上具有广泛的应用前景,为了更好提高水产养殖动物的生长性能和抗病能力,有必要在水产领域开展中草药类饲料添加剂的研发工作。本文以日本沼虾作为研究对象,探究了白术提取物作为中草药添加剂对其生长、健康和抗病力的影响,为水产绿色饲料添加剂的开发和应用提供科学依据。
1 材料与方法
1.1 实验动物及养殖实验
实验采用的日本沼虾为太湖2号,虾苗来自中国水产科学研究院淡水渔业研究中心大浦青虾实验基地。实验养殖在循环水养殖系统中进行,由36个玻璃纤维养殖缸组成,缸内放入塑料水草为日本沼虾提供庇护。实验用虾经1周的暂养以适应实验环境,挑选2160尾均匀且健康的日本沼虾幼苗,每尾虾重(0.21±0.05) g,随机分配至36个循环水养殖缸中,每个养殖缸放入60尾虾,养殖缸随机分为6个处理组,每个处理组6个重复。在实验期间每天投喂2次,分别于9: 00和17: 00定时投喂,喂食后排出污水,清理排泄物。投喂量为日本沼虾体重的3%—5%,每天收集残饵,烘干后称重以矫正摄食量。养殖期间水体温度为(20±3)℃,pH为7.8—8.2,亚硝酸盐为0.16—0.2 mg/L,氨氮为0.02—0.1 mg/L,溶氧>6.0 mg/L,实验周期为75d。
1.2 实验饲料
根据日本沼虾的营养需求设计日本沼虾基础饲料。饲料以秘鲁鱼粉、豆粕和菜粕为蛋白源,以大豆油为脂肪源,配方成分见表1。基础饲料为对照组(Control),分别在基础饲料上添加白术提取物(白术多糖含量60%,保定冀中生物科技有限公司,保定,河北,中国)100、200、400、600和1200 mg/kg(A100、A200、A400、A600和A1200),配制出6种等氮等能的实验饲料,本实验白术提取物采用水煎提取法,产地来自浙江。将各种原料超微粉碎后,按照配方称重并且利用逐级扩大混合,最后添加豆油和水搅拌混匀,在制粒机(SLR-45,中国水产科学院渔业机械研究所)加工成为直径为1 mm的颗粒饲料,75℃烘干后放置-20℃冰箱中备用。

表1 基础饲料配方及化学组成(%干物质)Tab.1 Diet formulation and chemical composition of control diet(% in dry matter)
1.3 样品采集
在实验开始时,称量日本沼虾的初始体重。在养殖实验结束后,停食24h。每个缸进行称重并记录。计算增重率(Weight gain rate,WGR)、特定增长率(Special growth rate,SGR)、饲料系数(Feed Coefficient,FC)和摄食率(Feeding rate,FR)。每个缸随机取9尾虾,分别测量虾的体长、体重、肝胰腺和肌肉重,用于计算肝体比(Hepatosomatic index,HSI)、肥满度(Condition factor,CF)和出肉率(Meat percentage,MP)。用柠檬酸葡萄糖抗凝剂(4℃预冷)润洗的注射器于虾的头胸甲处抽取血淋巴液,血淋巴使用混合样本,每个缸采集9只虾的混合样本。放入预先润洗过的离心管中。血淋巴液在4℃、3000 r/min条件下离心10min分离血清,血清保存于-80℃冰箱,用于血清生化指标测定。在血液采集完毕后,在冰上迅速采集虾的肝胰腺和肠道,并立即放入液氮中速冻,随后放入-80℃冰箱中保存,用于后续生化分析。取3尾虾的肝胰腺、鳃和肠道组织,保存在4%多聚甲醛溶液中,室温固定过夜,用于制作组织HE染色切片。
1.4 攻毒实验
嗜水气单胞菌由中国科学院水生生物研究所健康养殖实验室李爱华老师提供,将嗜水气单胞菌接种于营养琼脂培养基进行菌种复壮,挑取单克隆菌落用于液体培养基的扩大培养,收集菌液用灭菌生理盐水清洗后稀释到适宜浓度。经预实验确定致病菌攻毒的半致死浓度为3.84×107CFU/mL。在取样结束后,将剩余实验虾用相应饲料继续投喂5d使其恢复正常状态,从实验组每缸中随机取15尾虾,在第二腹节部肌肉注射致病菌菌液,记录各缸的死亡数量并计算存活率。
1.5 测定指标
生长性能
增重率(Weight gain rate,WGR,%)=100×(末均重-初均重)/初均重
特定生长率(Specific growth rate,SGR,%/d)=100×(ln末重-ln初重)/饲养天数
存活率(Survival rate,SR,%)=末尾数/初尾数×100
饲料系数(Feed Coefficient,FC)=摄食量/(末重-初重)
蛋白沉积率(Protein retention efficiency,PRE,%)=(终末鱼体蛋白-初始鱼体蛋白)/蛋白摄入量
摄食率(Feeding rate,FR,%BW/d)=100×平均每尾虾干物质摄入总量/[投喂天数×(平均末重+平均初重)/2]
肥满度(Condition factor,CF,g/cm3)=(体重/体长3)×100
肝体比(Hepatopancreas index,HSI)=肝脏重/体重×100
出肉率(Meat percentage,MP,%)=肌肉重/体重×100
基本组分参考AOAC(2003)对水分、灰分、粗脂肪和粗蛋白进行测定,干物质和灰分测定使用失重法,将样品在烘箱内105℃烘干至恒重测得;灰分测定将样品在马弗炉中550℃灼烧12h以失重法测得;粗脂肪利用氯仿甲醇溶液提取脂肪,将抽提得到的脂肪烘干测得;粗蛋白使用凯式定氮仪(2300,Kjeltec Analyzer Unit,Höganäs,Sweden)测定。
血清的相关生化指标谷氨酸氨基转移酶活性(ALT,紫外-乳酸脱氢酶法,货号: 105-000442-00)、天门冬氨酸基转移酶活性(AST,紫外-苹果酸脱氢酶法,货号: 105-000443-00)、碱性磷酸酶活性(ALP,AMP缓冲液法,货号: 105-000444-00)、总蛋白含量(TP,双缩脲法,货号: 105-000451-00)、总胆固醇含量(TC,氧化酶法,货号: 105-000448-00)、甘油三酯含量(TG,氧化酶法,货号: 105-000449-00)、血糖含量(Glu-O,氧化酶法,货号: 105-000949-00)、尿素氮含量(UN,脲酶法,货号: C013-2-1),采用深圳迈瑞BS-460全自动生化分析仪测定,参照南京建成生物工程研究所试剂盒说明书测定。
消化酶、抗氧化和免疫指标采用考马斯亮蓝试剂盒(货号: P0006,碧云天)测定组织匀浆液蛋白含量,根据试剂盒推荐方法测定。肝胰腺和肠道的消化酶活性、抗氧化和免疫的相关指标采用南京建成生物工程研究所的试剂盒测定,测定方法参照试剂盒说明书: 胰蛋白酶活性(Trypsin,货号:A080-2-2)、α-淀粉酶活性(AMS,货号: C016-1-1)、丙二醛含量(MDA,TBA法,货号: A003-1-2)、超氧歧化物酶活性(SOD,WST-1法,货号: A001-3-2)活性、谷胱甘肽过氧化物酶活性(GSH-PX,比色法,货号: A005-1-2)、过氧化氢酶活性(CAT,钼酸铵法,货号: A007-1-1)、总抗氧化能力(T-AOC,ABTS法,货号: A015-2-1)、酚氧化酶(POX,干粉法,货号: H247)、诱导型一氧化氮合成酶(iNOS,干粉法,货号: H372-1)、一氧化氮含量(NO,微板法,货号: A013-2-1)。
组织切片肝胰腺、鳃和肠道组织样品经梯度酒精脱水,二甲苯透明后,再由石蜡进行包埋,用切片机切片,厚度设置为5 μm。采用HE染色方法,经过染色、水洗、分化、漂洗、复染、脱水、透明和封片等步骤制作切片,采用Nikon Eclipse E100-DS-U3显微镜成像系统观察采集图像。
1.6 数据分析
数据以平均值±标准误(mean±SE)表示,实验结果用SPSS 21.0软件进行单因素方差分析(One-way ANOVA),显著水平为(P<0.05),之后使用Duncan’s法进行多重比较。以二次多项式拟合WGR与白术提取物添加水平的关系。
2 结果
2.1 白术提取物对日本沼虾生长性能的影响
如图1所示,日本沼虾的WGR和SGR随着白术提取物添加水平的增加呈现先上升后下降的趋势,A200组和A400组的WGR和SGR均显著高于对照组(P<0.05),FC随着白术提取物添加水平的增加有下降的趋势,其中A200、A400和A600组的FC均显著低于对照组(P<0.05),各组间的PRE、FR和SR无显著性差异(P>0.05)。
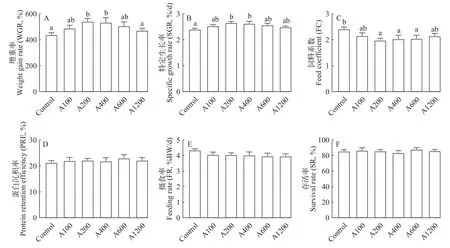
图1 白术提取物对日本沼虾生长性能的影响Fig.1 Effects of EAMK on growth performance ofMacrobrachium nipponense
如图2所示,日本沼虾摄食不同添加水平的白术提取物饲料后,A100和A200组的HSI均有所提高,但无显著性差异(P>0.05),各组间的CF和MP在各组之间均无显著性差异(P>0.05)。
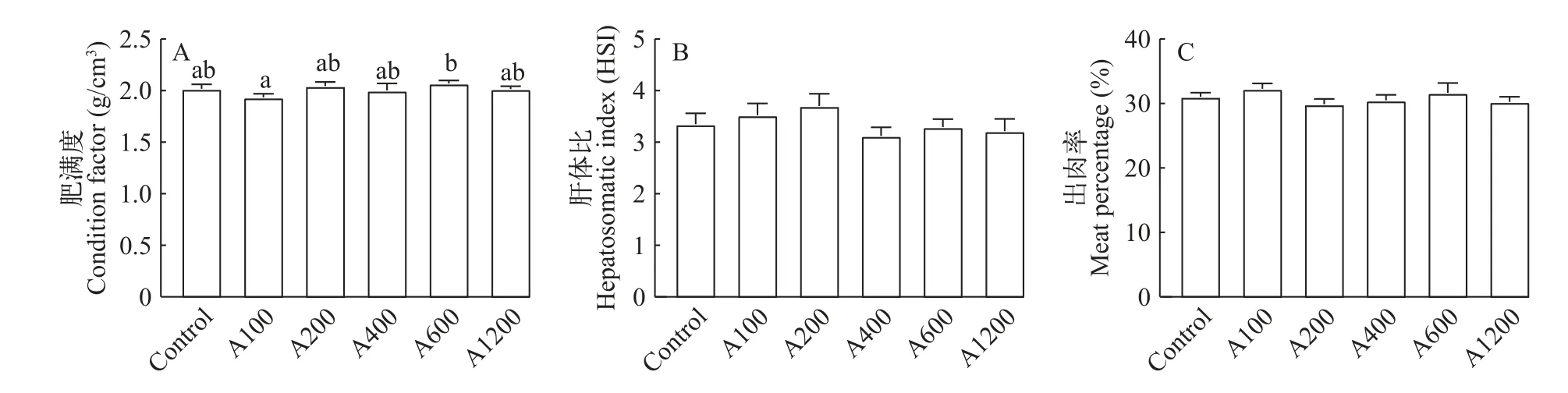
图2 白术提取物对日本沼虾形体指标的影响Fig.2 Effects of EAMK on body indexes ofMacrobrachium nipponense
如图3所示,白术提取物添加水平在0—600 mg/kg时,WGR随着饲料中白术提取物的添加量复合二次曲线关系,回归方程为y=-810.15x2+588.62x+440.39(R2=0.9381)。根据白术提取物与增重率的二次曲线,白术提取物的最适添加水平为363 mg/kg。
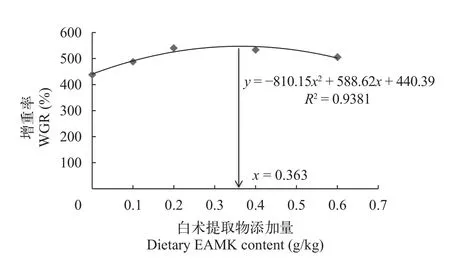
图3 日本沼虾增重率与白术提取物添加水平的关系Fig.3 Relationship between weight gain rate and EAMK addition level ofMacrobrachium nipponense
如图4所示,日本沼虾摄食不同水平白术提取物饲料后,与对照组相比,各组间的虾体水分、脂肪和蛋白无显著性差异(P>0.05),但可以显著降低虾体的灰分含量(P<0.05)。
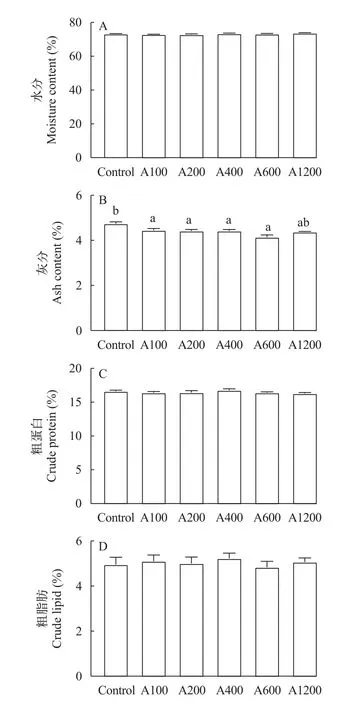
图4 白术提取物对日本沼虾营养成分的影响Fig.4 Effects of EAMK on the nutritional content ofMacrobrachium nipponense
2.2 白术提取物对日本沼虾血清生化指标的影响
如表2所示,与对照组相比,白术提取物添加组均显著降低了血清TG的含量(P<0.05)。A1200组的血清TC含量显著低于对照组(P<0.05)。A100组血清中Glu含量显著高于其他各组(P<0.05),ALT含量显著低于对照组和A1200组(P<0.05)。饲料中添加白术提取物对血清中的AST、ALP、TP和BUN含量没有显著性影响(P>0.05)。
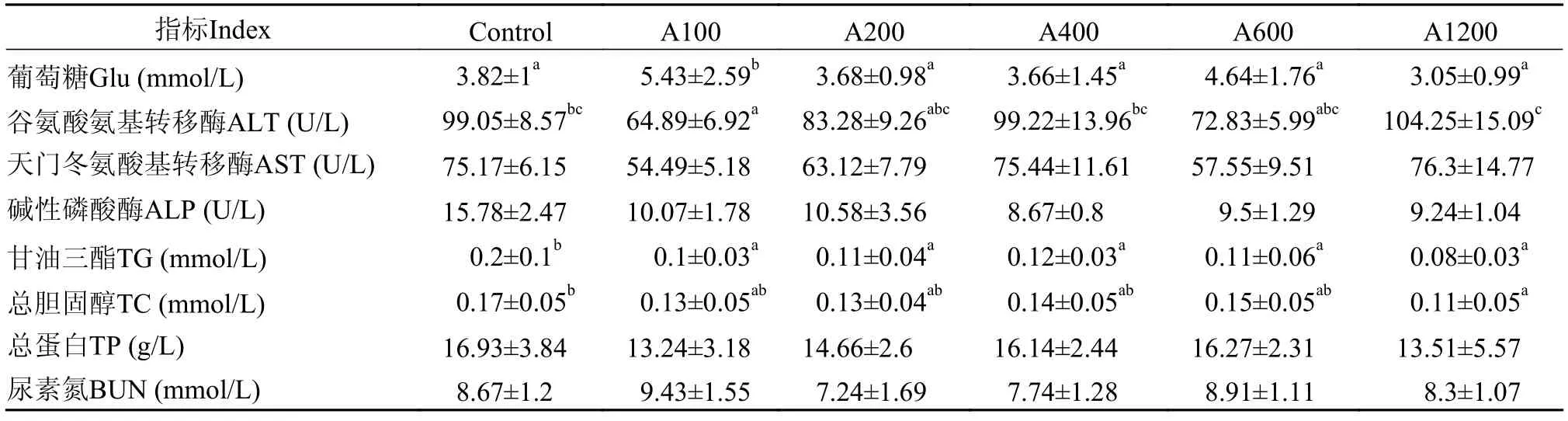
表2 白术提取物对日本沼虾血清生化指标的影响Tab.2 Effects of dietary EAMK levels on the hematologic characteristics ofMacrobrachium nipponense
2.3 白术提取物对日本沼虾肠道消化酶及免疫指标的影响
如图5所示,与对照组相比,α-淀粉酶和胰蛋白酶活性随着白术提取物添加水平的提高均呈现先升高后下降的趋势,但无显著性差异(P>0.05)。A200、A400和A1200组的iNOS活性显著高于对照组(P<0.05),NO含量和ACP活力随着白术提取物添加水平的提高有上升的趋势,但无显著性差异(P>0.05)。此外,A600组的AKP活性相比于对照组显著提高(P<0.05)。
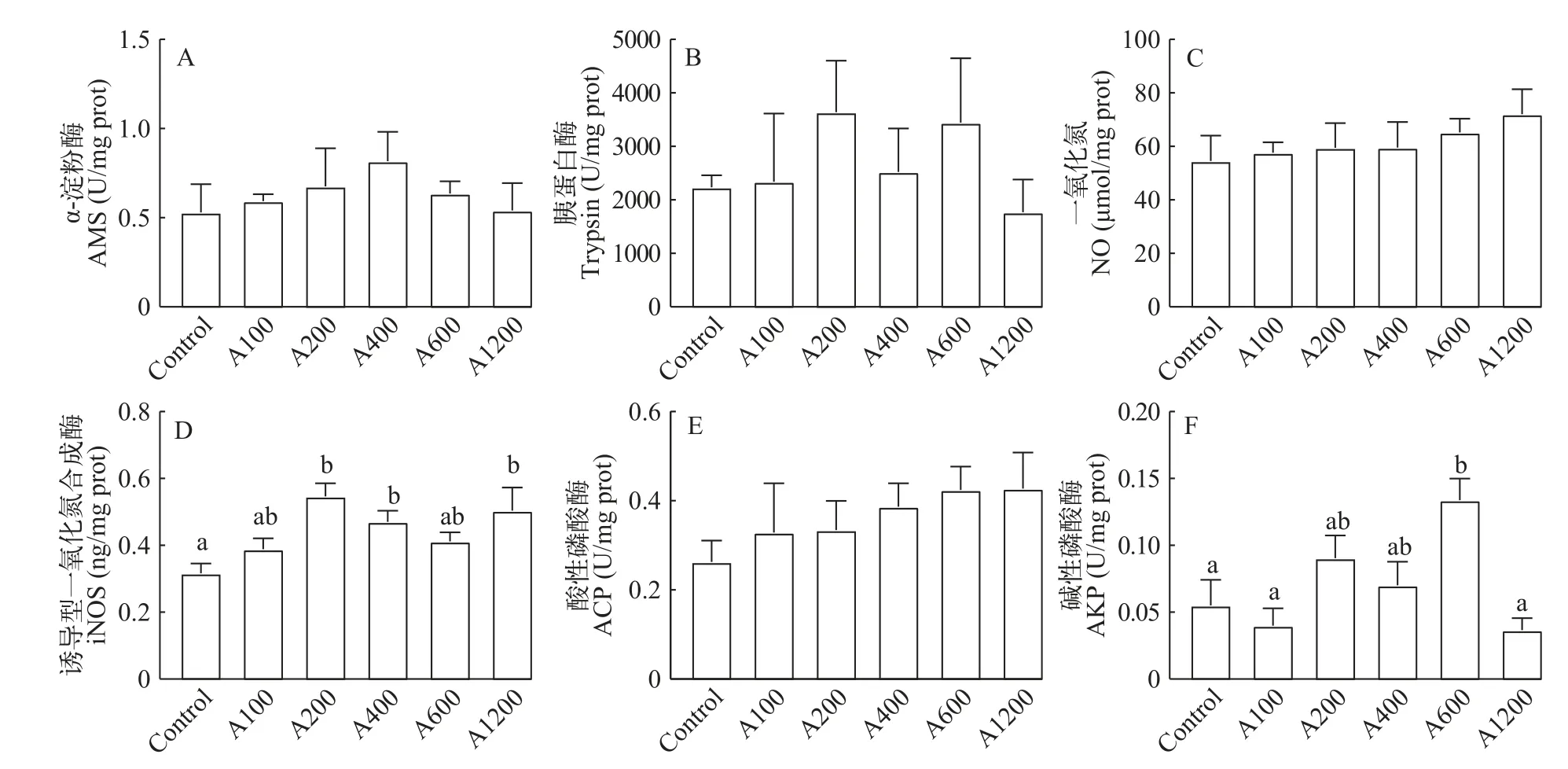
图5 白术提取物对日本沼虾肠道消化酶及免疫指标的影响Fig.5 Effects of EAMK on intestinal digestive enzymes and immunity ofMacrobrachium nipponense
2.4 白术提取物对日本沼虾肝胰腺抗氧化能力的影响
如图6所示,与对照组相比,A400组可以显著提高GSH-Px活性(P<0.05),A600组可以显著提高CAT活性(P<0.05);此外,白术提取物添加也可以提高SOD、T-AOC和PO活性,降低MDA含量,但无显著性差异(P>0.05)。
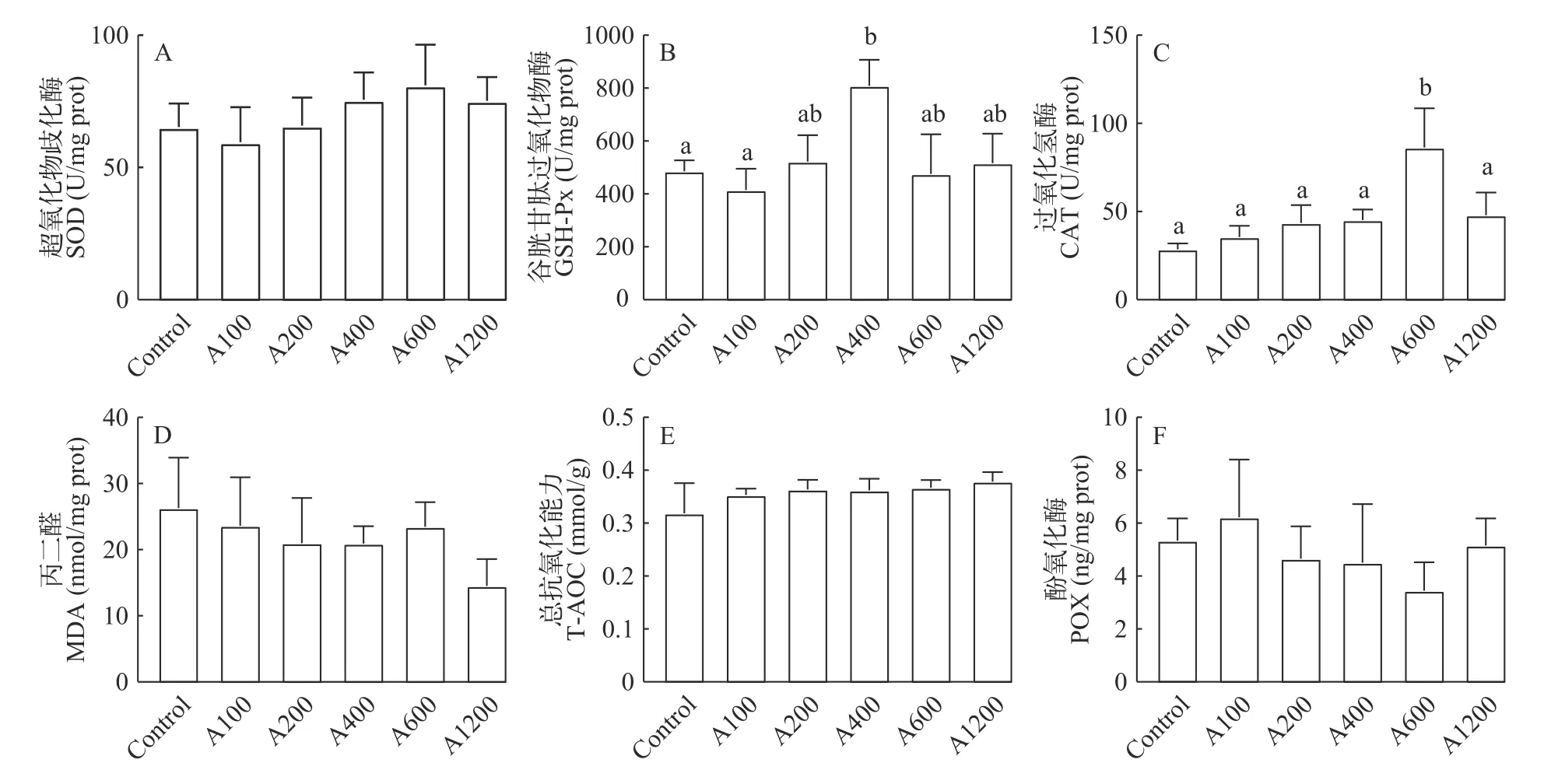
图6 白术提取物对日本沼虾肝胰腺抗氧化能力及免疫的影响Fig.6 Effects of EAMK on antioxidant capacity and immunity ofMacrobrachium nipponensehepatopancreas
2.5 白术提取物对日本沼虾肠、肝胰腺、鳃组织结构的影响
肠道HE染色如图7所示,与对照组相比,A200组和A400组肠道细胞完整,微绒毛排列更加整齐,肠道上皮和细胞间紧密连接,且A400组的肠道绒毛高度显著高于对照组(图8;P<0.05)。
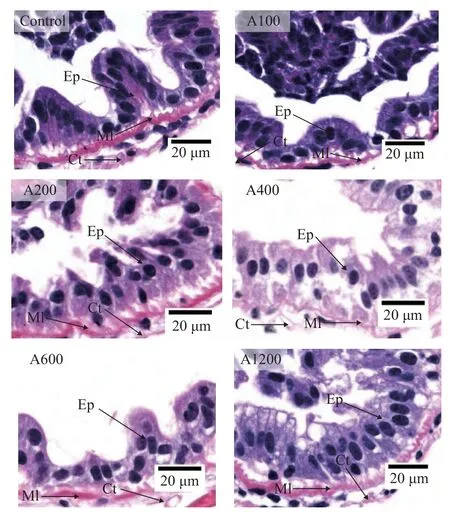
图7 白术提取物对日本沼虾肠道组织的影响Fig.7 Effect of EAMK on intestinal tissue ofMacrobrachium nipponense
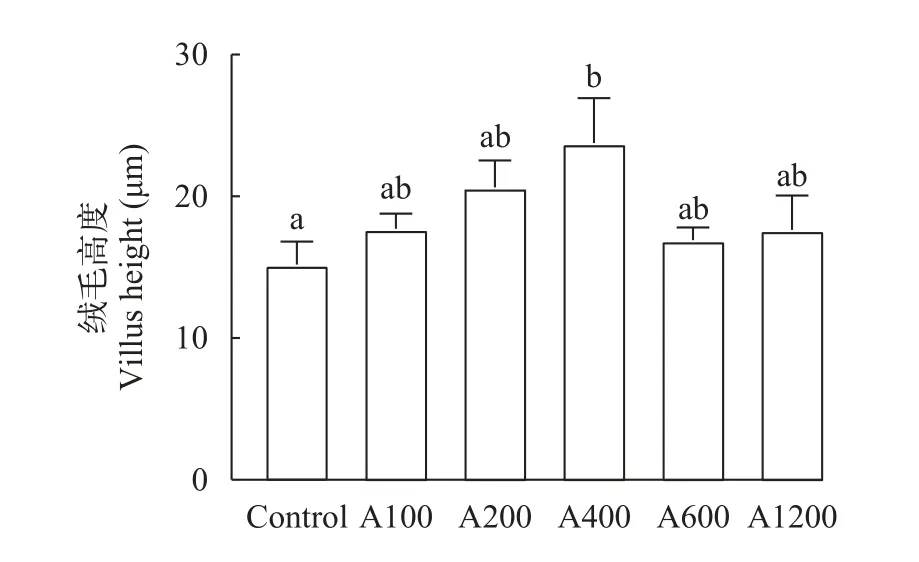
图8 白术提取物对日本沼虾肠道绒毛高度的影响Fig.8 Effect of EAMK on intestinal villi height ofMacrobrachium nipponense
肝胰腺HE染色如图9所示,与对照组相比,A200组和A400组星型腔结构变大,肝小叶空泡减少,R细胞增多,B细胞数量减少。在A600—1200组B细胞数量增多,R细胞减少。所有处理组肝胰腺的管腔内未见炎性渗出物,上皮细胞未见明显脱落。
鳃组织HE染色如图10所示,A100—1200组鳃叶形态与对照组一致,结构正常,鳃叶壁几丁质层和呼吸上皮联系紧密,所有白术提取物处理组均未观察到明显的显微病变。

图10 白术提取物对日本沼虾鳃组织切片的影响Fig.10 Effect of EAMK on gill tissue sections ofMacrobrachium nipponense
2.6 白术提取物对日本沼虾感染嗜水气单胞菌后存活率的影响
如图11所示,日本沼虾感染嗜水气单胞菌后,A100组可以显著提高攻毒后96h的存活率(P<0.05),对照组存活率为4%,A100组存活率为23%。
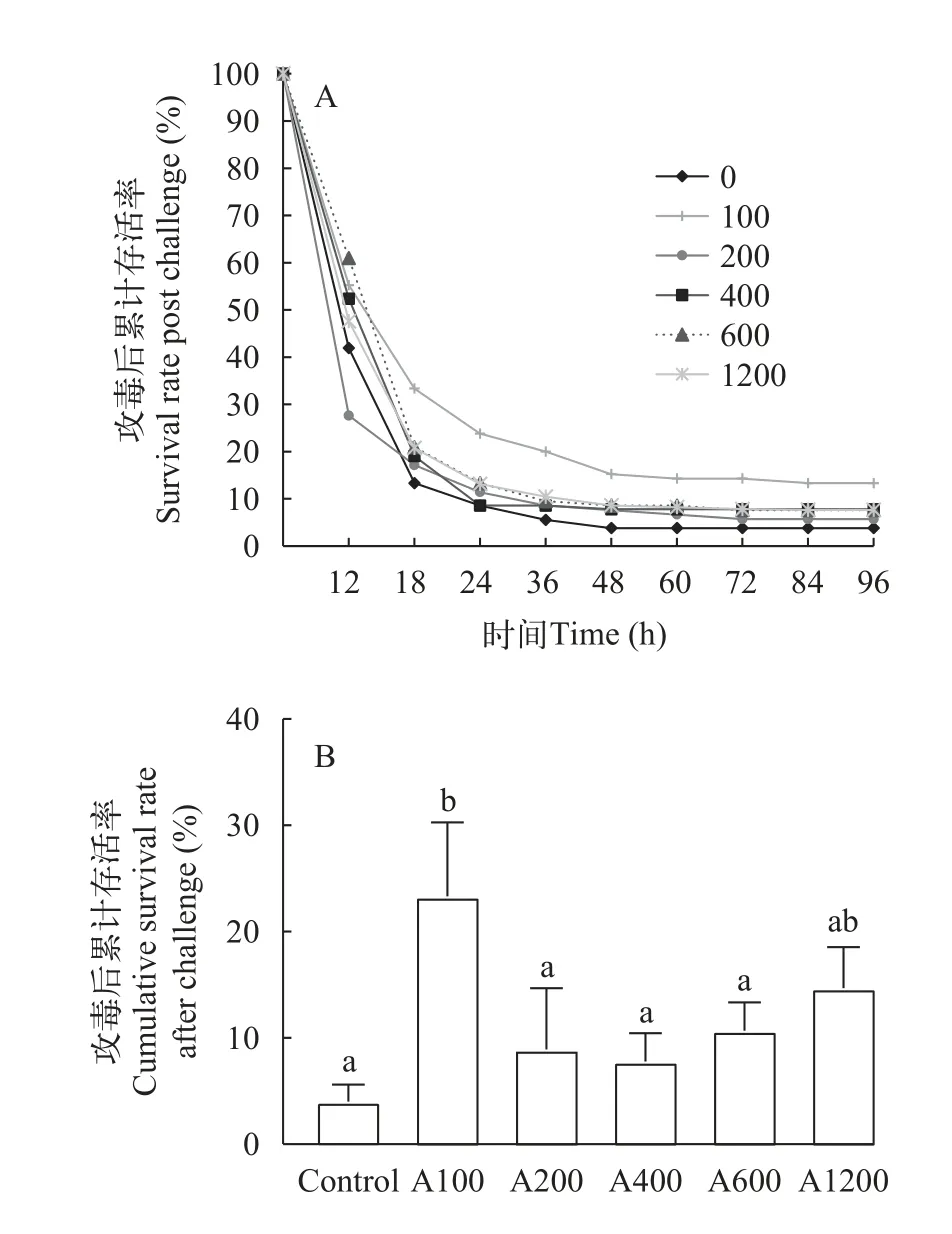
图11 白术提取物对日本沼虾嗜水气单胞菌攻毒后存活率的影响Fig.11 Effect of EAMK on survival rate after challenge ofAeromonas hydrophilainMacrobrachium nipponense
3 讨论
3.1 白术提取物对日本沼虾生长性能、饲料利用和血液生理的影响
增重率、特定生长率和饲料系数是评价动物生长性能和饲料利用的重要指标。柴艳等[10]研究表明,饲料中添加0.05%—0.15%白术多糖时,断奶仔猪的平均日增重显著提高,同时料重比下降。许丹宁等[18]的研究显示,饲料中添加白术多糖后,仔猪的日增重和饲料转化率显著提高。还有研究表明日粮中添加白术多糖可以显著降低仔猪的腹泻率[6],在鸭[19]和鸡[5]中也观察到类似结果。这些研究结果都表明,白术提取物可以改善畜禽对营养物质的消化吸收,调节机体代谢。水产动物的研究也发现,在黄颡鱼豆粕替代鱼粉的饲料中添加250 mg/kg的白术多糖可以提高鱼末重、特定生长率并降低饲料系数[7]。本研究发现日本沼虾饲料中添加200 mg/kg的白术提取物可显著提高其增重率和特定生长率,并且可以降低其饲料系数,说明日本沼虾饲料中添加白术提取物可以提高其生长性能。
血常规是基本的血液检验,能够快速反映机体的炎症状态和代谢异常,以此了解动物机体的新陈代谢和健康状况。本研究发现,饲料中添加白术提取物后,日本沼虾血清中的ALT的活性、TG和TC的含量均显著降低。血浆中的ALT和AST被认为是肝脏细胞损伤的指标,在肝脏细胞受到破坏时由肝细胞进入血液,导致血液内的ALT和AST活性升高[20,21]。血清中TC和TG与脂代谢密切相关,当肝脏脂肪过多或者脂肪代谢能力障碍时,TC和TG含量也会随之升高[22]。多种植物的多糖具有改善肝脏健康的作用,有研究表明,给大鼠灌胃200 mg/kg的蒙古黄芪多糖可以显著降低血清TC、TG和ALT的水平[23]。添加0.25%—0.50%的菊粉(富含果聚糖)可显著降低罗氏沼虾(Macrobrachium rosenbergii)血清中ALT的活性[24]。还有研究表明,在高能低蛋白的蛋鸡日粮中添加200或400 mg/kg白术多糖可以降低血浆中TC、TG和ALT的水平[25],与本实验结果一致。这说明在日本沼虾饲料中添加白术提取物能降低血脂,促进肝脏的健康。
3.2 白术提取物对日本沼虾抗氧化和免疫指标的影响
鱼体在正常代谢的过程中,活性氧的产生和清除处于平衡的状态,CAT、SOD和GSH-Px等抗氧化酶清除过量的活性氧,避免氧化应激的发生[26]。MDA是脂质过氧化降解的主要产物,可以反映机体受损情况[27],T-AOC是机体抗氧化和清除自由基能力的总和,可以衡量抗氧化系统功能的综合状况[28]。国内针对中草药提取物对养殖动物的抗氧化功能方面展开了一系列研究。含红景天提取物的饲料能够显著提高凡纳滨对虾肝胰腺GSH-Px和CAT的活性[29]。黄芪和黄连的活性提取物也能够显著提高凡纳滨对虾肝胰腺SOD的活性[30]。绿原酸能显著提高凡纳滨对虾肝胰腺中CAT活性[31]。陈强等[32]在日粮中添加0.8%和1.5%的复方白术,显著提高了断奶仔猪血清中GSH-Px和SOD的活性,降低MDA含量。在D-半乳糖致衰老小鼠模型中灌胃100和200 mg/kg白术多糖,小鼠血清中MDA含量下降,GSH-Px、CAT和T-AOC活性显著升高[33]。本研究也发现白术提取物具有调节虾氧化平衡的作用,白术提取物添加组日本沼虾肝胰腺的SOD和T-AOC有上升趋势降,MDA含量有下降趋势;添加400和600 mg/kg白术提取物分别能显著提高肝胰腺GSHPx和CAT的活性,说明白术提取物显著提高了日本沼虾的肝胰腺的抗氧化水平。
日本沼虾与其他甲壳动物一样,缺乏适应性免疫系统[34],因此先天性免疫在甲壳动物抵御病原方面显得尤为重要。NO在调节血管扩张、传递神经信号等过程中发挥重要的作用,同时NO也是重要的免疫调节剂。许多中草药可以调节NO的生成,本研究发现白术提取物可以提高日本沼虾肠道iNOS的活性。iNOS可以促进组织内NO的产生,NO通过与超氧化物阴离子反应生成不活跃的亚硝酸盐,因此NO作为化学屏障对抗超氧化物的细胞毒作用,被认为是一种超氧自由基清除剂[35]。NO还通过结合并激活可溶性鸟苷酸环化酶,催化三磷酸鸟苷生成第二信使环鸟苷酸,进一步激活下游蛋白激酶等效应蛋白来发挥生理功能[36]。NO参与机体氧化还原的调节具有两相性,低浓度的NO可以保护组织细胞免受损伤,高浓度的NO会氧化蛋白质、脂肪酸和DNA,从而破坏细胞膜甚至导致细胞死亡[37]。在虹鳟(Oncorhynchus mykiss)的研究中发现投喂低浓度复方中草药(茵陈和板蓝根)可以显著提高的肾脏组织iNOS活性和NO含量[38]。本研究肠道中NO含量随饲料中白术提取物添加呈现上升的趋势,说明白术提取物并不会导致过高NO引起的组织损伤。
ACP和AKP是活化的巨噬细胞产生的一种溶酶体酶,能够杀死病原微生物,是先天性免疫中防御病原体的重要酶类[39]。有研究表明,饲料中添加0.4%的熟地黄多糖显著提高了大鳞鲃(Luciobarbus capito)血清中ACP和AKP的活性[40]。还有研究表明,在中华绒螯蟹(Eriocheir sinensis)饲料中添加0—1200 mg/kg的黄芪多糖,肝胰腺AKP和ACP的活性随着添加量的增加而显著升高[41]。本研究日本沼虾饲料中添加600 mg/kg白术提取物显提高了肠道AKP活性,肠道的ACP活性随着白术提取物添加量增加有上升趋势,说明本实验中添加白术提取物对日本沼虾的免疫能力有一定的改善作用。有必要针对中草药中的活性成分开展研究,确定其中功能性成分的有效和安全添加剂量。
3.3 白术提取物对日本沼虾肠道、肝胰腺和鳃组织形态的影响
消化道的形态结构可以反映水产动物的健康状况[42]。以往的研究表明绒毛高度和隐窝深度比值与营养物质的吸收效率增加和消化道的健康[43]有关。白术多糖可显著提高断奶仔猪肠道绒毛高度,使肠道微生态趋于平衡,进而改善断奶仔猪小肠屏障功能[44]。在关于尼罗罗非鱼(Oreochromis niloticus)[45]和墨吉对虾(Penaeus merguiensis)[46]的研究中,海藻多糖可以促进绒毛表面积、绒毛长度和宽度。大口黑鲈饲料中添400 mg/kg的白术多糖显著增加其肠道杯状细胞数量和绒毛高度[8]。在本研究中,添加400 mg/kg白术提取物可以显著增加日本沼虾的肠道绒毛高度,改善肠道形态。
肝胰腺负责营养物质的积累和运输,也是重要的解毒器官[47]。肝胰腺占据甲壳动物头胸部的很大一部分,并参与消化酶的合成和分泌、营养吸收同化和废物排泄[48,49]。虾类的肝胰腺主要由不同类型的细胞(E、R、F和B细胞)和肝小管组成。研究发现,在甲壳动物中B细胞具有分泌功能,而R细胞的功能是吸收营养和解毒作用[50],糖和脂质通常储存在R细胞中[51]。研究表明饲料中添加250和500 mg/kg的白术多糖时,黄颡鱼的肝组织结构正常,肝小叶和肝窦结构清晰完整[7]。凡纳滨对虾肝胰脏中R细胞和B细胞数量及星型腔大小受到饲料添加黄芪党参甘草混合提取物(2.0 g/kg)的影响[52]。本实验中100—400 mg/kg组日本沼虾的肝胰腺中R细胞数量增多,星型腔增大,说明添加适量的白术提取物对日本沼虾可以提高肝胰腺的吸收营养物质能力,从而提高生长。在1200 mg/kg处理组中,B细胞数量和R细胞数量与对照组相似,所有处理组均未出现炎性浸出物,说明在本实验的水平范围内,白术提取物未对日本沼虾的肝胰腺造成损伤。水生生物的鳃容易受到有毒物质和水生环境的变化的影响,从而降低耗氧量并损害渗透压的调节[53]。本研究中所有白术提取物处理组均未观察到显微病变,100—1200 mg/kg处理组鳃叶形态结构正常。
3.4 白术提取物对日本沼虾抗病力的影响
酚氧化酶(PO)是无脊椎动物先天性免疫系统中一种含铜的金属酶[54],活化的PO可以催化酚类氧化为醌类物质,醌类物质使病毒病原体失活,发挥免疫功能。许多研究发现,PO的活性与对虾的抗病性呈正相关[55]。例如,红凤菜(Gynura bicolor)提取物提高了PO活性,显著降低了溶藻弧菌攻毒后凡纳滨对虾的死亡率[56]。也有研究表明,饲喂羊栖菜(Sargassum fusiforme)多糖的中国对虾(Fenneropenaeus chinensis)PO活性显著升高,感染哈维氏弧菌后对虾的累积死亡率降低[57]。饲喂复方中草药黄芪多糖和大蒜素能够使凡纳滨对虾PO活性显著提高,感染哈维氏弧菌后对虾的累积死亡率显著降低[58]。饲喂0.0325%白术多糖的益生元具有提高凡纳滨对虾血清中PO活性能力,还能提高哈维氏弧菌攻毒后存活率[9]。在罗氏沼虾饲料中添加15 g/kg的白千层(CajeputMelaleuca cajuputi)提取物可以显著提高其嗜水气单胞菌攻毒后的存活率[59]。本实验发现,白术提取物虽然对肝胰腺PO活性没有显著性影响,但在添加量为100 mg/kg时日本沼虾的PO活性最高,且显著降低了嗜水气单胞菌攻毒后日本沼虾的死亡率。嗜水气单胞菌为革兰氏阴性细菌,可引起许多淡水鱼类细菌性出血病,其传播速度快、发病范围广,是淡水鱼类暴发性传染病最主要的病原菌之一[60]。这说明白术提取物参与调节日本沼虾的先天免疫反应,从而提高其嗜水气单胞菌攻毒后的存活率,然而白术提取物调节日本沼虾先天免疫的具体机制仍有待于进一步探究。
综上所述,在本实验条件下,白术提取物可以提高日本沼虾的生长性能和抗氧化能力,并提高抗病力,在日本沼虾饲料中适宜添加量为100—400 mg/kg。

