氨氮胁迫对大口黑鲈幼鱼组织结构、酶活及肠道微生物的影响
魏孟申郑 涛, 路思琪强 俊, 陶易凡李 岩徐 跑,
(1.南京农业大学无锡渔业学院,无锡 214128;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,无锡 214081)
氨氮是水产动物养殖水环境中的重要污染物之一,以离子氨和非离子氨的形式存在,非离子氨为主要毒性形式,能引起养殖动物摄食降低、生长缓慢、免疫力差等现象[1]。养殖用水多来自养殖地周边河道,生活污水和工业废水的排放会导致河水氨氮浓度严重超标。有研究显示,受污染的河水氨氮浓度可达25 mg/L,严重的会超过40 mg/L[2,3]。
长期暴露在高氨氮环境会引起水生动物机体抗氧化系统失衡,引发免疫和代谢功能紊乱,最终造成肝、肠组织损伤[4]。氨氮胁迫能使鱼体产生过量的活性氧自由基(ROS),导致机体产生氧化应激[5]。Yu等[6]对拉氏鱥(Rhynchocypris lagowskii)的研究显示,氨暴露会显著提高鱼体MDA含量,增加SOD和CAT的活性,引起氧化应激。此外,相关研究表明,氨氮还能够导致鱼体GPT、GOT、LZM和补体C3等免疫相关指标变化[7,8],影响非特异性免疫能力。环境中高浓度氨氮能够导致草鱼(Ctenopharyngodon idell)、淇河鲫(Carassius auratus)和黄颡鱼(Pelteobagrus fulvidraco)等鱼类脏器细胞出现核溶解和空泡化等现象,造成组织损伤[9—11]。
肠道是机体消化吸收的主要场所,肠道菌群对宿主的免疫应答和内环境的稳定具有重要意义[12]。水体环境的改变会使动物产生应激反应,影响体内肠道微生物的结构[13]。在杂交黄颡鱼(P.fulvidraco♀×P.vachellii♂)的研究中[14],运输过程中氨氮浓度上升会破坏肠道微生物的稳态,引发氧化应激、代谢和免疫失调。16S rDNA高通量测序技术能快速地对不同属种的细菌进行分类鉴定[15],广泛应用于环境因子对肠道菌群结构影响的研究中[16]。在大鳞副泥鳅(Paramisgurnus dabryanus)和瓦氏黄颡(P.vachelli)的研究中,温度和低氧应激会破坏肠道菌群的稳定,影响机体健康[17,18]。氨氮对鱼类肠道的影响不容忽视,然而,目前氨氮对大口黑鲈肠道微生物的影响尚不可知。
大口黑鲈Micropterus salmoides,是从北美洲引进的一种优良淡水养殖品种,具有养殖周期短、市场需求大和售卖价格高等优点。大口黑鲈的养殖多采用高密度集约化养殖模式,该模式存在残饵溶解、鱼集中排泄等问题,极易导致水体中氨氮浓度的急剧升高,从而对鱼体产生胁迫,影响鱼体的生长发育[19]。氨氮胁迫干扰大口黑鲈氨的排泄,减少分解代谢[20];同时氨暴露会损害其鳃和肝等组织结构,增加血清转氨酶活性与抗氧化酶活力,抑制鱼体免疫和抗氧化能力[21,22]。然而,目前对大口黑鲈肠道结构及肠道微生物的影响鲜有报道。本实验通过对大口黑鲈进行氨氮胁迫,研究氨氮对其肝和肠组织结构的影响,分析胁迫对鱼体抗氧化和免疫能力及肠道菌群的影响,为全面评估和解析氨氮对鱼类的危害提供依据和参考。
1 材料与方法
1.1 实验材料
大口黑鲈幼鱼由苏州金澄福生物科技有限公司(中国苏州)提供。挑选同一批次、生长健康状况良好的鲈幼鱼[(15.32±0.65 g)]180尾进行实验。实验开始前,于100 L养殖缸内暂养7d。在暂养期间,水温25—26℃,溶氧>7 mg/L,pH为7.5±0.2。用NH4Cl(分析纯)配制成10 g/L的母液,实验时根据养殖缸中水的体积加入母液,达到所需实验浓度。
1.2 氨氮暴露实验设计
实验在体积100 L养殖缸内进行,依据养殖水源可能达到的氨氮浓度[2,3]和大口黑鲈48h半致死氨氮浓度(LC50)[23],设置0、25和50 mg/L三个浓度组(非离子氨浓度0、0.55和1.11 mg/L),实测值分别为(0.37±0.08)、(25.19±0.51)和(50.47±0.46) mg/L[非离子氨浓度(0.008±0.002)、(0.59±0.011)和(1.12±0.01) mg/L],每组设3个平行,每个平行放养实验大口黑鲈20尾。在实验过程中,每隔4h用纳氏试剂分光光度法[24]对实验水体进行氨氮浓度测定,根据具体结果用母液及时调节。实验期间,水温保持25—26℃,pH为7.5±0.15,溶氧(7.57±0.46) mg/L。
氨氮胁迫48h取样,每个平行取4尾使用MS-222麻醉后解剖,迅速取出肝脏和前肠,液氮冷冻后置于-80℃冰箱保存,用于酶活测量。同时,每个浓度组另取肝脏、前肠样品3份,用4%多聚甲醛固定,用于组织切片观察。0和50 mg/L浓度组各取6尾,取出前肠放入冻存管(记为NAN和AN50),液氮冷冻后放入-80℃冰箱保存,用于肠道微生物测定。
1.3 HE染色切片
4%多聚甲醛浸泡固定的组织,进行石蜡包埋处理并切片,通过二甲苯脱蜡,再使用苏木素-伊红染色,待切片风干后封片,使用光学显微镜(OLYMPUS CX22LED)进行观察[25]。使用Image J软件计算空泡细胞面积占据切片面积的比例,得出空泡率;使用Image-Pro Plus 6.0软件测量肠道绒毛高度、绒毛宽度和肌层厚度。
1.4 Elisa检测
待测样品吸干表面水分,称取0.1 g左右,按照1∶9比例加入已预冷磷酸缓冲盐溶液(Phosphate buffer saline,PBS),制成组织匀浆,在4℃,9000 r/min条件下离心15min。取上清,用于生化指标检测。根据上海朗顿生物科技有限公司ELISA试剂盒的说明,检测肝组织中谷丙转氨酶(Glutamic pyruvic transaminase,GPT)、谷草转氨酶(Glutamic oxalacetic transaminase,GOT)、溶菌酶(Lysozyme,LZM)和补体C3(Complement3,C3),肠组织中超氧化物歧化酶(Superoxide dismutase,SOD),过氧化氢酶(Catalase,CAT)和丙二醛(Malondialdehyde,MDA)的活性,使用全波段酶标仪(Bio-Tek EonTM)对所有指标进行检测。
1.5 肠道微生物总 DNA 提取和测序
使用E.Z.N.A.粪便DNA试剂盒(D4015)提取肠道样本总DNA。用1%琼脂糖凝胶电泳检测DNA提取质量。PCR扩增使用V3—V4区域通用引物341F:5′-CCTACGGGNGGCWGCAG-3′及805R: 5′-GAC TACHVGGGTATCTAATCC-3′。PCR产物经2%琼脂糖凝胶电泳进行检测。PCR扩增程序: 98℃预变性30s,32次循环(在98℃下变性10s,在54℃下退火30s,在72℃下延伸45s);最后在72℃下延长10min。使用Ampure XT beads对PCR产物进行纯化,并通过Qubit定量。使用Illumina (Kapa Biosciences,Woburn,MA,USA)文库定量试剂盒和Agilent 2100生物分析仪(Agilent,USA)评估扩增子文库的大小及数量。
在Illumina NovaSeq平台上对样本进行测序,通过FLASH合并匹配端读取。在特定的过滤条件下,使用Fqtrim(v0.94)对原始读数据进行质量过滤,以获得高质量的clean标签。使用Vsearch软件(v2.3.4)过滤嵌合序列。特征表和特征序列由DADA2进行解调获得。Alpha多样性和Beta多样性由QIIME2计算出来,利用Bugbase 数据库进行细菌表型预测。
1.6 数据处理及统计分析
非离子氨浓度[26]计算公式:
式中,C1为非离子氨浓度(mg/L),f为氨的水溶液中非离子氨的摩尔百分比(%),C2为氨氮浓度(mg/L),T为绝对温度(K),t为摄氏温度(℃)。
实验所得数据用SPSS26.0软件进行分析处理。使用Shapiro-Wilk和Levene检验分析酶活数据的正态性和方差同质性,使用单因素方差分析(oneway ANOVA)和 Duncan 检验法统计分析各组间数据差异显著性。用Wilcoxon秩和检验确定了样品间Alpha多样性和相对丰度差异的显著性,通过QIIME2分析Beta多样性并用R(v3.5.2) 包绘制图片。显著差异肠道菌群的筛选使用LefSe分析,设定P<0.05,LDA>3。结果均以平均值±标准差(SD)表示,当P<0.05时认为差异显著。
2 结果
2.1 氨氮胁迫48h后大口黑鲈组织的显微观察
通过显微观察发现,在氨氮胁迫48h后,0组肝组织中央静脉周围肝细胞排列整齐,肝细胞结构清晰完整,细胞间界限明显(图1A和1D)。25 mg/L组肝细胞排列出现紊乱,部分细胞出现空泡化(图1B和1E)。50 mg/L组肝细胞肿胀,排列紊乱,大量肝细胞空泡化(图1C和1F)。0、25和50 mg/L组肝细胞空泡率分别为(23.61±1.39)%、(47.72±0.55)%和(69.8±1.38)%,差异显著(P<0.05)。
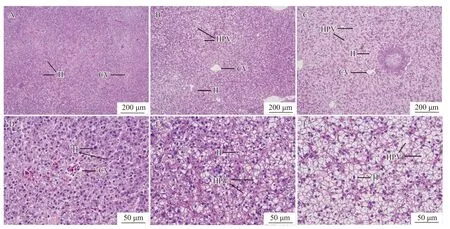
图1 氨氮胁迫48h对大口黑鲈肝组织显微结构的影响Fig.1 Effects on liver microstructure ofMacropterus salmoidesunder 48h ammonia-N stress
通过对肠组织显微结构的测量与分析(图2)可知,在氨氮胁迫48h后,25和50 mg/L组肠组织杯状细胞的数量增加,杯状细胞体积逐渐变大。对照组和各实验组的绒毛高度无显著性差异(P>0.05;表2)。0和25 mg/L组的绒毛宽度无显著性差异(P>0.05),50 mg/L组的绒毛宽度显著高于0和25 mg/L组(P<0.05);50 mg/L组的肌层厚度显著高于0组(P<0.05),与25 mg/L组差异不显著(P>0.05;表1)。
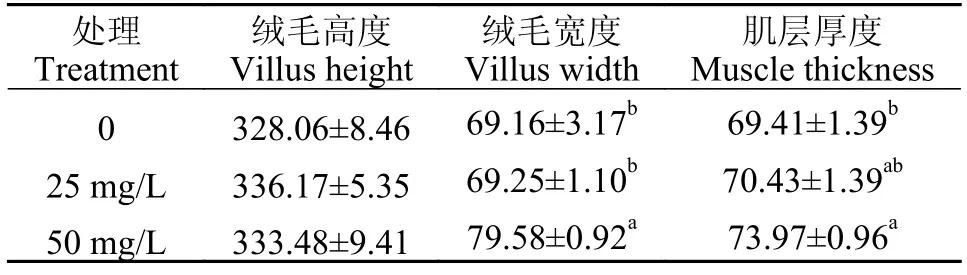
表1 氨氮胁迫48h对大口黑鲈肠道组织的影响Tab.1 Effects on intestinal tissue ofMacropterus salmoidesunder 48h ammonia-N stress (μm)
2.2 氨氮胁迫48h后大口黑鲈组织抗氧化及免疫参数的变化
氨氮胁迫对大口黑鲈组织抗氧化酶及非特异性免疫酶活性产生显著影响(图3和图4)。胁迫48h后肠组织中SOD活性和CAT活性显著升高(P<0.05);50 mg/L组SOD活性显著低于25 mg/L组,CAT活性显著高于25 mg/L组(P<0.05),25和50 mg/L组MDA含量显著大于0组(P<0.05)。肝组织中25和50 mg/L组GPT及GOT活性较0组显著下降(P<0.05),25和50 mg/L组LZM活性显著高于对照组(P<0.05),25和50 mg/L组无明显差异;50 mg/L组补体C3活性显著高于0组(P<0.05),25 mg/L组高于0组但差异不显著(P>0.05)。
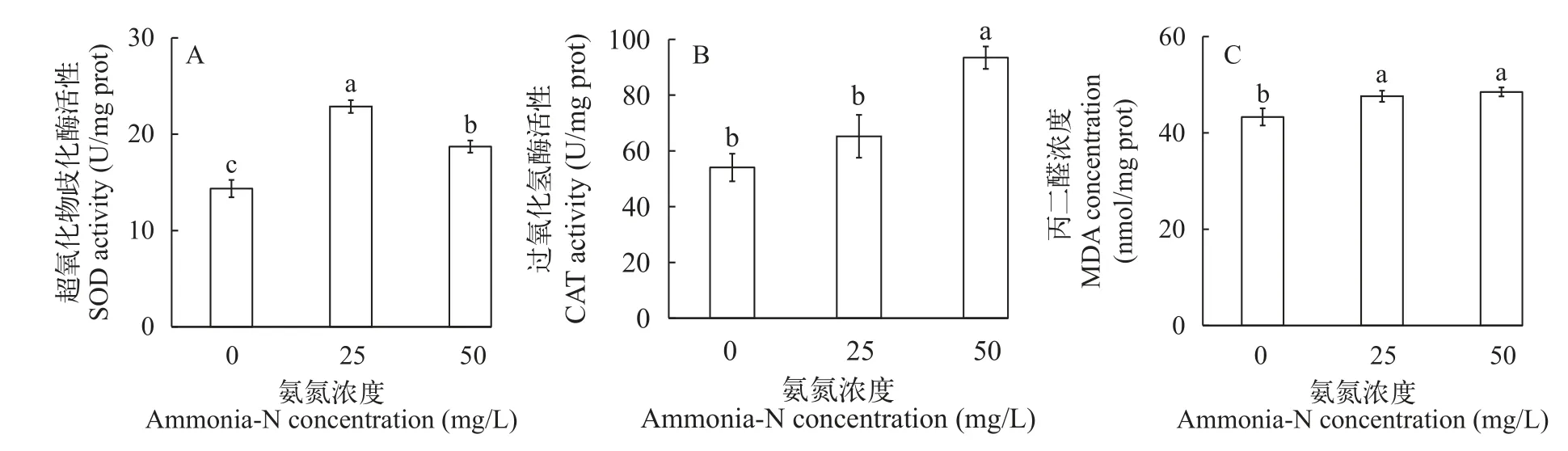
图3 氨氮胁迫48h对大口黑鲈组织抗氧化酶的影响Fig.3 Effects of antioxidant enzymes on tissue ofMacropterus salmoidesunder 48h ammonia-N stress

图4 氨氮胁迫48h对大口黑鲈非特异性免疫酶的影响Fig.4 Effects on non-specific immunoenzymes ofMacropterus salmoidesunder 48h ammonia-N stress
2.3 氨氮胁迫48h后大口黑鲈肠道菌群的变化
本实验收集了12个样本进行测序,总共获得了合格的16S rDNA序列546249条,通过双端拼接、质量控制和嵌合体过滤等方式修正错误,共得到1166个OUT。测序所得数据可以覆盖样本绝大多数物种,可以进行后续分析。
Alpha多样性主要用来反映物种丰富度和均匀度(图5)。通过测定观察到NAN组的chao1指数(图5A)、observed_outs指数(图5B)、shannon指数(图5C)和simpson指数(图5D),均显著低于AN50组(P<0.05),肠道菌群的丰富度降低。
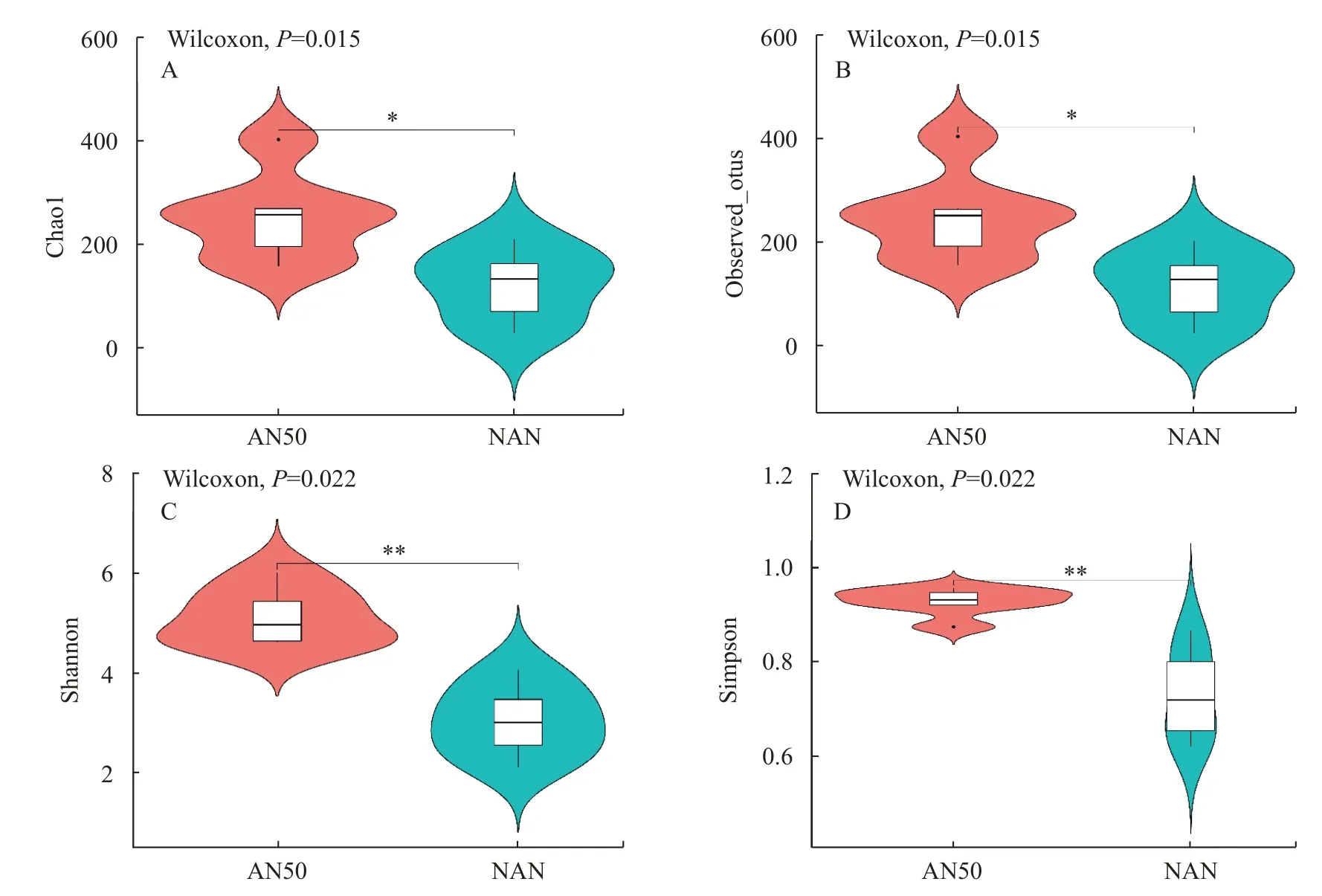
图5 氨氮胁迫48h肠道微生物Alpha多样性指数Fig.5 Alpha diversity under 48h ammonia-N stress
对12个样本的主坐标分析(Principal coordinates analysis,PCoA)如图6所示。不同颜色代表不同分组,不同样本间的距离代表其物种组成的差异情况。AN50组和NAN组样本间区分明显,具有显著差异(P<0.05),氨氮胁迫48h后大口黑鲈肠道微生物结构发生明显改变。
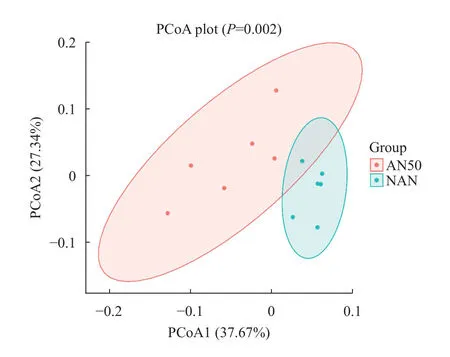
图6 氨氮胁迫48h肠道微生物PCoA分析Fig.6 Principal coordinates analysis of intestinal microbiome under 48h ammonia-N stress
韦恩图能反映不同组共有和特有的特征值数目,对AN50组和NAN组所测feature进行分析发现(图7),AN50组和NAN组共有的feature有196个,占总feature的16.8%,而AN50组和NAN组特有的feature数量相差较大,分别为709(60.8%)和261(22.4%)。同时,用曼哈顿图来展示差异feature分析(图8)。结果显示,差异feature主要集中在拟杆菌门(Bacteroidetes)、蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)和螺旋体门(Spirochaetes),变形菌门(Proteobacteria)同时存在上升和下降的feature。

图7 氨氮胁迫48h feature 韦恩图Fig.7 Venn diagram showing feature under 48h ammonia-N stress
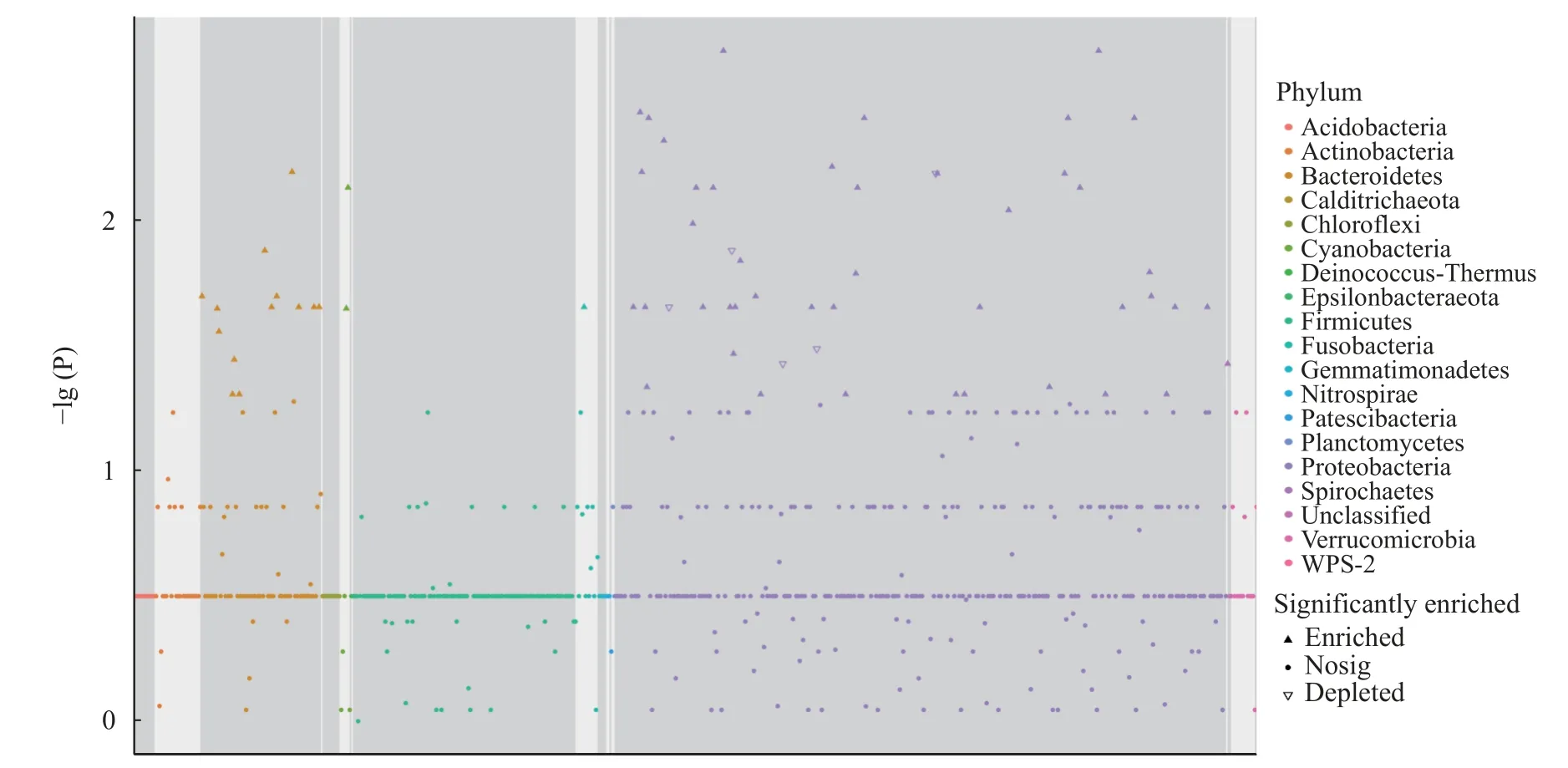
图8 氨氮胁迫48h feature曼哈顿图Fig.8 Manhattan plots showing enriched and depleted feature under 48h ammonia-N stress
对样本中平均相对丰度大于1%的feature进行相对丰度和差异分析(图9)。在门水平上(图9A),主要的优势菌群是变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、拟杆菌门(Bacteroidetes)、螺旋体门(Spirochaetes)和厚壁菌门(Firmicutes)。由图9B可知,在氨氮胁迫48h后,AN50组和NAN组在拟杆菌门和螺旋体门的相对丰度上存在显著差异(P<0.05),AN50组显著高于NAN组;梭杆菌门和厚壁菌门存在一定差异(P>0.05)。在属水平上(图9C),相对丰度大于1%的属有8个,分别为不动杆菌属(Acinetobacter)、金黄杆菌属(Chryseobacterium)、邻单胞菌属(Plesiomonas)、螺旋体属(Brevinema)、鲸杆菌属(Cetobacterium)、爱德华氏菌属(Edwardsiella)、气单胞菌属(Aeromonas)和假单胞菌属(Pseudomonas)。经差异分析(图9D)和LEfSe分析(图9E)可以发现,在8个优势菌属中4个存在显著差异(P<0.05)。AN50组不动杆菌属、金黄杆菌属和螺旋体属的丰度显著高于NAN组,邻单胞菌属的丰度显著低于NAN组(P<0.05)。
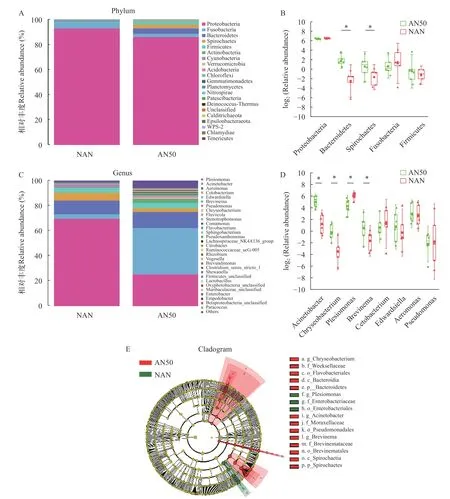
图9 氨氮胁迫48h肠道微生物的优势菌相对丰度和差异分析Fig.9 Relative abundance and difference analysis of intestinal microbiome under 48h ammonia-N stress
通过相关性热图来分析相对丰度前20的属与肠道生理指标的关系(图10)。结果发现,不动杆菌属与肠道MDA含量、CAT活性、绒毛宽度和肌层厚度呈正相关,金黄杆菌属与肠道肌层厚度、绒毛宽度及SOD活性呈正相关,黄杆菌属与肠道肌层厚度、绒毛宽度呈正相关。假黄单胞菌属、短波单胞菌属、寡养单胞菌属与肠道MDA含量呈正相关。邻单胞菌属与肠道MDA含量、CAT活性、绒毛宽度和肌层厚度呈负相关。
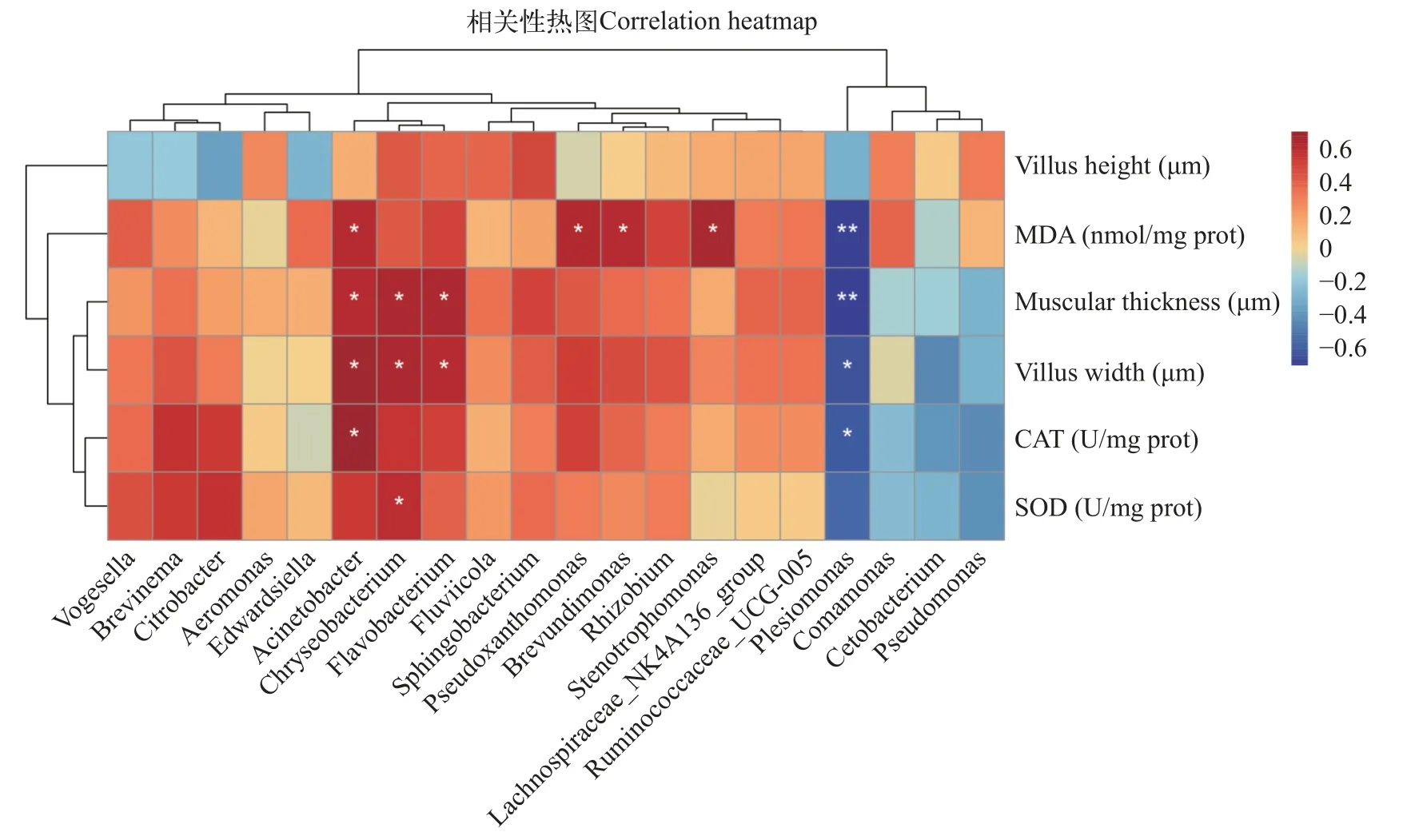
图10 肠道微生物属水平与肠道生理指标的相关性Fig.10 Relationships between intestinal microbiome at genus level and intestinal physiological indexes
为了进一步了解氨氮胁迫对大口黑鲈肠道微生物的菌群的影响,对肠道菌群表型进行分析,使用BugBase对细菌表型进行预测,深入探究氨氮胁迫对肠道微生物菌群的表型和功能的影响(图11)。AN50组和NAN组在革兰氏阴性菌、革兰氏阳性菌方面没有显著差异,革兰氏阴性菌在肠道菌群中占绝对优势。同时,AN50组具有更低的生物膜形成能力和耐应激性。
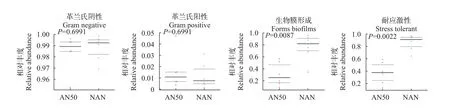
图11 BugBase预测得到的氨氮胁迫48h肠道菌群表型分析Fig.11 Phenotype analysis of intestinal microbiome under 48h ammonia-N stress predicted by BugBase
3 讨论
3.1 氨氮胁迫影响大口黑鲈肝脏、肠道组织的正常结构和功能
肝脏是新陈代谢和解毒的主要器官,水体氨氮浓度的升高,会造成肝组织的损伤[27]。在本实验中,氨氮对大口黑鲈肝脏最主要的组织结构影响表现为肝细胞排列紊乱和肝细胞空泡化,并且随着氨氮浓度增加,肝细胞空泡化更加严重。在团头鲂(Megalobrama amblycephala)和圆斑星鲽(Verasper variegatus)的氨氮胁迫实验中,同样出现肝细胞空泡化的现象[28,29]。细胞空泡化是细胞坏死的前兆[30]。同时,肝脏中存在多种酶,对鱼体的生长代谢有重要作用[31],而肝细胞空泡可能会对酶活性产生影响,从而导致肝脏的正常功能损伤。
鱼类的肠道具有屏障功能[32]。在本实验中,杯状细胞数量在胁迫后显著增加;50 mg/L组的肠道绒毛肿胀,绒毛宽度显著大于对照组和25 mg/L组,且肠道肌层厚度显著大于对照组。在急性氨胁迫对草鱼肠道影响的研究中[33],肠道出现同样的变化。肠道内的杯状细胞数量增多,会促使肠道黏液分泌增多,以达到保护肠道减少损伤的目的[34]。绒毛宽度和肌层厚度增加可能是肠道产生炎症的预兆,氨暴露可诱导氧化应激和炎症,改变鱼体酶活性,进而损伤肠道[33,35]。因此,高浓度的氨氮可能会引起肠道的炎症反应,肠道通过促进杯状细胞分裂应对氨氮胁迫带来的影响,从而影响肠道的结构与功能。
3.2 氨氮胁迫造成大口黑鲈氧化应激
在水体中氨氮浓度升高时,鱼体内发生一系列应激反应而产生大量ROS;MDA 是ROS脂质过氧化反应的产物[36],氨氮胁迫后肠组织中的MDA含量显著增加,导致细胞的正常功能受损。SOD和CAT是机体抗氧化系统的重要组成部分,能有效清除ROS[37]。胁迫后SOD和CAT活性也明显高于对照组,去清除过多的ROS,以减轻过氧化损伤。这与翘嘴鳜(Siniperca chuatsi)的研究结果一致[38]。而50 mg/L组SOD活性较25 mg/L组低,可能是因为胁迫产生的有害物质超过了鱼体的耐受上限。孙丽颖等[39]对黄颡鱼的研究发现,过高的氨氮浓度会抑制抗氧化酶活性。氨氮胁迫抑制鱼体的调节能力,抗氧化功能被削弱,从而可能影响肠道的结构和功能,这与肠道组织切片的结果一致。
3.3 氨氮胁迫影响大口黑鲈非特异性免疫相关酶活性及免疫能力
LZM是鱼类先天免疫的重要防御因子,是反映鱼类免疫毒性的常规指标[40]。LZM能激活机体的补体系统[41];C3是补体系统的主要成分,在抵抗病原感染和炎症反应方面起着重要作用[42]。在本实验中,氨氮胁迫刺激大口黑鲈合成或分泌LZM,增强LZM活性,进而激活补体系统促进补体C3活性上升,加强非特异性免疫,以应对氨氮带来的毒性作用。鲤(Cyprinus carpio)[43]和异育银鲫(Carassius auratus gibelio)[44]的研究也出现相同现象。
GPT和GOT是动物体内广泛存在的重要的转氨酶,通常用这两种酶的活性检测氨基酸的代谢情况并反映肝脏的功能状况。在正常情况下,GPT和GOT存在于细胞内,只有极少数释放入血液中[45]。在本研究中,氨氮胁迫后,两实验组的GPT和GOT活性均显著低于对照组。在尼罗罗非鱼(Oreochromis niloticus)的研究[46]也发现,氨氮胁迫会降低组织中GPT和GOT的浓度。其原因可能是氨氮胁迫使肝细胞受到损伤,细胞膜通透性增加,转氨酶释放到血液里所致,氨基酸代谢因此受到抑制。
3.4 氨氮胁迫改变大口黑鲈肠道微生物的组成及功能
在外界环境胁迫条件下,鱼类肠道菌群结构会发生一定程度的改变[47,48]。氨氮胁迫后Alpha多样性和Beta多样性显著变化,微生物菌群有明显的聚类特征,菌群差异显著。在戚晓舟[49]对鲫的氨氮胁迫研究中,也出现胁迫组物种丰度提高,肠道菌群结构改变的现象。Khan等[50]对中华花龟(Mauremys sinensis)的研究也发现,在氨胁迫下肠道微生物Beta多样性差异显著,影响了肠道菌群的组成。这说明氨氮胁迫使肠道微生物群丰度产生差异,肠道菌群结构发生变化,而肠道菌群结构变化易造成宿主生理功能的异常[51]。
在氨氮胁迫后,大口黑鲈肠道内变形菌门、梭杆菌门、拟杆菌门、螺旋体门和厚壁菌门占据优势,AN50组的螺旋体门和拟杆菌门相对丰度显著高于NAN组。有研究指出,变形菌门、梭杆菌门、拟杆菌门和厚壁菌门是淡水鱼类肠道微生物群的重要组成部分[52]。螺旋体广泛分布在自然界和动物体内,多通过寄生引起疾病。在暗纹东方鲀(Takifugu obscurus)和大西洋鲑(Salmo salar)的相关研究中,螺旋体门是其肠道微生物菌群的优势菌群之一[53,54],但是关于螺旋体如何对淡水鱼产生影响的研究尚少,其对鱼体结构、功能的作用有待进一步探究。
拟杆菌门的菌群多生活在动物的肠道中,为条件致病菌,参与肠道中糖类、蛋白质的代谢[55],与肠道炎症密切相关[53]。厚壁菌门和拟杆菌门的比例可用来表示动物的肥胖程度,厚壁菌门和拟杆菌门的相互作用对鱼类肠道的能量代谢起着重要的作用[56]。在本研究中,厚壁菌门和拟杆菌门的比例降低,可能削弱鱼体能量代谢。金黄杆菌属在本实验中是优势菌属,是一类革兰氏阴性菌,属于拟杆菌门,会引起水产动物的疾病[57]。王鑫毅等[58]对乌鳢(Channa argus)的研究发现,金黄杆菌属有比较强的毒性,鱼类感染金黄杆菌属会出现鳞片脱落、肝肿大和肠组织黏连等症状。氨氮胁迫后拟杆菌门和金黄杆菌属丰度的增加,可能引起大口黑鲈肠道损伤,破坏能量平衡,影响鱼体生长代谢。
变形菌门是细菌中最大的一个门,同时也包含了大量的病原菌。在氨氮胁迫后,变形菌门相对丰度总体没有显著变化,其门下的不动杆菌属和邻单胞菌属丰度差异显著,不动杆菌属显著增多,邻单胞菌属则显著减少。不动杆菌感染多出现在犬科动物和人上,近年来常出现在鱼类中,其致病性被广泛研究[59,60]。不动杆菌属感染可能会导致团头鲂出现鳞片脱落、肝脏发白和肝细胞肿胀空泡等症状[61],氨氮胁迫后不动杆菌属的增多可能导致大口黑鲈组织损伤。邻单胞菌属常见于鱼类、水生动物和各种哺乳动物消化道内,发病时对鱼类等水产动物造成极大危害[62]。然而氨氮胁迫降低了邻单胞菌属丰度,使大口黑鲈因邻单胞菌属产生疾病的可能降低。
氨氮胁迫会引起大口黑鲈肠道菌群功能的差异。AN50组和NAN组的优势菌群均是革兰氏阴性菌,占到相对丰度的90%以上。革兰氏阴性菌是鱼类肠道微生物的优势菌群,也存在一部分革兰氏阳性菌[63]。同时,AN50组有较低的生物膜形成能力和耐应激性。微生物生物膜是由微生物群体及其包被的细胞外多聚物和基质网组成,生物膜形成后细菌对宿主免疫防御机制的抵抗力也会增强[64,65]。氨氮胁迫会使大口黑鲈肠道微生物的生物膜形成能力降低,不利于菌群在肠道中的生存,减少了因肠道菌群致病的可能。肠道菌群的耐应激性更低,说明氨氮浓度高时,大口黑鲈肠道容易受到影响,菌群平衡破坏,进而影响鱼体健康。
4 结论
本实验结果表明,氨氮胁迫使大口黑鲈的肝脏、肠道组织结构发生变化,同时氨氮胁迫后肠道微生物结构被破坏,引起大口黑鲈肝脏、肠道损伤,破坏能量平衡,影响鱼体生长代谢。随水体氨氮浓度的升高,MDA含量增多,SOD、CAT、LZM和补体C3活性升高,GOT和GPT活性降低,使大口黑鲈产生氧化应激,并降低其非特异性免疫能力。在氨氮胁迫后,肠道菌群生物膜形成能力和菌群耐应激性降低,大口黑鲈肠道更容易受到损伤。在进行大口黑鲈养殖时,应密切注意养殖水体氨氮浓度的监测和管理,防止氨氮对大口黑鲈幼鱼的毒性效应。

