GSTP1和ERCC1基因多态性与食管癌患者放疗敏感性及预后的关系
李强虎,辛 勇
(1.徐州医科大学第一临床医学院,江苏 徐州 221004;2.徐州医科大学附属医院,江苏 徐州 221006)
临床治疗中,通过科学、足量的放疗能够有效控制食管癌进展[1],但并非所有食管癌患者均对放疗敏感,部分患者因对放疗耐受而造成治疗失败,其影响因素包括患者自身特征、肿瘤本身、放射剂量效应关系等[2]。随着近年来基因检测技术的快速发展,通过基因检测预测食管癌患者对放疗的敏感性,并制定个体化放疗方案。相关研究[3]显示,DNA损伤修复能力与放疗敏感性密切相关,DNA损伤修复相关基因在其中发挥重要作用,其单核苷酸多态性(SNP)能够改变DNA修复蛋白功能,进而影响损伤修复能力。谷胱甘肽硫转移酶P1基因(GSTP1)、切除修复交叉互补基因1(ERCC1)在核苷酸修复中发挥重要作用[4]。为此,本研究主要探讨GSTP1和ERCC1基因多态性与食管癌患者放疗敏感性及预后的关系。
1 对象与方法
1.1 研究对象
选取2018年4月—2020年2月徐州医科大学附属医院收治的食管癌患者200例。其中,男144例,女56例;年龄61~75岁,平均(66.31±5.08)岁。根据放疗结束后的疗效将患者分为放疗敏感组(完全缓解、部分缓解)、放疗不敏感组(稳定、进展)。本研究经徐州医科大学附属医院医学伦理委员会审核批准,患者均自愿参与并签署知情同意书。
入选标准:经内镜检查和病理检查确诊为食管癌;无放疗禁忌证,接受多西他赛单药化疗和同期放疗;完成3 a随访研究。
排除标准:有重要器官功能异常或癌细胞远处转移的患者;接受过手术治疗、放疗、化疗的患者。
1.2 方 法
1.2.1 治疗方案
食管癌患者放疗方案:采取适形放射治疗,总剂量为原发肿瘤靶区60 Gy,2 Gy/次,1次/d,5次/周,30次为1个疗程。放疗第1天开始同期进行化疗,化疗方案:多西他赛40 mg,1次/周,6次为1个疗程,共2个疗程。
1.2.2 疗效评价
患者放疗1个疗程后,参照实体瘤疗效评价标准(RECIST1.1)判断食管癌患者的疗效,分为完全缓解、部分缓解、稳定、进展。其中,完全缓解:靶病灶完全消失;部分缓解:靶病灶最大径与治疗前相比减少30%及以上;稳定:处于部分缓解和进展之间的状态;进展:靶病灶最大径与治疗前相比增加20%及以上,或出现新发肿瘤病灶。将完全缓解、部分缓解纳入放疗敏感组,稳定、进展纳入放疗不敏感组。治疗后对患者进行3 a随访,利用电话、门诊复查、住院复查等方式进行,记录患者生存情况。
1.2.3 GSTP1和ERCC1基因型检测
采集患者外周静脉血4 mL,放入EDTA抗凝管中4 ℃保存待测,使用Qiagen全血基因组DNA提取试剂盒获得基因组DNA。PCR扩增引物由上海士锋生物有限公司合成。GSTP1上游引物:5′-AAAGTCCCCTCTTTAAAC CGC-3′,下游引物:5′-CTGACTGATGGAGTACTTGTT-3′;ERCC1上游引物:5′-CCGTCATTAGGCGGTCGGAA-3′,下游引物:5′-CTCATGTAGTGGTCGTC GTAG-3′。PCR反应体系20 μL,包括dNTP Master Mix 6 μL、上游引物1 μL、下游引物1 μL、DNA模板3 μL、双蒸馏水9 μL。扩增条件:94 ℃预变性1 min,95 ℃变性40 s,60 ℃复性1 min,共45个循环,72 ℃延伸5 min。检测仪器自带软件收集荧光信号并分析得出SNP分型,同时将标本送至基因科技(上海)股份有限公司进行直接测序。
1.2.4 MBP-1、PTEN、Cyclin D1、PLCE1基因表达检测
取适量的患者食管癌组织,加入RIPA蛋白裂解液充分研磨,将组织悬液以12 000 r/min 4 ℃恒温离心15 min,收集上清液;应用酶联免疫吸附法测定髓磷脂碱性蛋白1(MBP-1)、磷酸酶张力蛋白同源物(PTEN)、G1/S-特异性周期蛋白-D1(Cyclin D1)、磷脂酶Cε1(PLCE1)基因蛋白浓度。
1.3 统计学分析

2 结 果
2.1 不同性别、病理类型的食管癌患者GSTP1和ERCC1基因多态性分析
本研究结果显示,200例食管癌患者中GSTP1基因携带野生型GG 115例,杂合型GA 61例,突变型AA 24例。ERCC1基因携带野生型CC 86例,杂合型CT 99例,突变型TT 15例。GSTP1和ERCC1基因SNP分布符合Hardy-Weinberg平衡,GSTP1和ERCC1基因各位点的基因型分布在不同性别、病理类型的食管癌患者间比较差异均无统计学意义(P>0.05)。见表1。
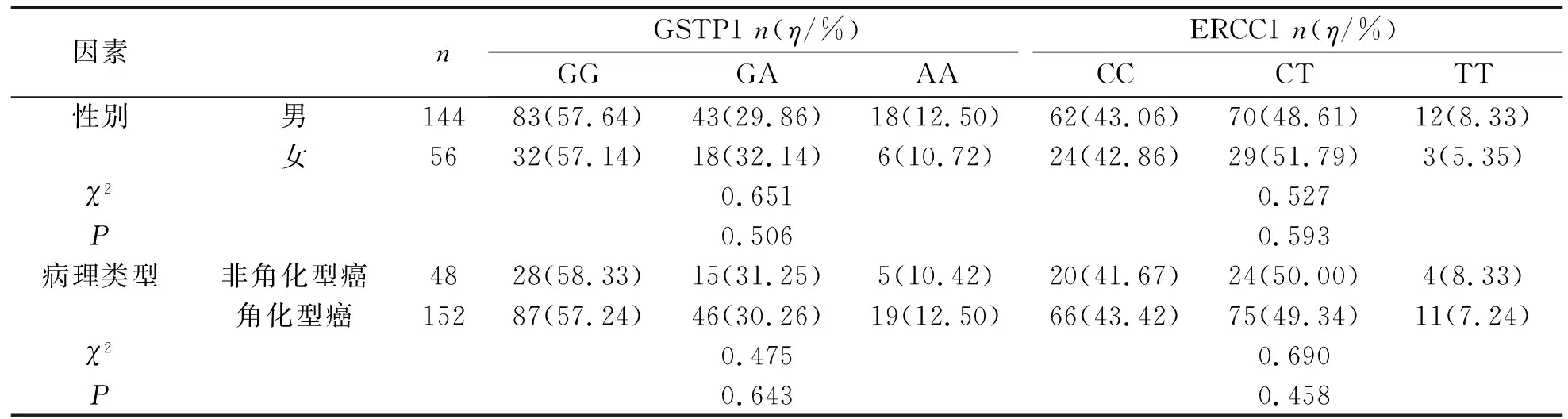
表1 不同性别、病理类型的食管癌患者GSTP1和ERCC1基因多态性分析Tab.1 Analysis of GSTP1 and ERCC1 gene polymorphisms in esophageal cancer patients with different genders and pathological types
2.2 GSTP1和ERCC1基因型与食管癌患者放疗后疗效分析
本研究结果显示,200例食管癌患者经放疗后敏感(完全缓解、部分缓解)119例纳入放疗敏感组,不敏感(稳定、进展)81例纳入放疗不敏感组。GSTP1基因携带杂合型GA和突变型AA的食管癌患者放疗后完全缓解、部分缓解的比例明显高于野生型GG的患者,稳定、进展的比例明显低于野生型GG的患者(P<0.001)。ERCC1基因携带野生型CC的食管癌患者放疗后完全缓解、部分缓解的比例明显高于携带杂合型CT和突变型TT的患者,稳定、进展的比例明显低于携带杂合型CT和突变型TT的患者(P<0.001)。见表2。

表2 GSTP1和ERCC1基因型与食管癌患者放疗后疗效分析Tab.2 GSTP1 and ERCC1 genotypes and efficacy of radiotherapy in esophageal cancer patients
2.3 GSTP1和ERCC1基因型与食管癌患者放疗后生存时间的关系
本研究结果显示,GSTP1基因携带杂合型GA和突变型AA的食管癌患者放疗后1 a生存率、2 a生存率、3 a生存率均明显高于野生型GG的患者(P<0.05);ERCC1基因携带野生型CC的食管癌患者放疗后1 a生存率、2 a生存率、3 a生存率均明显高于携带杂合型CT和突变型TT的患者(P<0.05)。见表3。
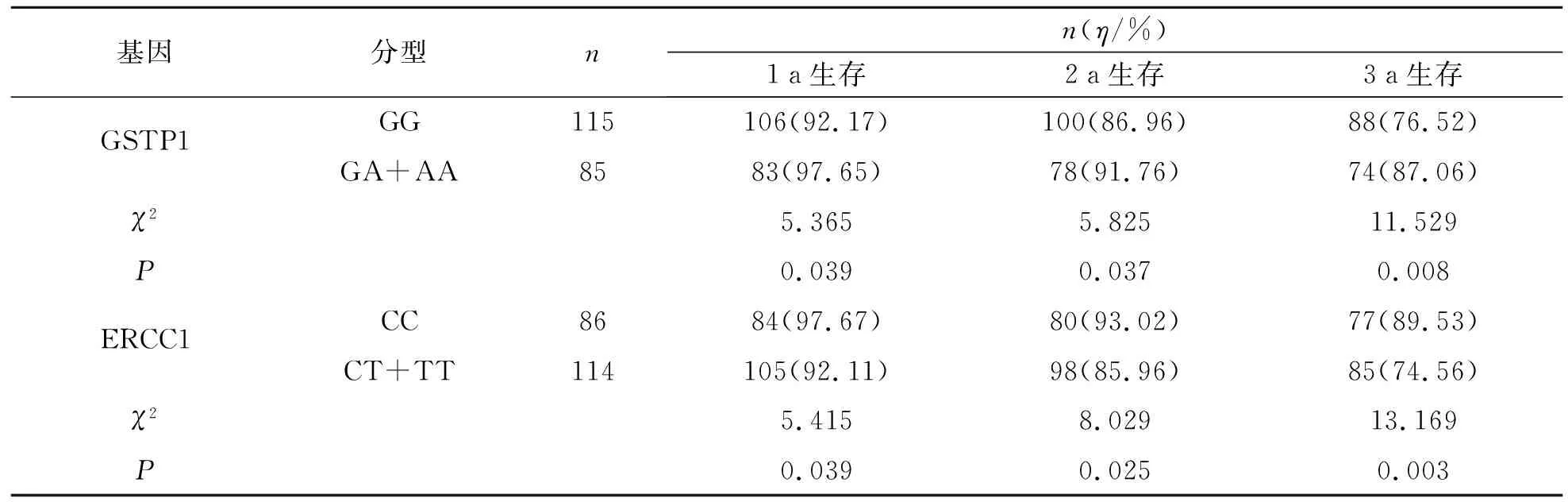
表3 GSTP1和ERCC1基因型与食管癌患者放疗后生存时间的关系Tab.3 GSTP1 and ERCC1 genotypes and survival time after radiotherapy in esophageal cancer patients
2.4 不同放疗敏感性的食管癌组织中增殖、凋亡相关基因表达
本研究结果显示,放疗不敏感组食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显低于放疗敏感组食管癌患者,增殖相关基因Cyclin D1、PLCE1表达水平明显高于放疗敏感组食管癌患者(P<0.05)。见表4。
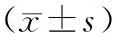
表4 不同放疗敏感性的食管癌组织中增殖、凋亡相关基因表达Tab.4 Expression of proliferation and apoptosis related genes in esophageal cancer tissues with different radiosensitivity
2.5 GSTP1和ERCC1基因型与食管癌组织中增殖、凋亡相关基因表达水平的关系分析
本研究结果显示,GSTP1基因携带杂合型GA和突变型AA的食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显高于野生型GG的患者,增殖相关基因Cyclin D1、PLCE1表达水平明显低于野生型GG的患者(P<0.001)。ERCC1基因携带野生型CC的食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显高于携带杂合型CT和突变型TT的患者,增殖相关基因Cyclin D1、PLCE1表达水平明显低于携带杂合型CT和突变型TT的患者(P<0.05)。见表5。
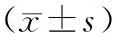
表5 GSTP1和ERCC1基因型与食管癌组织中增殖、凋亡相关基因的关系分析Tab.5 Analysis of relationship between GSTP1 and ERCC1 genotypes and expression levels of proliferation and apoptosis related genes in esophageal cancer tissue
3 讨 论
放射生物学效应主要是通过DNA改变来实现的,当人体细胞在X线作用下会发生单链或双链断裂,其中双链断裂主要发生在对侧互补碱基对或间隔区碱基对[5]。DNA双链断裂是目前公认的电离辐射所致染色体损伤,主要修复方式为切除修复[6]。近年来研究[7]显示,恶性肿瘤患者放疗的疗效差异可能与DNA损伤修复水平有关。在恶性肿瘤患者分次放疗中,射线能够对DNA造成累积性损伤,该损伤过程在多种DNA底物及修复酶的作用下持续被修复,当患者对放疗中射线所致DNA损伤修复能力较强时,表现为放疗敏感性低[8]。GSTP1是从哺乳动物中分离得到的影响细胞对电离辐射敏感性的基因,参与DNA的修复过程,其编码蛋白无直接催化活性,但能够在碱基切除修复过程中发挥蛋白支架作用,与DNA连接酶作用后参与电离辐射所致的DNA修复和碱基损伤过程[9]。相关研究[10]显示,GSTP1基因G28152A位点多态性能够降低GSTP1基因的碱基切除活性,影响肿瘤细胞对放射性的敏感性。本研究对GSTP1基因G28152A位点多态性进行检测,结果显示,携带杂合型GA和突变型AA的食管癌患者放疗后完全缓解的比例明显高于野生型GG的患者,放化疗后1 a生存率、2 a生存率、3 a生存率均明显高于野生型GG的患者。提示食管癌患者中GSTP1基因携带杂合型GA和突变型AA的放疗效果更好,生存率处于较高水平;检测GSTP1基因SNP可作为食管癌患者放疗敏感性的预测指标之一。
ERCC1编码一种高度保守的单链DNA内切酶,其表达产物与相应的DNA切除修复酶通过互补基因相互结合而生成XPF-ERCC1核酸酶复合体,作为特异性核酸内切酶,发挥损伤识别、切除DNA 5′端的双重作用[11]。ERCC1基因C118T位点核苷酸C向T改变,会造成密码子中AAC排列转变为AAT,虽然上述两种核苷酸排列均编码天门冬氨酸,但SNP会改进基因转录[12]。相关研究[13]显示,卵巢癌细胞中ERCC1基因第121位密码子由C变异为T,造成ERCC1蛋白表达下调。目前,关于ERCC1基因多态性与食管癌放疗疗效的相关研究较少,为此,本研究对ERCC1基因C118T位点多态性进行检测,结果显示:ERCC1基因携带野生型CC的食管癌患者放疗后完全缓解的比例明显高于携带杂合型CT和突变型TT的患者,放疗后1 a生存率、2 a生存率、3 a生存率均明显高于携带杂合型CT和突变型TT的患者。提示食管癌患者中ERCC1基因携带野生型CC的放疗效果更好,生存率处于较高水平;检测ERCC1基因SNP也可作为食管癌患者放疗敏感性的预测指标。
放疗能够促进肿瘤细胞凋亡,抑制肿瘤细胞增殖,凋亡、增殖相关基因的表达也会发生相应改变[14]。食管癌病情发展过程中MBP-1、PTEN属于凋亡相关基因,Cyclin D1、PLCE1属于增殖相关基因[15]。其中MBP-1作为c-myc启动子结合蛋白,可抑制其生物学活性,诱导细胞凋亡[16];PTEN负调控磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)通路,抑制该信号通路介导的细胞生长[17]。Cyclin D1属于细胞周期家族成员,具有高度保守性,其可通过调控细胞周期蛋白依赖性激酶来促进细胞增殖[18]。PLCE1可通过诱导抑癌基因p53活化来促进肿瘤细胞增殖[19]。本研究结果显示,放疗不敏感组食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显低于放疗敏感组食管癌患者,增殖相关基因Cyclin D1、PLCE1表达水平明显高于放疗敏感组食管癌患者,提示MBP-1、PTEN、Cyclin D1、PLCE1表达水平与食管癌放疗敏感性密切相关。进一步分析显示,GSTP1基因携带杂合型GA和突变型AA的食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显高于野生型GG的患者,增殖相关基因Cyclin D1、PLCE1表达水平明显低于野生型GG的患者。ERCC1基因携带野生型CC的食管癌患者凋亡相关基因MBP-1、PTEN表达水平明显高于携带杂合型CT和突变型TT的患者,增殖相关基因Cyclin D1、PLCE1表达水平明显低于携带杂合型CT和突变型TT的患者。说明GSTP1基因携带杂合型GA和突变型AA,ERCC1基因携带野生型CC可能通过上调凋亡相关基因MBP-1、PTEN表达,下调增殖相关基因Cyclin D1、PLCE1表达来发挥抑制食管癌病情发展的作用,具有较高的放疗敏感性。
综上所述,食管癌患者GSTP1和ERCC1基因SNP可作为放疗敏感性的预测指标,其中GSTP1基因携带杂合型GA和突变型AA,ERCC1基因携带野生型CC的患者放疗预后较好,可能与上调凋亡相关基因MBP-1、PTEN表达,下调增殖相关基因Cyclin D1、PLCE1表达有关。

