辐射诱导成纤维细胞FAP表达对放射治疗后瘢痕复发的影响
唐建萍,刘钟华
(1.吉林大学第一医院,吉林 长春 130021;2.长春中医药大学第三附属医院, 吉林 长春 130061)
瘢痕疙瘩(keloid scars,KSs)是一种皮肤纤维增殖性疾病,为皮肤损伤后结缔组织过度增生所产生的[1]。放射治疗是目前公认的瘢痕疙瘩最重要的临床治疗方法之一[2]。高能电子线照射时,从体表进入体内深部后都可以维持均匀的剂量分布,目前,已成为瘢痕疙瘩术后辅助放疗的最佳选择[3]。单纯手术切除是治疗瘢痕疙瘩和增生性疤痕的传统方法,复发概率为45%~100%[4]。放疗通常作为瘢痕疙瘩的术后辅助治疗,可将瘢痕疙瘩复发概率控制在15%~23%[2]。然而,其复发机制尚不清楚。成纤维细胞活化蛋白(fibroblast activation protein alpha,FAP)是一种膜上的丝氨酸蛋白酶(二肽基肽酶Ⅳ),可能在瘢痕疙瘩的侵袭性中发挥关键作用[5],对伤口愈合和肿瘤侵袭过程中细胞外基质的降解极为重要。FAP具有蛋白酶和胶原酶活性,但在正常成人组织中FAP通常呈阴性[6],提示FAP可能是治疗瘢痕疙瘩的新靶点,但目前关于FAP与放疗后瘢痕疙瘩复发关系的研究很少,因此有必要建立合适的动物模型探索新的治疗方法。将人源性组织移植到具有免疫能力的啮齿动物体内的主要障碍是其自身强大的异种免疫排斥反应[7],通过破坏对免疫细胞的发育、存活和功能起重要作用的相关基因,已经培育出了几种免疫缺陷小鼠品系[8]。本研究使用三重免疫缺陷(NCG)小鼠,通过构建人瘢痕疙瘩组织PDX异种移植NCG小鼠模型,研究FAP在瘢痕疙瘩复发中的作用机制,以期为瘢痕的临床治疗提供理论依据。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器
60只8周龄NCG小鼠(动物生产许可证号: SCXK(京)-2019-0009,北京维通利华实验动物技术有限公司);所有小鼠饲养于22 ℃、12 h光/暗循环的SPF级标准动物房中,自由摄取食物和饮水。本研究经医院实验动物伦理委员会审核通过,所有动物操作均符合试验动物使用和保护条例。人瘢痕疙瘩成纤维细胞由8名瘢痕疙瘩患者手术切除的组织中提取,本研究经医院医学伦理委员会审核批准,所有患者知情同意。
DMEM培养基、1%青-链霉素、胰蛋白酶、胎牛血清(fetal bovine serum,FBS)和磷酸盐缓冲盐水(phosphate buffered saline,PBS)(Gibco公司,美国);RNA提取试剂盒(Amresco公司,美国);反转录试剂盒、实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR) 试剂盒和PCR引物(上海翊圣生物科技有限公司);4%多聚甲醛组织固定液(上海尚宝生物科技有限公司);免疫组化一抗FAP、CD31抗体(Affinity公司,美国);二抗Kit-9706和过氧化物酶试剂盒(迈欣科技有限公司);碘化丙啶PI染色液和曲拉通X-100(Triton X-100)(北京博奥拓达科技有限公司);细胞计数试剂盒-8(cell counting kit-8,CCK-8)(上海碧云天生物技术有限公司);21EX直线加速器放疗设备(Clinac 21ex,Varian医疗系统,瓦里安公司,美国);低温离心机(5424R)(Eppendorf公司,德国),基因扩增仪(ETC811)(苏州东胜兴业科学仪器有限公司);荧光定量PCR仪(Rotor-Gene Q)(孚约生物科技(上海)有限公司);流式细胞仪(BD FACS Canto II)(BD公司,美国);多功能酶标仪(SPARK)(TECAN公司,瑞士)。
1.2 组织来源、制备、异种移植及电子线照射
将瘢痕组织用磷酸盐缓冲盐水洗涤2次,并在无菌条件下切成边长为3 mm的正方体组织块。将60只8周龄NCG小鼠以0.1 mL/10 g体质量、5%水合氯醛腹腔注射麻醉,在臀大肌上方背中线两侧做1 cm切口,将瘢痕组织块植入皮下,最后缝合创口。将两侧皮下移植物分为两组,左侧为未照射组,右侧为照射组。照射组的组织块植入小鼠体内1周后,对移植小鼠右侧移植物应用6 MeV进行电子线照射,剂量率为600 cGy/min,剂量为10 Gy,非目标区域用2 cm的铅板屏蔽。
1.3 原代成纤维细胞培养及电子线照射
将瘢痕组织用磷酸盐缓冲盐水洗涤2次,在无菌条件下切成边长为3 mm的正方体组织块。将组织块间隔1 cm放入培养皿中,加入含有10%FBS和1%青-链霉素双抗的DMEM培养基,置于37 ℃、5% CO2恒温培养箱中培养。约1周可见原代成纤维细胞从组织块边缘爬出,当原代成纤维细胞达到90%的融合度时进行胰酶消化并传代培养。培养至第3代时开始细胞试验。将细胞分为未照射组和照射组,照射组细胞长至70%~80%时应用6 MeV电子线照射,剂量率为600 cGy/min,剂量为10 Gy,非目标区域用2 cm的铅板屏蔽。
1.4 实时定量PCR检测细胞中mRNA水平
收集未照射组和照射组细胞,用RNA提取试剂盒提取两组细胞总RNA,根据反转录试剂盒和RT-qPCR试剂盒说明书进行mRNA定量分析。引物序列:FAP上游引物5′ GGAAGTGCCTGTTCCAGCAATG-3′,下游引物5′- TGTCTGCCAGTCTTCCCTGAAG-3′ ;Vimentin上游引物5′-AGGCAAAGCAGGAGTCCACTGA-3′,下游引物5′-ATCTGGCGTTCCAGGGACTCAT-3′ ;Beta-actin上游引物5′-ATTGCCGACAGGATGCAGAAG-3′,下游引物5′-CCATGCCAATCTCATCTTGT-3′ 。
1.5 免疫组织化学检测小鼠移植物内FAP和CD31的表达
收集两组小鼠移植物组织,用4%多聚甲醛固定20 min,石蜡包埋,切片至4 μm厚度,将组织切片进行抗原修复;应用一抗FAP(1∶200) 和CD31(1∶200)孵育,然后应用二抗Kit-9706(1∶1 000)孵育,并使用过氧化物酶试剂盒检测免疫反应性;应用Image-Pro Plus 6.0软件进行定量分析。
1.6 CCK-8检测细胞增殖
应用细胞计数试剂盒-8评估细胞增殖。将成纤维细胞(3×103细胞/孔)接种到96孔板中,在37 ℃、5% CO2恒温培养箱中培养;加入CCK-8溶液2 h,在450 nm处测定吸光度(A)值。
1.7 流式细胞术检测细胞周期
在未照射组和照射组的成纤维细胞达到80%~90%时进行胰蛋白酶化。将细胞用PBS清洗2次,在-20 ℃、70%乙醇中固定12 h,用300 μL PI(终浓度为50 mg/L)和0.1% Triton X-100在37 ℃下放置15 min;应用流式细胞术分析细胞周期不同阶段的细胞分布。
1.8 统计学分析

2 结 果
2.1 建立人源瘢痕疙瘩组织异种移植NCG小鼠模型
将瘢痕手术后的组织切成边长为3~4 mm的正方形组织块,并在无菌条件下将切好的组织块植入NCG小鼠双侧背部皮下并缝合(见图1 a)。在本研究中,移植20周后,能够观察到明显的组织体积减小,但移植物仍然可见;移植3周后建立了稳定的新生血管(见图1 b)。移植4周后,用单次10 Gy的电子线照射移植小鼠的右侧移植物(见图1 c)。结果显示,本研究成功构建了人源瘢痕疙瘩异种移植小鼠模型。
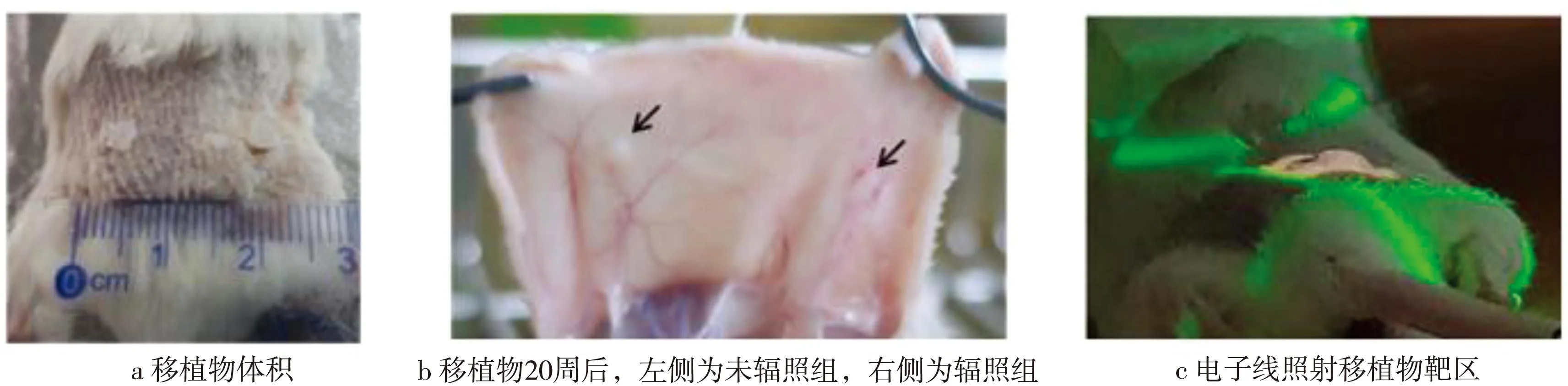
图1 人源瘢痕疙瘩组织移植NCG小鼠及其照射方式Fig.1 Human keloid tissue transplantation of NCG mice and its radiotherapy
2.2 免疫组织化学检测两组小鼠移植物和荧光定量PCR检测两组细胞CD31和FAP表达
通过免疫组化检测未照射组和照射组照射4周后小鼠移植物中CD31和FAP表达情况,结果显示,照射组移植物较未照射组的CD31表达量明显减少,而FAP的表达量明显升高(P<0.001)。见图2 a。在体外实验中,荧光定量PCR结果显示,照射组的成纤维细胞FAP(P<0.001)和Vimentin(P<0.01)的表达量在第4周明显高于未辐照组(见图2 b)。以上结果提示电子线照射可以诱导激活瘢痕组织中的成纤维细胞,上调FAP表达水平,促进瘢痕组织复发。
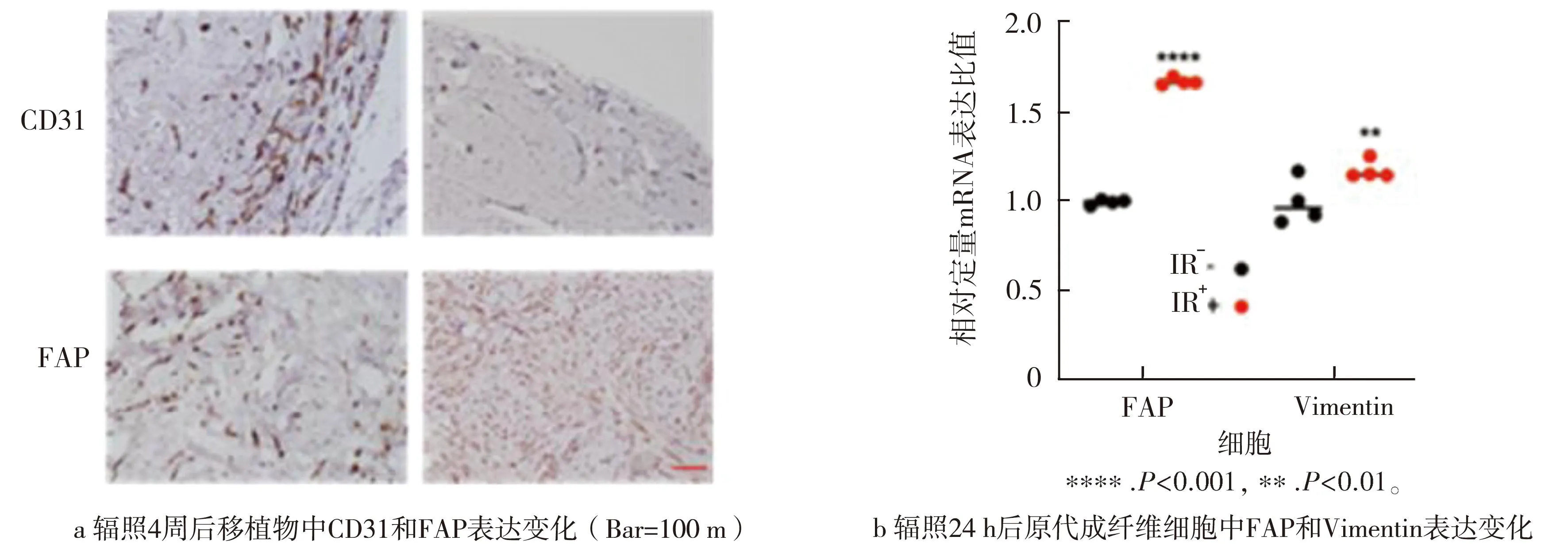
图2 组织及细胞中相关指标表达变化Fig.2 Expression of indicated molecule in tissues and cells
2.3 CCK-8检测两组原代成纤维细胞增殖能力
本研究结果显示,辐照后的瘢痕组织原代成纤维细胞会具有更强的增殖能力(见图3 a)。CCK8法检测结果显示,与未照射组比较,照射组在450 nm处A值更高(P<0.05),表示其细胞增殖能力更强(见图3 b)。

图3 两组原代成纤维细胞增殖能力Fig.3 Proliferation ability of primary fibroblasts in two groups
2.4 流式细胞术分析两组成纤维细胞的细胞周期
KEGG分析显示,辐照显著增加了细胞周期调节因子的表达。因此,通过流式细胞术分析两组成纤维细胞的细胞周期变化,结果显示,与未照射组比较,照射组照射后4周明显促进成纤维细胞进入S期,加速了细胞的增殖(见图4 a)。体外试验证明,成纤维细胞照射后第3天开始,进入S期的细胞比例明显超过未照射组(见图4 b)。
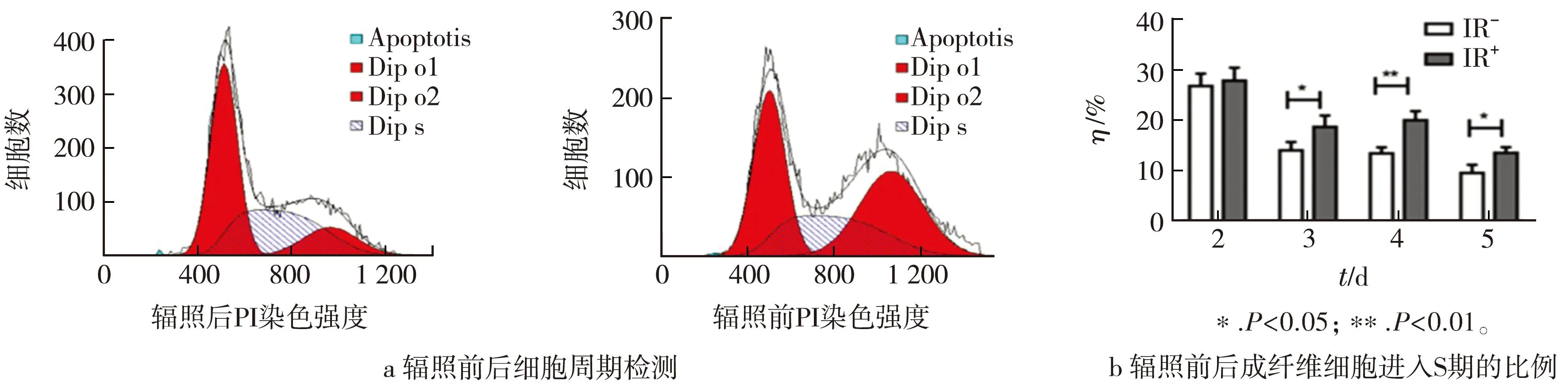
图4 流式细胞术鉴定细胞周期Fig.4 Cell cycle identification by flow cytometry
3 讨 论
瘢痕疙瘩是一种纤维增生性疾病和人类特有的生理现象,可发生在遗传易感人群中[9]。因此,由于瘢痕疙瘩仅能在人体上产生,是很难通过动物模型进行体内科学研究的。免疫缺陷小鼠品系的培育为研究体内瘢痕疙瘩的病理提供了一种新的方法,这种人源组织异种移植小鼠模型(PDX模型)在移植后几周到几个月仍然存活[8,10]。本研究利用NCG小鼠建立了人源性瘢痕疙瘩组织的PDX模型,移植物成功在小鼠体内存活了长达20周。虽然随着时间的推移,能够观察到明显的组织损失,但所有移植物在20周内保持了其原始的组织学和形态学特征,为临床研究和分子机制提供了足够长的窗口期。
研究[11]表明,电子线照射瘢痕疙瘩具有良好的临床疗效,最近的数据[4]显示,手术切除瘢痕疙瘩后随即进行电子线照射可将复发概率降低到8.6%,而传统瘢痕疙瘩手术的复发概率高达45%~100%。关于最佳照射时间,大多数研究[12]建议在瘢痕疙瘩手术切除后24~48 h内应进行电子线辅助放射治疗。从放疗分子机制上看,此时在切口肉芽组织中占主导地位的成纤维细胞是对辐射敏感组织。因此,这种放疗策略可以有效抑制成纤维细胞的增殖和分裂,减少胶原沉积。然而,对于最佳照射剂量和分割方案尚未达成共识。在既往研究[13]中,瘢痕疙瘩的治疗基本上均为术后辅助放疗,剂量分割方式为12~20 Gy/3~5次。本研究证实,与正常分割方案相比,20 Gy/5次的辐射可产生更好的局部控制率。最近的研究[14]表明,对瘢痕疙瘩切除术后尽快使用大分割的高能电子线放疗是一种很好的临床治疗方法。单次8~10 Gy的电子线辅助放疗也被证实对治疗瘢痕疙瘩是有效和安全的[15-16]。既往研究[17]表明,对于不可切除的瘢痕疙瘩,根治性放疗亦可达到令人满意的疗效。因此,术后辅助放疗已成为瘢痕疙瘩最为常见的治疗方法。
在本研究通过电子线照射人源瘢痕疙瘩的PDX模型探讨FAP对辐照后瘢痕疙瘩复发的作用及其机制,血管作为辐照敏感组织,其状态直接影响移植物的存活周期。本研究提示照射后4周移植物的血管网络遭到严重破坏,表明辐照可迅速破坏移植物的新生血管系统,导致其产生辐射抗性。本研究观察到辐照后的瘢痕疙瘩组织迅速复发,并且伴随着FAP和Vimentin的表达回升。FAP是一种脯氨酸选择性丝氨酸蛋白酶,在瘢痕疙瘩组织和肿瘤基质(癌症/肿瘤相关成纤维细胞,CAFs/TAFs)中过度表达,但在大多数正常成人组织中检测不到[18-19]。FAP通过丝氨酸蛋白酶活性在基质重塑中发挥重要作用[20],放疗后肿瘤复发通常是由肿瘤辐射抗性成分引起的,这是由癌细胞内在特性和外部微环境共同作用的结果[21]。越来越多的证据[22-24]表明:FAP阳性的肿瘤CAFs可能提供更具免疫抑制性的肿瘤微环境,以抵抗免疫细胞/放疗/化疗的杀伤,从而提高肿瘤存活率。此外,移植瘤模型结果表明,FAP阳性基质细胞可以通过削弱T细胞抗肿瘤活性来促进免疫抑制[25]。然而,诱导FAP表达的机制尚不清楚。本研究结果首次揭示了电子线照射可提升体外和体外FAP的表达水平,未照射组FAP阳性组织的减少与组织损失呈正相关关系,而照射组FAP阳性组织的复发也与移植物体积成正比。此外,转录组学结果显示,辐照显著增强了移植物的翻译活性,促进细胞周期进程。本研究结果显示,无论是体内还是体外试验,辐照均促进成纤维细胞的S期细胞比例的增加,并提高其增殖能力。本研究发现,电子线仅在原代人瘢痕疙瘩衍生成纤维细胞中诱导FAP表达,也试图检测辐射诱导的小鼠成纤维细胞细胞系FAP表达,但该细胞系显示出较差的放射敏感性(数据未显示)。
综上所述,本研究结果显示,FAP在手术切除和放疗后瘢痕复发组织中的显著表达,表明辐照可能增强FAP阳性细胞丰度,其与细胞周期和增殖相关。

