CircRERE调节miR-128-3p/WEE1轴促进人多发性骨髓瘤细胞系增殖、迁移和侵袭
方 媛,李 轶,王 玮*
西安市第九医院1.肿瘤血液科;2.血管介入科,陕西 西安 710054
多发性骨髓瘤(multiple myeloma, MM)是一种以浆细胞恶性增殖为特征的血液系统肿瘤。由于极高的转移率和耐药性,MM的生存率仍不令人满意[1-2]。环状RNA精氨酸-谷氨酸二肽重复序列(circular RNA arginine-glutamate dipeptide repeat sequence,circRERE)在MM患者中上调,敲低circRERE表达可通过海绵状结合miR-152-3p抑制MM细胞增殖和硼替佐米抗性,促进MM细胞凋亡[3-4]。生物信息学预测显示circRERE序列中含有miR-128-3p的结合位点。miR-128-3p在MM中表达下调,lncRNA HCP5通过结合miR-128-3p促进MM的进展[5]。丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,WEE1)在包括MM在内的多种类型癌中高表达,抑制WEE1表达可促使肿瘤细胞凋亡并抑制其增殖[6]。生物信息学预测显示WEE1是miR-128-3p的潜在靶基因,且在胶质瘤中miR-128-3p可靶向负调控WEE1表达[7]。基于此笔者推测circRERE可能通过靶向miR-128-3p/WEE1轴来调节MM进展。故本研究旨在观察circRERE对MM细胞迁移、侵袭和增殖的影响及潜在机制。
1 材料与方法
1.1 材料
1.1.1 细胞:人MM细胞系(U266、RPMI-8226、NCI-H929、LP-1)和人胚肾细胞系293T(上海雅吉生物科技有限公司);选取西安市第九医院的健康体检者10名作为健康受试者,通过肘静脉采集外周血5 mL,用CD138富集法从健康受试者外周血中分离正常浆细胞(normal plasma cells,nPCs),健康受试者均签署知情同意书,本研究获得西安市第九医院伦理委员会的审核与批准(H20221021)。
1.1.2 主要试剂:Lipofectamine2000、Trizol(Invitrogen公司);BCA试剂盒、RIPA裂解液和噻唑蓝MTT试剂盒(上海碧云天公司);实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒、反转录试剂盒(TaKaRa公司);兔源一抗anti-磷酸甘油醛脱氢酶(phosphoglyceraldehyde dehydrogen-ase,GAPDH)、anti-WEE1及山羊源二抗(Abcam公司);1%结晶紫染液(北京索莱宝公司);5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EdU)染色液(广州锐博生物公司);双荧光素酶试剂盒(上海北诺生物科技有限公司);CircRERE、miR-128-3p和U6引物(南京金斯瑞公司设计合成);sh-circRERE、sh-NC、miR-128-3p inhibitor、inhibitor-NC、miR-128-3p mimic、mimic-NC、野生型circRERE(circRERE-WT)质粒、WEE1-WT质粒,突变型circRERE(circRERE-MUT)质粒和WEE1-MUT质粒(上海吉玛制药公司设计、合成)。
1.2 方法
1.2.1 细胞的分组与转染:nPCs和MM细胞系(U266、RPMI-8226、NCI-H929、LP-1)以及HEK-293T细胞均用含1%青霉素-链霉素双抗、10% FBS的RPMI-1640培养基,于37 ℃、5% CO2培养箱中常规培养。
取对数增殖期的RPMI-8226细胞,以5×104个/孔接种至24孔板内,待细胞汇合度达80%时弃去培养基,利用Lipofectamine2000进行转染,将细胞分为对照组(control)(未进行转染)、sh-circRERE组、sh-NC组、miR-128-3p inhibitor组、inhibitor-NC组、sh-circRERE+inhibitor-NC组和sh-circRERE+miR-128-3p inhibitor组,转染48 h后收集各组RPMI-8226细胞。sh-circRERE、sh-NC、miR-128-3p inhibitor和inhibitor-NC的转染量均为50 pmol/L。
1.2.2 RT-qPCR检测circRERE、miR-128-3p表达:使用Trizol从nPCs和MM细胞系及1.2.1各组RPMI-8226细胞中提取总RNA,通过NanoDrop 2000测定RNA浓度后,使用反转录试剂盒合成cDNA。U6作为miR-128-3p的内参,GAPDH作为circRERE的内参。采用RT-qPCR试剂盒和RT-qPCR仪进行PCR扩增反应。circRERE、miR-128-3p的定量采用2-ΔΔCt法。引物序列:circRERE:forward 5′-TTTG CAGGAATGTGTGATGG-3′,reverse 5′-ATGAATCC ACTCG GGCTTTA-3′;miR-128-3p:forward 5′-GGGT CACAGTGAACCG-3′,reverse 5′-AACTGGTGTCGTG GAGTCGGC-3′;GAPDH:forward 5′-GTCTCCTCTGA CTTCAACAGCG-3′,reverse 5′-ACCACCCTGTTGCT GTAGCCAA-3′;U6:forward 5′-GTGCTCGCTTCGG CAGCAC AT-3′,reverse 5′-TACCTTGCGAAGTGCTT AAAC-3′。
1.2.3 Western blot检测WEE1表达: 用RIPA裂解液提取nPCs和MM细胞及1.2.1各组RPMI-8226细胞总蛋白质。蛋白质样品使用BCA法进行定量。然后将蛋白质通过凝胶电泳分离,并转移到PVDF膜上。用5%脱脂奶粉阻断1 h后,4 ℃下与兔源anti-GAPDH、anti-WEE1一抗过夜孵育。次日,用山羊源二抗在室温下孵育膜2 h。最后,根据制造商的说明,滴加ECL发光液显色。采用Image-Pro Plus 6.0软件进行灰度分析,定量蛋白表达。
1.2.4 MTT法和EdU免疫荧光染色实验测定细胞增殖:MTT实验:RPMI-8226细胞接种至96孔板(1×104个/孔),孵育48 h,添加MTT试剂,4 h后加入DMSO,继续孵育10 min。用酶标仪测量490 nm处吸光度(A)。增殖率(%)=(A转染处理组-A空白组)/(A对照组-A空白组)×100%。
EdU免疫荧光染色:转染后的RPMI-8226细胞分别在添加50 μmol/L EdU标记液的培养基中孵育2 h,4%多聚甲醛固定后,甘氨酸孵育后,阿波罗染色(Apollo)30 min,5 μg/mL DPAI进行DNA染色30 min,荧光显微镜下检测EdU阳性细胞。
1.2.5 划痕愈合实验检测细胞迁移:RPMI-8226细胞接种至24孔板(5×104个/孔),孵育48 h后弃去培养基,用100 μL枪头在孔中间竖着划一条直线,PBS清洗2遍去除划下的细胞,继续培养48 h,而后于倒置显微镜下拍照,借助Image J软件计算细胞划痕面积愈合率。
1.2.6 Transwell小室法检测各组RPMI-8226细胞侵袭:预先于Transwell小室的上表面涂上Matrigel胶,收集转染的RPMI-8226细胞,在无血清RPMI-1640培养基中重悬。将4×104个细胞接种于孔径为8.0 μm的24孔室的上室,将含10% FBS的RPMI-1640培养基作为化学引诱剂加入下腔。37 ℃,孵育48 h,用棉签轻轻拭去上表面的细胞,随后置于固定液中30 min,PBS清洗、晾干后置于1%结晶紫染液中染色10 min,借助倒置显微镜计数细胞数量,即为侵袭细胞数量。
1.2.7 双荧光素酶报告基因实验证实miR-128-3p与circRERE或WEE1的靶向作用关系:通过ENCORI在线数据库预测miR-128-3p与circRERE或WEE1的结合位点。将circRERE、WEE1野生序列或突变序列分别插入到pmiRGLO载体,构建circRERE-WT/MUT质粒、WEE1-WT/MUT质粒。
取对数增殖期的293T细胞,以5×104个/孔接种至24孔板内,待细胞汇合度达80%时利用Lipofectamine2000进行转染,实验分组如下:1)circRERE-WT+miR-128-3p mimic组、circRERE-WT+mimic-NC组、circRERE-MUT+miR-128-3p mimic组、circRERE-MUT+mimic-NC组;2)WEE1-WT+miR-128-3p mimic组、WEE1-WT+mimic-NC组、WEE1-MUT+miR-128-3p mimic组、WEE1-MUT+mimic-NC组。48 h后,收集细胞,用裂解缓冲液裂解。根据制造商的方案,使用双荧光素酶试剂盒评估荧光素酶活性。
1.3 统计学分析

2 结果
2.1 CircRERE、miR-128-3p、WEE1在MM细胞系中的表达
与正常浆细胞nPCs比较,MM细胞RPMI-8226、U266、NCI-H929、LP-1中circRERE、WEE1表达增加,miR-128-3p表达减少(P<0.05)(图1)。其中,RPMI-8226细胞中circRERE、WEE1表达水平最高,miR-128-3p表达水平最低,故选择RPMI-8226细胞进行后续实验。

*P<0.05 compared with nPCs cells; # P<0.05 compared with RPMI-8226 cells.
2.2 各组RPMI-8226细胞中circRERE、miR-128-3p、WEE1的表达
与对照组比较,sh-circRERE组RPMI-8226细胞circRERE、WEE1表达减少,miR-128-3p表达增加(P<0.05);miR-128-3p inhibitor组miR-128-3p表达减少,WEE1表达增加(P<0.05);与sh-circRERE组比较,sh-circRERE+miR-128-3p inhibitor组RPMI-8226细胞miR-128-3p表达减少,WEE1表达增加(P<0.05)(图2)。

*P<0.05 compared with control group; # P<0.05 compared with sh-NC group; &P<0.05 compared with inhibitor-NC group; △ P<0.05 compared with sh-circRERE group; ▲ P<0.05 compared with miR-128-3p inhibitor group; ☆ P<0.05 compared with sh-circRERE+inhibitor-NC group.
2.3 敲低circRERE和/或miR-128-3p表达后RPMI-8226细胞增殖、迁移和侵袭
与对照组比较,sh-circRERE组RPMI-8226细胞增殖率、EdU阳性细胞比例、划痕面积愈合率、侵袭数均减少(P<0.05),miR-128-3p inhibitor组增殖率、EdU阳性细胞比例、侵袭数、划痕面积愈合率均增加(P<0.05);sh-circRERE+miR-128-3p inhibitor组与sh-circRERE组比较,增殖率、EdU阳性细胞比例、侵袭数、划痕面积愈合率均增加(P<0.05)(图3,4,5)。

*P<0.05 compared with control group; # P<0.05 compared with sh-NC group; &P<0.05 compared with inhibitor-NC group; △ P<0.05 compared with sh-circRERE group; ▲ P<0.05 compared with miR-128-3p inhibitor group; ☆ P<0.05 compared with sh-circRERE+inhibitor-NC group.
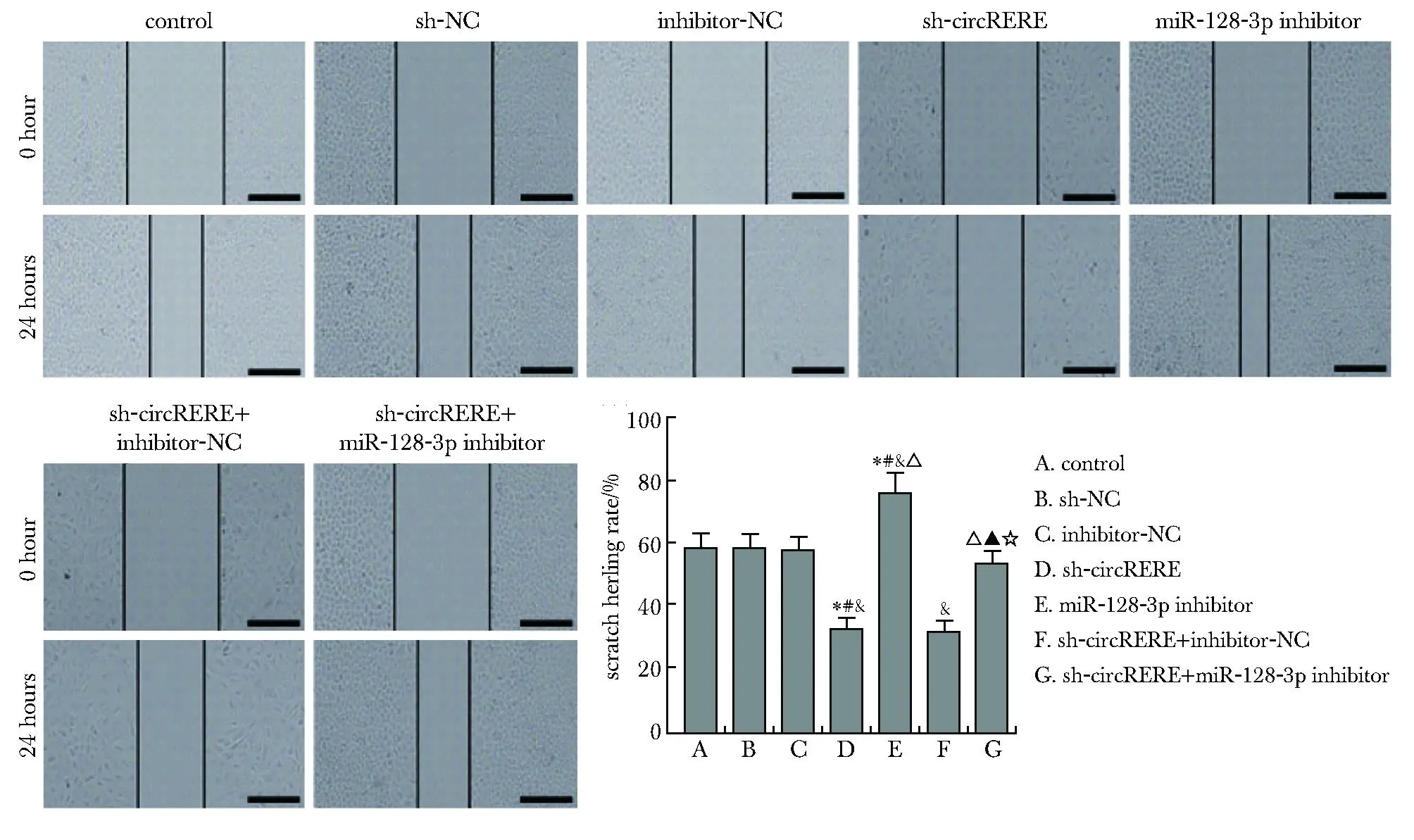
*P<0.05 compared with control group; # P<0.05 compared with sh-NC group; &P<0.05 compared with inhibitor-NC group; △ P<0.05 compared with sh-circRERE group; ▲ P<0.05 compared with miR-128-3p inhibitor group; ☆ P<0.05 compared with sh-circRERE+inhibitor-NC group;Scale bar=200 μm.

*P<0.05 compared with control group; # P<0.05 compared with sh-NC group; &P<0.05 compared with inhibitor-NC group; △ P<0.05 compared with sh-circRERE group; ▲ P<0.05 compared with miR-128-3p inhibitor group; ☆ P<0.05 compared with sh-circRERE+inhibitor-NC group.
2.4 CircRERE/miR-128-3p、miR-128-3p/WEE1靶向关系验证
ENCORI数据库预测miR-128-3p与circRERE、WEE1的结合位点(图6A)。双荧光素酶报告实验中,circRERE-WT+miR-128-3p mimic组与circRERE-WT+mimic-NC组比较,荧光素酶活性下降(P<0.05);WEE1-WT+miR-128-3p mimic组与WEE1-WT+mimic-NC组比较,荧光素酶活性下降(P<0.05)(图6B)。

A.binding sites prediction of miR-128-3p and circRERE or WEE1; B,C.double luciferase experiment confirmed the targeting relationship between miR-128-3p and circRERE(B) or between miR-128-3p and WEE1(C); *P<0.05 compared with mimic-NC.
3 讨论
CircRNA的异常表达在肿瘤的发生和发展中具有重要作用,被认为是MM发病的关键因素[8]。CircRERE在MM组织和细胞中呈高表达,且其能够增强MM细胞对硼替佐米的耐药性,有望成为MM潜在的治疗靶点[3]。在本研究中,circRERE在MM细胞中呈高表达,敲低其表达可降低RPMI-8226细胞的增殖率、划痕愈合率和侵袭细胞数,表明circRERE可能作为一种促癌基因参与MM进展,敲低circRERE可抑制RPMI-8226细胞增殖、迁移和侵袭。
miRNA通过与靶基因mRNA的3’端非编码区结合以使其降解或抑制其翻译,负调控下游靶标的表达,能够影响增殖、凋亡、迁移等过程,与MM的发生发展密切相关[9]。miR-128-3p为miRNA家族一员,在MM中表达下调,上调其表达能够抑制MM进展。在本研究中,miR-128-3p在MM细胞中呈低表达,并且在MM细胞中抑制miR-128-3p表达会刺激细胞增殖、迁移和侵袭,表明miR-128-3p在MM中作为抑癌基因发挥作用。
CircRNA主要通过发挥miRNA海绵的功能来调节基因表达,从而调控肿瘤的生物学过程[10]。Circ_0000190通过调控miR-767-5p/MAPK4轴抑制MM的进展[11];Circ_0007841通过介导miR-129-5p/JAG1轴增加MM细胞对硼替佐米的耐药性[12]。为了探究circRERE在MM中的调控机制,本研究通过生物信息学工具、双荧光素酶报告基因检测筛选并鉴定了circRERE的靶标miRNA。结果显示,miR-128-3p是circRERE的靶标;敲低circRERE表达后RPMI-8226细胞miR-128-3p表达增加,提示circRERE可能通过抑制miR-128-3p表达参与MM进展。在敲低circRERE的同时下调miR-128-3p表达,结果发现,下调miR-128-3p可明显减弱敲低circRERE对RPMI-8226细胞增殖、迁移和侵袭的抑制作用,证实敲低circRERE可上调miR-128-3p表达,从而阻断MM细胞的恶性生物学行为。
WEE1是一个与细胞周期有关的基因,其能够调控G2/M检查点阻滞,为细胞在有丝分裂开始之前的受损DNA修复提供时间和条件,促进包括MM在内的多种癌的进展,为MM潜在的治疗靶点[13]。在本研究中,MM细胞系中WEE1表达的水平显著升高,使用生物信息学分析和双荧光素酶报告实验,WEE1被预测和验证为miR-128-3p的靶标。miR-128-3p能够通过靶向调控WEE1而促进胶质母细胞瘤细胞的生存并增强其对替莫唑胺的耐药性[7]。有报道指出在胃癌中miR-128-3p能够通过调节CLDN18影响胃癌的侵袭和迁移[14]。本研究结果显示,敲低miR-128-3p表达后RPMI-8226细胞WEE1表达增加,而敲低circRERE表达后RPMI-8226细胞miR-128-3p表达增加,WEE1表达减少,表明miR-128-3p可能通过靶向负调控WEE1表达而抑制RPMI-8226细胞增殖、迁移和侵袭。这些提示敲低circRERE可能通过上调miR-128-3p,抑制WEE1表达,促进MM进展。
综上所述,敲低circRERE可能通过靶向上调miR-128-3p、下调WEE1抑制RPMI-8226细胞迁移、侵袭和增殖,为开发MM治疗的有效靶点提供了参考依据。未来可采用更多的细胞系并结合体内实验验证circRERE在MM中的作用与分子机制。

