基于气相色谱-质谱法测定塞来昔布中磺酸酯类基因毒性杂质的残留量
赵晨阳,刘晓梦,邢亮彬,李亚丽,赵立新,艾连峰 ,哈婧
1.河北省药品审评中心,石家庄 050091;2.河北科技大学化学与制药工程学院,石家庄 050018;3.石家庄海关技术中心,石家庄 050051;4.河北医科大学公共卫生学院,石家庄 050017
塞来昔布(celecoxib,CXB),化学名为4-[5-(4-甲苯基)-3-(三氟甲基)-1H-吡唑-1-基]苯磺酰胺,属于解热镇痛抗炎药-非甾体抗炎药(nonsteroidal antiinflammatory drugs,NSAIDs)[1]。作为一种高度选择性的环氧化酶-2(cyclooxygenase-2,COX-2)抑制剂[2],塞来昔布几乎没有胃肠道不良反应[3-4]。因其具有抗炎镇痛等作用,临床上主要用于治疗风湿性关节炎和骨关节炎等疾病[5-8]。
在塞来昔布的工艺合成和纯化过程中,磺酸基团与醇类溶剂共存时有可能生成磺酸酯类基因毒性杂质(genotoxic impurity,GTI),如塞来昔布磺酸甲酯和塞来昔布磺酸乙酯(图1)。基因毒性杂质是指能直接或间接损害DNA,导致基因突变或具有致癌倾向的物质[9-12]。在原料药的生产过程中,所使用的起始物料以及中间体、试剂、溶剂、催化剂、反应中生成的副产物,还有在药物合成和储存过程中产生的降解产物都会造成基因毒性杂质的产生[9]。GTI 在低浓度下即可造成人体遗传物质的损伤,具有致突变性和致癌性,在用药过程中严重威胁到患者的健康[10,13-14]。因此,需要严格控制GTI 在药物中的限度,建立准确可靠的分析检测方法跟踪检测药物的工艺过程,对于保障用药安全具有重大意义。
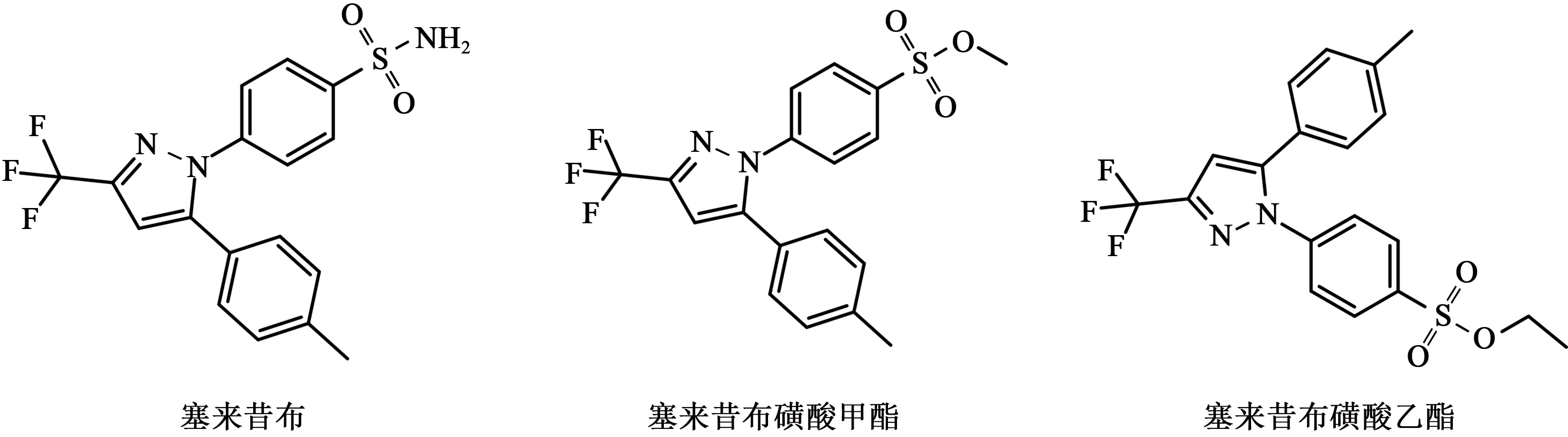
图1 塞来昔布及两种杂质结构式Fig.1 Structural formulae for celecoxib and two impurities
本研究期望通过气相色谱串联质谱(gas chromatograph-mass spectrometer,GC-MS)法 建立测定塞来昔布原料药及其制剂中塞来昔布磺酸甲酯和塞来昔布磺酸乙酯两个磺酸酯类杂质含量的方法,为塞来昔布原料药及其制剂中塞来昔布磺酸甲酯和塞来昔布磺酸乙酯的检测提供指导。
1 材料与方法
1.1 材料
Agilent 7697E+7890A+5975C(美国Agilent 公司)顶空气相色谱质谱联用仪;Vortex genie-2漩涡振荡器(美国Scientific 公司);XSE205DU 电子天平(瑞士梅特勒公司);Milli-Q 超纯水制备仪(美国Millipore公司)。
塞来昔布原料药(石家庄以岭药业股份有限公司,批号:BR21062501、1039171101、1039171102、1039171103);塞来昔布胶囊(石家庄以岭药业股份有限公司,批号:06910;江苏正大清江制药有限公司,批号:210914;辉瑞制药有限公司,批号:DT6150;青岛百洋制药有限公司,批号:211201611);塞来昔布磺酸甲酯(石家庄以岭药业股份有限公司,批号:BR26452801);塞来昔布磺酸乙酯(石家庄以岭药业股份有限公司,批号:BR26452801);无水硫代硫酸钠和碘化钠均为分析纯;乙腈(色谱级,美国Sunrise Chemical 公司);超纯水。
1.2 方法
1.2.1 溶剂的配制 按20∶80(体积比)的比例将水和乙腈混合配制稀释剂,涡旋混匀,使用时现用现配。
衍生试剂的配制:精密称取无水硫代硫酸钠30 mg置于50 mL 棕色容量瓶中,加入适量超纯水溶解。再称取60 g 碘化钠置于同一容量瓶中,加超纯水溶解并稀释至刻度线,摇匀。
标准品储备液的配制:精密称取塞来昔布磺酸甲酯和塞来昔布磺酸乙酯标准品各10 mg,分别置于10 mL 容量瓶中,加入80%乙腈水溶液溶解并定容至刻度线,摇匀,配成1 mg·mL-1的标准品储备液。转移至棕色标准溶液瓶中,放置于4 ℃冰箱避光保存。
标准品溶液的配制:使用时根据需要,将标准品储备液用稀释剂溶液配制成不同浓度的混合标准溶液,精密量取0.5 mL 置于20 mL 顶空瓶中,再加入0.5 mL 衍生试剂,迅速压盖密封,振摇混匀。
供试品溶液的制备:精密称取供试品10 mg,置于20 mL 顶空瓶中,分别加入稀释剂和衍生试剂各0.5 mL,立即压盖密封,摇匀。
加标供试品溶液的制备:称取塞来昔布约10 mg,置于20 mL 顶空瓶中,分别加入所需浓度的标准品溶液和衍生试剂各0.5 mL,立即压盖密封,摇匀。
1.2.2 仪器条件 顶空条件:平衡温度为60 ℃,平衡时间为30 min。
气相色谱条件:色谱柱为Agilent DB-624毛细管色谱柱(60 m×0.25 mm,1.4 μm),高纯氦载气,流速1.2 mL·min-1,进样口温度220 ℃,分流进样方式,分流比为100:1,程序升温:初始柱温40 ℃,保持3 min,以3 ℃·min-1升至80 ℃,再以20 ℃·min-1升至220 ℃,保持2 min,总运行时间为25.333 min。
质谱条件:四级杆温度150 ℃,离子源温度230 ℃,选择离子监测采集模式,溶剂延迟2 min。塞来昔布磺酸甲酯和塞来昔布磺酸乙酯经衍生后得到的衍生产物分别为碘甲烷和碘乙烷。两种目标物质的质谱参数如表1所示。
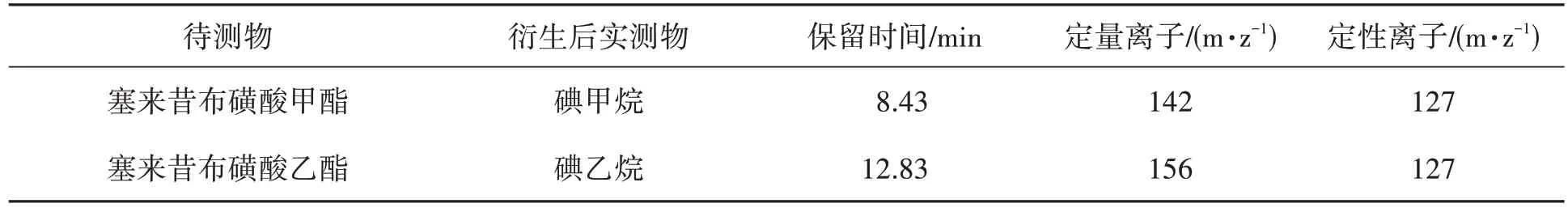
表1 2种目标物质质谱参数Table 1 Mass spectral parameters for two target substances
1.2.3 衍生试剂的选择 为防止直接进样易导致基质污染进样口等问题,可采取衍生化技术提高磺酸酯类的灵敏度和稳定性[15-16]。本实验分别考察了五氟苯硫酚和碘化钠作为衍生试剂的效果。称取12 份塞来昔布原料药,分别置于20 mL 顶空瓶中,其中6 份加入所需浓度的混合标准品溶液和五氟苯硫酚衍生试剂各0.5 mL,另6 份加入所需浓度的混合标准品溶液和碘化钠衍生试剂各0.5 mL,迅速压盖密封,摇匀。
1.2.4 平衡温度的考察 本实验分别考察了平衡温度为30、40、50、60、70 和80 ℃时对测定结果的影响。将相同浓度的标准溶液经碘化钠衍生后,分别在平衡温度为30、40、50、60、70 和80 ℃的条件下上机测定,并记录结果。
1.2.5 平衡时间的考察 本实验分别考察了平衡时间为10、20、30、40 和50 min 时对测定结果的影响。将相同浓度的标准溶液经碘化钠衍生后,分别在平衡时间为10、20、30、40 和50 min 的条件下上机测定,并记录结果。
1.2.6 色谱柱的考察 本实验分别考察了Agilent DB-624 毛细管色谱柱(60 m×0.25 mm,1.4 μm)和Agilent HP-5 毛细管色谱柱(60 m×0.25 mm,1.0 μm)对测定结果的影响。将两个目标物质的标准溶液经碘化钠衍生处理后,分别使用两种色谱柱上机测定。
1.2.7 系统适应性 精密量取6 份混合标准工作液0.5 mL 分别置于20 mL 顶空瓶中,各自加入0.5 mL 衍生试剂,立即压盖密封,摇匀。按1.2.2小节条件顶空进样,每份工作液进样1针,记录衍生产物碘甲烷和碘乙烷的保留时间、峰面积并计算RSD。
1.2.8 专属性 分别配制空白试剂、混合标准限度对照溶液、样品和加标样品溶液按1.2.2 小节条件上机测定,记录色谱图。
1.2.9 基质效应与线性关系 本实验以基质匹配标准溶液10、20、和50 ng·mL-13 个水平的响应值所对应质量浓度的纯溶剂标准溶液的响应值进行比较考察基质效应。若基质效应在80%~120%,表明基质效应不明显;若基质效应<80% 或>120%,表明存在基质抑制或基质增强。
分别配制浓度为10、20、50、100、200 和500 ng·mL-1的塞来昔布磺酸甲酯和塞来昔布磺酸乙酯混合标准工作液,各取0.5 mL 分别置于20 mL 顶空瓶中,各加0.5 mL NaI 衍生试剂,立即压盖密封,上机测定。分别以塞来昔布磺酸甲酯和塞来昔布磺酸乙酯的浓度为横坐标(x),以塞来昔布磺酸甲酯和塞来昔布磺酸乙酯的衍生产物碘甲烷和碘乙烷的峰面积为纵坐标(y),建立标准曲线。
1.2.10 重复性 取6 份同一样品,每份各加0.5 mL 10 ng·mL-1的混合标准工作液,再加0.5 mL衍生试剂,迅速压盖密封,置于顶空进样器中,上机测定,记录目标物质的检测量。
1.2.11 中间精密度 在同一实验室,由不同分析人员在不同时间进行中间精密度试验,考察本方法在上述不同条件下对精密度的影响。取塞来昔布样品,在定量限10 ng·mL-1做样品加标回收实验,平行处理6份。
1.2.12 稳定性 按1.2.1 小节条件分别配制样品溶液、定量限浓度标准品溶液及含有定量限浓度的样品加标溶液,分别在0、2、4、8、12 和24 h 时将各溶液按1.2.2小节条件测定2种目标物质的峰面积并计算RSD值。
1.2.13 耐用性 本实验通过微调色谱条件来考察测得的两个目标物质混合标准溶液浓度的变化,包括改变进样口温度(210、230 ℃)、流速(1.1、1.3 mL·min-1)和起始柱温(35、45 ℃)。配制18 份浓度为20 ng·mL-1的样品加标溶液,每个条件分别进样3份,记录结果。
1.2.14 准确度 称取9 份塞来昔布原料药分别置于20 mL 顶空瓶中,按1.2.1 条件方法制备得到低、中、高3 种不同加标水平的样品加标溶液,浓度分别为10、20和50 ng·mL-1,每个浓度平行制备3 份,按1.2.2 条件上机测定并使用外标法计算目标物质的回收率。
1.2.15 样品测定 将所有塞来昔布原料药及其制剂按1.2.1条件方法制备,每批平行制备3份,按1.2.2条件方法上机测定。
2 结果与分析
2.1 衍生试剂的选择
五氟苯硫酚作为衍生试剂时,两个目标物质的回收率只有60%左右,而碘化钠为衍生试剂时,两个目标物质的回收率均大于80%。因此,本实验选择以碘化钠为衍生试剂,对塞来昔布磺酸甲酯和塞来昔布磺酸乙酯进行衍生生成碘代烷后,经HS-GC-MS 法测定。衍生产物碘甲烷和碘乙烷的质谱图如图2 所示。由质谱图可看出,衍生产物碘甲烷和碘乙烷的监测离子质荷比与分子量相同,且均有特征碎片离子127。
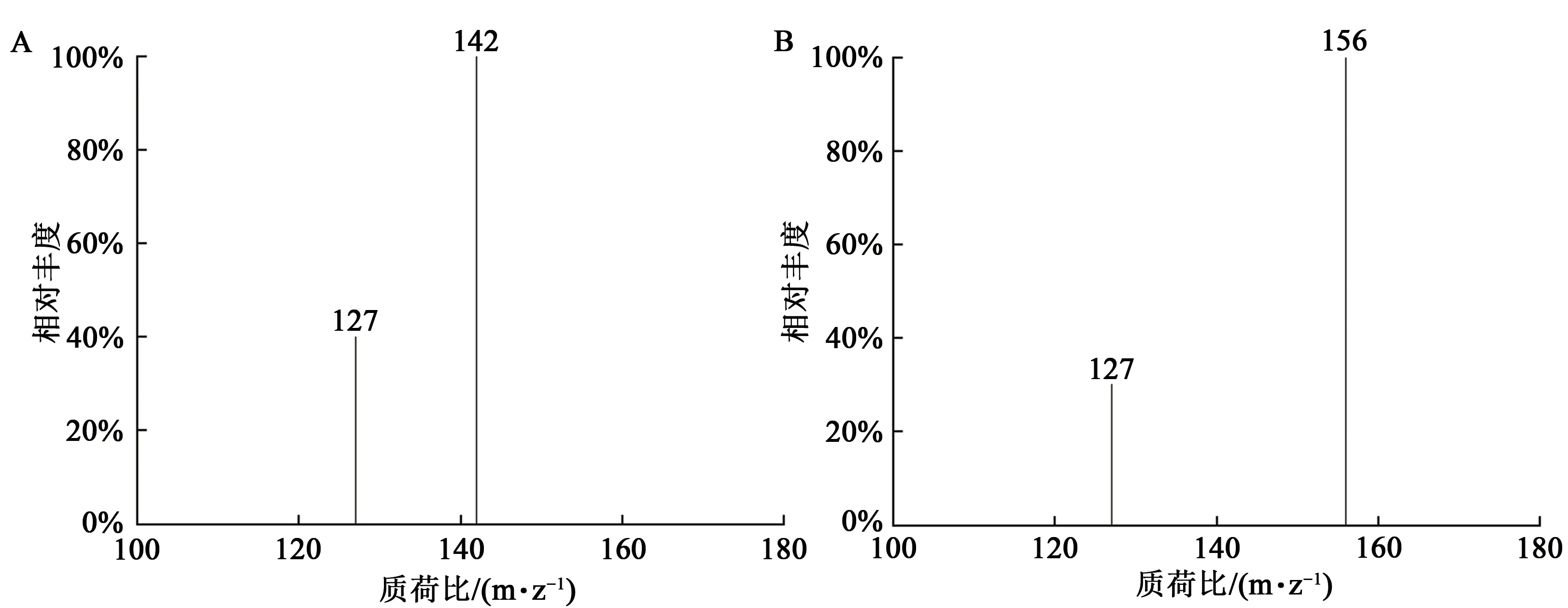
图2 碘甲烷和碘乙烷质谱图Fig.2 Mass spectra of iodomethane and iodoethane
2.2 平衡温度的优化
本实验分别考察了平衡温度为30、40、50、60、70 和80 ℃时对测定结果的影响。结果如图3所示,随着平衡温度的升高,测得目标物质的峰面积也越大。但当平衡温度为70 ℃和80 ℃时,目标物质的峰面积反而降低。因此,本实验选择60 ℃作为平衡温度进行试验。
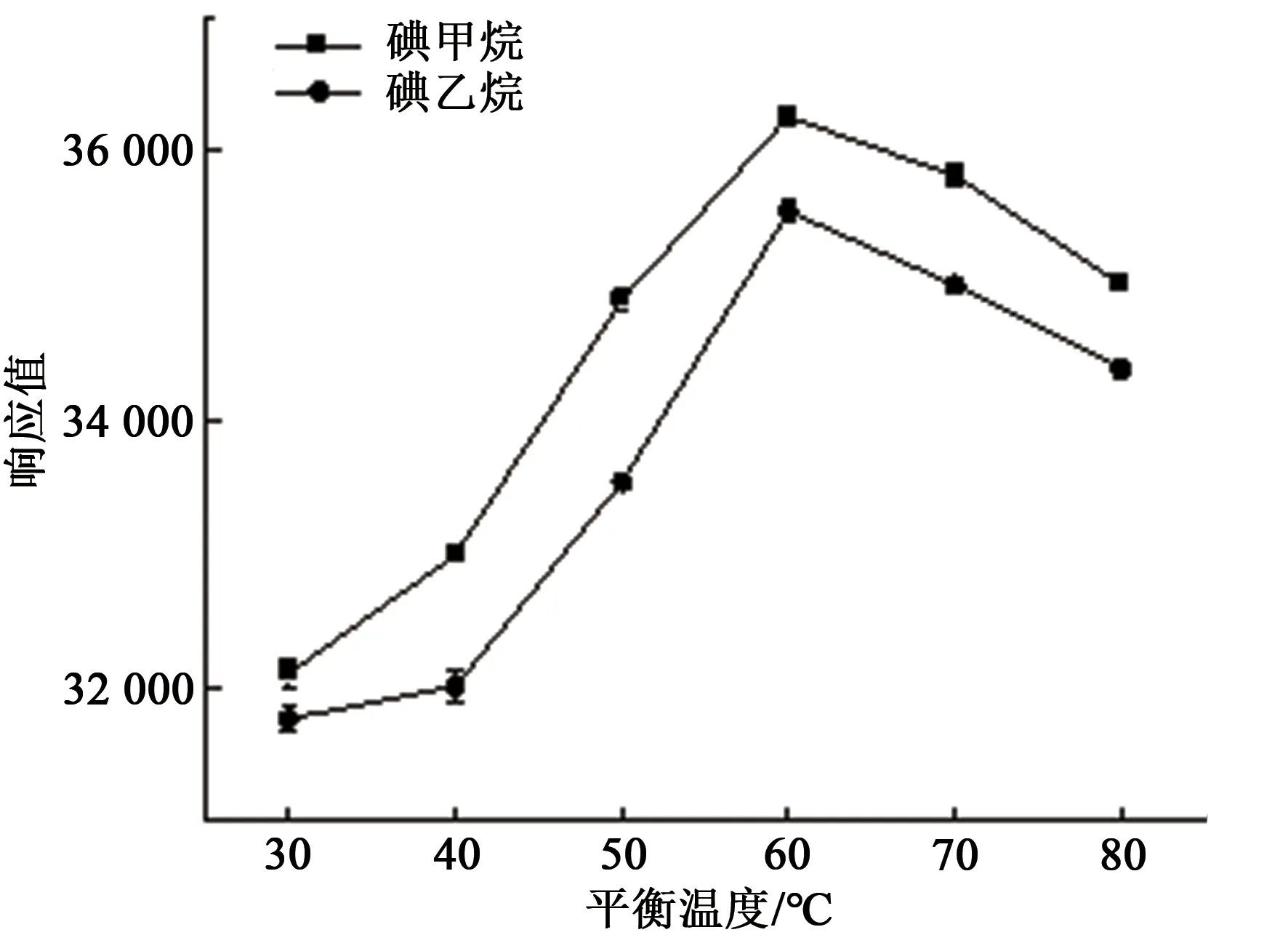
图3 平衡温度对测定的影响Fig.3 Effect of equilibrium temperature on determination
2.3 平衡时间的优化
本实验分别探究了平衡时间为10、20、30、40和50 min 时对测定结果的影响。结果如图4 所示,当平衡时间到达30 min时,目标物质的响应值达到最大,峰面积不再随着平衡时间的延长而增大。因此,本研究选择30 min 作为顶空进样的平衡时间。
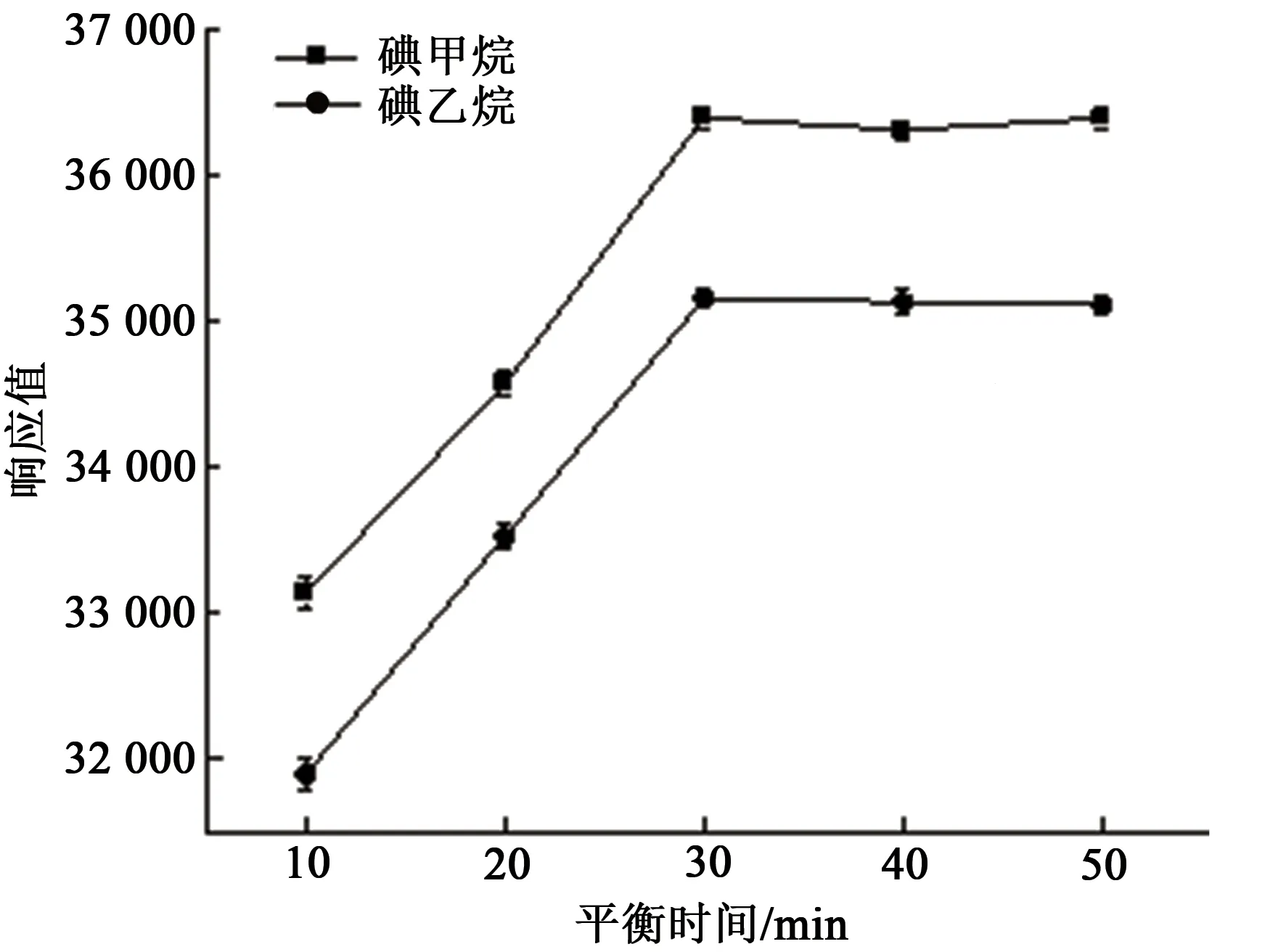
图4 平衡时间对测定的影响Fig.4 Effect of equilibration time on determination
2.4 色谱柱的选择
本实验分别考察了Agilent DB-624 毛细管色谱柱(60 m×0.25 mm,1.4 μm)和Agilent HP-5 毛细管色谱柱(60 m×0.25 mm,1.0 μm)对测定结果的影响。结果发现,衍生产物碘甲烷和碘乙烷在DB-624 毛细管色谱柱上保留较好,且两目标物质之间、两目标物质与溶剂峰之间的分离度均>1.5,表明分离效果好。因此,本研究选择Agilent DB-624 毛细管色谱柱(60 m×0.25 mm,1.4 μm)进行实验。
2.5 系统适应性
在1.2.2 仪器测定条件下,两目标物质保留时间的RSD 分别为0.02%和0.05%(≤2%),峰面积的RSD 分别为4.91%和8.54%(≤10%),均符合要求,表明该方法系统适应性良好。
2.6 专属性试验
专属性的实验结果如图5 所示,衍生产物碘甲烷和碘乙烷的保留时间分别为8.43 和12.83 min,空白溶剂和样品溶液中不存在对目标物质造成干扰的干扰峰,空白溶剂峰也与目标峰完全分离,不干扰碘甲烷的检测,表明该方法专属性良好。

图5 专属性色谱图Fig.5 Proprietary chromatograms
2.7 基质效应和线性关系
基质效应的结果如图6 所示,本实验的基质效应在80%~120%,表明基质效应基本不存在。
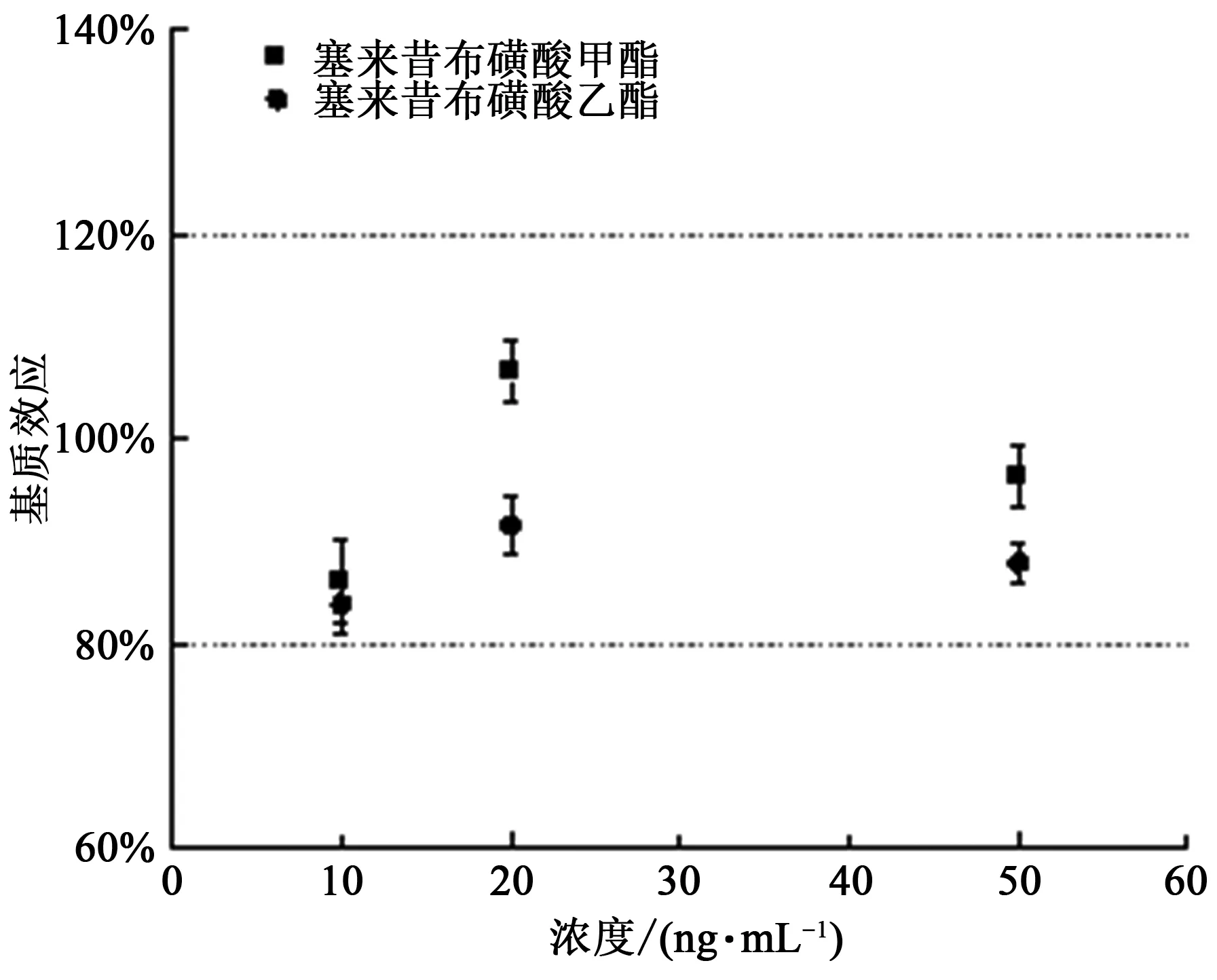
图6 基质效应Fig.6 Matrix effect
线性结果如表2 所示,塞来昔布磺酸甲酯和塞来昔布磺酸乙酯均在10~500 ng·mL-1范围内线性关系良好。采用逐级稀释,以信噪比S/N≥10 的最低浓度作为定量限。按上述条件,测得两个杂质的定量限均为10 ng·mL-1。

表2 2种目标物质的线性结果Table 2 Linear results for two target substances
2.8 重复性试验
6 份样品加标溶液中塞来昔布磺酸甲酯和塞来昔布磺酸乙酯检测量的RSD 分别为8.60%和5.42%(≤10%),表明该方法重复性良好。
2.9 中间精密度试验
6 份样品加标溶液中塞来昔布磺酸甲酯和塞来昔布磺酸乙酯检测量的RSD 分别为7.18%和8.95%(≤10%),表明该方法精密度良好。
2.10 稳定性试验
稳定性结果如表3 所示,标准品溶液和样品加标溶液在24 h 内峰面积的RSD 均小于10%,样品溶液中未检出,表明溶液在24 h 内稳定性良好。
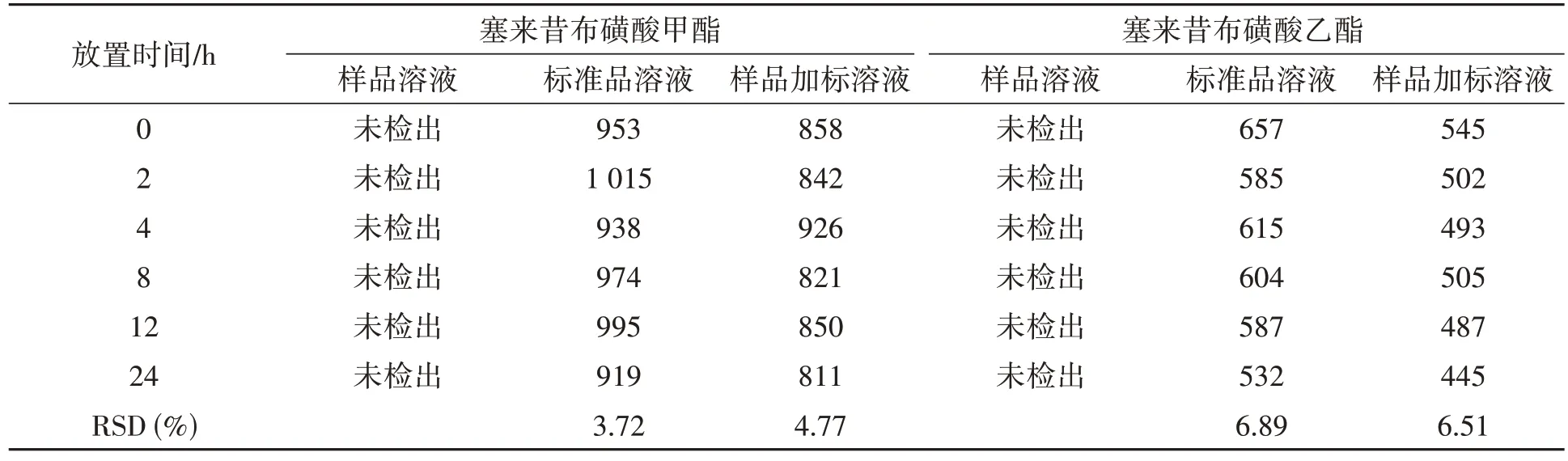
表3 2种目标物质的稳定性试验结果Table 3 Stability test results for two target substances
2.11 耐用性试验
耐用性结果见表4 所示,两个杂质在不同条件下测得浓度的RSD 均小于10%,表明该方法耐用性良好。

表4 耐用性试验结果 (n=3)Table 4 Durability test results (n=3)
2.12 准确度试验
准确度结果见表5 所示,两杂质低、中、高3 种加标水平的回收率均在80.87%~106.52%,RSD 均小于10%,表明该方法的准确度良好。
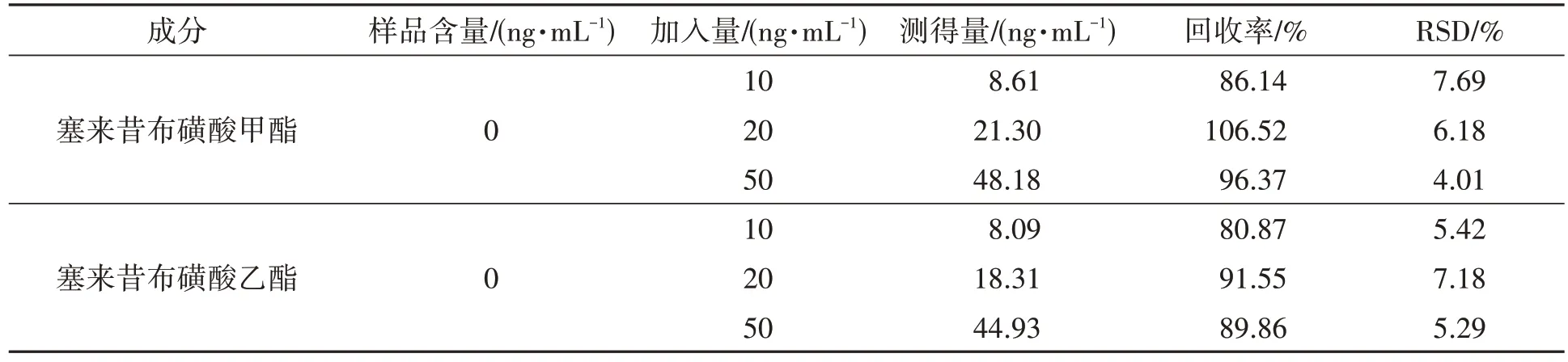
表5 准确度试验结果 (n=3)Table 5 Accuracy test results (n=3)
2.13 样品测定
样品的测定结果显示,所有塞来昔布样品中均未检出塞来昔布磺酸甲酯和塞来昔布磺酸乙酯杂质。
3 讨论
本研究开始时采用的进样方式为直接进样,但是发现两个目标物质均没有出峰,推测可能是直接进样导致塞来昔布磺酸甲酯和塞来昔布磺酸乙酯在进样口发生了高温分解,从而对实验造成了干扰[17],因此采用顶空进样来进行试验。与直接进样相比,顶空进样不需要复杂的前处理步骤,不存在高浓度的样品污染进样口等问题[18]。
欧洲药典(European Pharmacopoeia,EP)[19]中经过碘化钠衍生后,采用顶空GC-MS 法检测几种原料药中磺酸酯类基因毒性杂质。本试验经过比较,最终选择了碘化钠作为衍生试剂,该方法操作简便、干扰小、通适性强。
在不同结构的基因毒性杂质中,每人可接受限度“毒理学关注阈值”(threshold of toxicological concern,TTC)为1.5 μg·d-1[20-22]。基因毒性杂质的结构相似时,可能具有相同的作用模式,因此该类基因毒性杂质的总量应小于1.5 μg·d-1。塞来昔布磺酸甲酯和塞来昔布磺酸乙酯的结构相似,所以两者的TTC 均应小于0.75 μg·d-1。塞来昔布的最大日服用量为600 mg,因此,塞来昔布磺酸甲酯和塞来昔布磺酸乙酯的限度为1.25 μg·g-1。在本实验条件下,两杂质的标准限度对照溶液应不超过12.5 ng·mL-1。因此,本实验制定的标准限度对照溶液浓度为10 ng·mL-1,可满足塞来昔布中塞来昔布磺酸甲酯和塞来昔布磺酸乙酯1.25 μg·g-1的灵敏度。
本研究采用衍生化技术与GC-MS 法相结合测定塞来昔布中的塞来昔布磺酸甲酯和塞来昔布磺酸乙酯,并将该方法成功运用于实际样品。在实验过程中,该方法的线性范围、定量限和准确度均可满足实际检测需要。以顶空进样,避免了高浓度的样品污染进样口等问题,且前处理方便快捷、重现性好,可为药品监督管理部门修订塞来昔布原料药及制剂质量标准提供借鉴,使塞来昔布原料药及制剂质量标准更符合实际。目前,基因毒性杂质问题频发,磺酸酯类基因毒性杂质相关分析的研究也有一定的进展,但也存在一定的缺陷,如测定的磺酸酯类基因毒性杂质较为单一。因此,未来需要将更多的磺酸酯类基因毒性杂质列入未来的研究计划中。

