人呼吸道合胞病毒感染的预防和治疗研究进展
吕娜 ,李岩异 ,马祝青
1.华北制药金坦生物技术股份有限公司,石家庄 050035 2.山东博安生物技术股份有限公司,山东 烟台 264003
随着新型冠状病毒的大流行,人们对与呼吸道相关病毒引发疾病的发病率和死亡率越来越关注。呼吸道合胞病毒(respiratory syncytial virus,RSV)感染人类模式 U 形年龄曲线显示,发病率峰值人群为年龄小于5岁的婴幼儿及65岁以上老年人[1]。在全球范围内,RSV每年导致约300万名5岁以下儿童住院,约6万人在院内死亡。而在美国,RSV 是导致1 岁以下婴儿住院的主要原因;每年因RSV 住院的17.7 万老年人中,有1.4 万人死亡[2]。儿童期感染RSV 可能在以后的生活中引发持续性或复发性喘息和哮喘,由此成为慢性疾病[3-4]。目前,用于治疗或预防RSV 感染的特异性和非特异性方法很少。本文综述了当前临床上可用的RSV 感染的治疗方法和预防药物,包括最新的疫苗研发进展,以期为RSV 的预防和临床治疗研究提供参考。
1 特异性抗呼吸道合胞病毒感染疗法
RSV 是一种线性单链RNA 病毒,为副粘病毒,编码10 种蛋白质,该病毒有两种跨膜糖蛋白参与病毒进入细胞,即附着蛋白(G)和融合糖蛋白(F)。F 蛋白通过构象变化可以介导病毒包膜和宿主细胞的融合,诱导产生特征合胞体[5]。F蛋白以两种形式存在:一种是高度稳定的融合后(post-F)形式,另一种是不稳定的融合前(pre-F)形式。在感染期间,当病毒和宿主细胞聚集在一起时,这种蛋白质呈现pre-F 形式,一旦感染发生,这种蛋白质就转变为更加稳定的post-F 形式[6]。RSV 潜伏期通常为2~8 天,最初感染上呼吸道(upper respiratory tract infection,URTI),如果治疗不及时或选择错误的治疗方法,就有可能继发下呼吸道感染(lower respiratory tract infection,LRTI),对于健康的儿童来说,RSV 感染通常是一种自限性疾病,因此,支持治疗是治疗的基本方法。RSV 特异性治疗已被证明对特定的儿科人群(如骨髓和肺移植受者)有益,这些治疗措施的最终目标是缓解症状,减少疾病的持续时间和严重程度,并降低传播风险。常规的治疗剂主要包括帕利珠单抗(palivizumab)、莫维珠单抗(MEDI-524)、Clesrovimab、尼塞韦单抗(nirsevimab)、免疫球蛋白(RSV-immune globulin intravenous,RSV-IGIV)和利巴韦林(ribavirin)。
1.1 帕利珠单抗
帕利珠单抗是人源化小鼠单克隆抗体(mAb),能与RSV 融合蛋白(F)的抗原位点Ⅱ结合,并抑制随后的病毒感染。1998 年,帕利珠单抗被批准用于预防特定高危人群的严重 RSV 感染,但至今未在国内获批。在某些高危婴儿亚组中,帕利珠单抗预防因RSV 感染住院的有效率高达 80%[7]。但是,帕利珠单抗价格昂贵,并且由于半衰期相对较短(约20天),需要在易感染RSV 的季节每月肌内注射5 次,因此未获得广泛应用。在一项双盲临床对照试验中,420 名既往健康的RSV细支气管炎婴儿被随机分配到帕利珠单抗组(15 mg·kg-1体重)或安慰剂。结果显示两组在再入院率、住院持续时间上未表现出统计学差异[8]。
1.2 莫维珠单抗
莫维珠单抗是帕利珠单抗的第二代人源化抗RSV 单克隆抗体,它突变了位于抗体CDR 序列可变区域的13 个特异性氨基酸残基,从而将其亲和力和中和能力分别提高了70 和100 倍[9]。为了随机研究莫维珠单抗对 RSV 阳性儿童患者的影响,在多中心随机对照试验中,将受试者分为3个组:莫维珠单抗30 mg·kg-1、100 mg·kg-1和安慰剂组。12个月的随访结果显示,3组受试者在住院时间、疾病严重程度或喘息发作方面没有统计学差异[10]。
1.3 Clesrovimab (MK1654)
Clesrovimab 是一种半衰期延长的RSV 中和单克隆抗体,目前处于临床研究阶段,它针对以pre-F 和post-F 形式存在的抗原部位Ⅳ。Plock等[11]通过将流行病学数据拟合到恒定基线值的高斯函数,创建了感染力(force of infection,FOI)函数来描述 RSV 暴露程度随时间的变化情况,利用荟萃分析进行临床模拟试验,以预测温带和热带地区 RSV 引起下呼吸道感染的季节性发病率(incidence rate,IR)以及Clesrovimab 剂量的有效性。临床模拟试验表明,热带和温带气候的预测结果一致,Clesrovimab 在热带气候地区 RSV 易感季节开始时使用,预计能在150 天内保持预防RSV 下呼吸道感染疾病的高功效(>75%)。
1.4 尼塞韦单抗
尼塞韦单抗是一种高效的人中和 IgG1К单克隆抗体,能与pro-F 形式的抗原表位 Ø 中的高度保守表位结合。由于IgG 重链(YTE 技术)FC区域中的3个氨基酸被取代,改善了其抗降解性能,从而延长了抗体在血清中的半衰期(平均半衰期为85~117天)[12]。尼塞韦单抗的推荐剂量为:体重<5 kg的婴儿,50 mg肌内注射;体重≥5 kg的婴儿,100 mg肌内注射,并且应在RSV易染季节开始之前给药,对于在RSV 感染季节出生的婴儿,应在出生时给药。在一项针对32~35 周健康早产儿的 1b/2a 期剂量范围(10、25和50 mg 尼塞韦单抗或安慰剂)研究中,90%注射过尼塞韦单抗的婴儿血清 RSV 中和抗体水平比对照组增加了4 倍[13]。有试验还显示抗体的半衰期可以持续保护5个月[14],并且与安慰剂(生理盐水)对照组相比,尼塞韦单抗显著降低了RSV 感染的就诊率和住院率,分别降低了70.1%和78.4%[15]。获批的尼塞韦单抗Beyfortus可广泛应用于婴儿人群,包括足月或早产的健康婴儿,或健康状况特殊的婴儿。
1.5 免疫球蛋白(RSV-IVIG)
免疫球蛋白是针对急性RSV 感染的治疗药物,在动物模型中静脉注射多克隆免疫球蛋白对RSV 具有很强的中和作用。RSV 在肺部的复制减少,从而降低了病毒载量并降低了随后发生呼吸道疾病的风险[16]。一项双盲随机对照试验评估了RSV-IGIV 在治疗“高风险”人群RSV 感染中的作用,试验包括107 名2 岁以下的早产儿、先天性心脏病或慢性肺病儿童,积极治疗组的患者给予1 500 mg·kg-1的RSV-IVIG,对照组为安慰剂,两组的住院时间或疾病严重程度均无差异[17]。2019 年,Sanders 等[18]的评价研究纳入了7 项试验,涉及486例RSV 细支气管炎婴儿,但结论是没有足够的证据表明免疫球蛋白疗效与安慰剂之间存在差异。2003 年,当出现其他的替代品时,RSV-IGIV则不再用于RSV感染的治疗[19]。
1.6 利巴韦林
利巴韦林是一种嘌呤核苷酸类似物,对多种DNA 和RNA 病毒感染有效。已有研究认为当利巴韦林进入被病毒感染的细胞后能够迅速磷酸化,通过多种途径发挥作用,例如干扰病毒的三磷酸鸟苷合成、抑制病毒mRNA合成、抑制病毒依赖的RNA的RNA聚合酶。利巴韦林有雾化剂、口服剂和静脉注射3种剂型。有研究表明,其对动物有致畸作用,兔子和大鼠的致畸剂量为1 mg·kg-1,无致畸作用的安全剂量为 0.3 mg·kg-1,调整后成人安全剂量相当于0.05 mg·kg-1[20]。尽管在利巴韦林暴露的卫生保健工作者后代中未观察到致畸作用,但雾化引起的利巴韦林暴露仍然是一个值得关注的问题[21]。
有研究探讨了肺移植受者感染RSV 后口服利巴韦林的效果,52 名肺移植受者利巴韦林静脉注射剂量为33 mg·kg-1(分3 剂),另外21 名患者接受口服利巴韦林(20 mg·kg-1,分两次服用)持续 6~31 天,中位持续时间为 11 天。结果提示利巴韦林用于治疗肺移植后的RSV 感染,口服可能是静脉注射的有效替代[22]。此外,荟萃分析和系统评价显示,接受利巴韦林治疗的血液病患者的死亡率在统计学上显著降低[23]。口服利巴韦林具有良好的病毒清除率,与雾化形式相比,口服利巴韦林是一种安全、简单且成本较低的替代方式。
然而,由于利巴韦林潜在的不良反应,目前不推荐用于儿童。鉴于其在严重免疫功能低下患者中疗效良好,利巴韦林在这些人群中的临床应用值得推荐。此外,其他抗病毒药物正在进行随机对照试验,例如 RV521[24]和AK0529(ziresovir)[25],这两种药物作用机制主要是抑制RSV 和宿主细胞的融合或病毒的复制。
2 非特异性抗呼吸道合胞病毒治疗
RSV 感染后在呼吸道内壁(从鼻咽到远端肺泡)的黏膜中复制,在儿童中,特别是婴儿和学龄前儿童,病毒对下呼吸道的影响更为突出,这是由于成人呼吸细支气管的平均直径约为 250 μm,而4 个月婴儿的平均直径仅为120 μm[26],使得婴儿的细支气管管腔在病毒感染期间更容易被堵塞。肺部的这些物理特性与正在发育的免疫系统,使婴儿更容易发生临床症状的细支气管炎。对抗RSV 感染的非特异性疗法中最常用的是粘液溶解剂[27]、支气管扩张剂[28]和抗炎剂[29]等,这些药物能够逆转气道阻塞,缓解RSV 感染后的症状。
2.1 白三烯受体拮抗剂
白三烯能触发RSV 引起的支气管高反应和黏液分泌过多,并且白三烯可通过与支气管平滑肌的相互作用诱导支气管收缩[30]。在1 项纳入了5项随机试验的评价研究中,对年龄<24 个月因细支气管炎住院的患者(共1 296名婴儿),检测了白三烯受体拮抗剂相关数据,无法得出使用白三烯受体拮抗剂能使住院时间缩短或减轻临床严重程度的结论[31]。因此,在进一步试验之前,不提倡使用白三烯受体拮抗剂治疗RSV 感染。
2.2 人重组核酸酶
RSV 细支气管炎的粘液中含有大量细胞外DNA,这是白细胞招募和降解后形成的[32]。由于人类重组核酸酶(hrDNase)不仅能够切割细胞外DNA,而且能明显降低粘液粘度,因此hrDNase 被用于治疗细支气管炎。有研究和病例报告显示,患有严重疾病的婴儿因细支气管炎而导致的肺不张使用hrDNase 后有所改善[33]。但是,最大的随机、双盲、对照试验涉及225 名患有细支气管炎的住院婴儿,未能证明hrDNase 治疗后住院时间或补充氧气时间有任何统计学差异[34]。2012 年,Annabelle 等[35]发现给予rhDNase 并没有减少患有RSV细支气管炎的氧气依赖婴儿的住院时间或补充氧气的持续时间。但是,在常规治疗方案失败时,可以考虑将雾化hrDNase 用于与细支气管炎相关的严重不溶性肺不张症。
2.3 支气管扩张剂
对患有细支气管炎的婴儿进行听诊时,可能会听到喘息声,并且伴有特征性的呼气期延长的湿啰音。沙丁胺醇是一种β-2 肾上腺素能激动剂,可松弛气道平滑肌并缓解阻塞。早期的综合分析表明,在某些轻度或中度RSV 病例中,使用这些药物短期内症状有所改善[36]。但2014年Gadomski 等[28]荟萃分析了30 项研究,包括1 992 例毛细支气管炎婴儿,结果显示使用支气管扩张剂和安慰剂在血氧饱和度、入院率或住院时间方面无显著差异。此外,β-2 肾上腺素能激动剂有一定的不良反应,包括引起心动过速、血氧饱和度下降、震颤和电解质异常等。因此,不推荐将支气管扩张剂作为毛细支气管炎的常规治疗选择,不建议常规使用支气管扩张剂作为细支气管炎的治疗选择,但可以尝试评估以喘息为主的婴儿的反应用于评估响应的功能。尽管缺乏这方面的数据,但RSV 感染的表现和症状的异质性已得到广泛认可,并且根据临床表型对某些患者亚组选择使用支气管扩张剂可能是未来有针对性的随机临床试验的起点[37]。
2.4 N-乙酰半胱氨酸(N-acetylcysteine,NAC)
NAC 既可以切割粘蛋白二硫键,又具有额外的抗氧化作用,所以可用于毛细支气管炎的治疗[38]。在RSV感染的肺泡Ⅱ型上皮细胞的体外感染模型中,NAC 可抑制粘蛋白合成并减少促炎原基质介质的产生[39]。文献检索显示,仅有1项纳入100例婴儿的随机对照研究,比较了雾化吸入NAC与雾化吸入沙丁胺醇的效果,结果显示症状评分或入院时间没有改善[40]。因此,在考虑将NAC 作为RSV感染的治疗方法之前,仍需要进一步研究。
2.5 糖皮质激素
有研究表明,糖皮质激素在RSV 感染中具有有限的抗炎特性[41]。2013年,Fernandes 等[42]评价了17 项对照研究,纳入了2 596 例毛细支气管炎婴儿,结果显示类固醇治疗不会影响毛细支气管炎入院婴儿和儿童的临床病程,不推荐将其用于治疗其他方面健康、不通气患者的毛细支气管炎。然而,在某些情况下,RSV感染的婴儿可能受益于类固醇,例如患有潜在支气管肺发育不良和哮喘的婴儿。一项纳入200 例毛细支气管炎入院婴儿的试验发现,地塞米松可缩短具有一级亲属湿疹或哮喘家族史患者的住院时间[43]。以上研究表明,糖皮质激素在成为标准化方法之前,还需要进一步的试验验证。
2.6 雾化吸入高渗盐水
雾化吸入高渗盐水可增加健康受试者、哮喘患者[44]、支气管扩张患者[45]和囊性纤维化患者[46]的粘液纤毛清除率。高渗盐水通过产生渗透梯度,将水从黏膜和黏膜下层吸入黏膜层,从而有可能减少气道水肿[47-48]。黏液层的水合作用有助于调动分泌物,当与有效咳嗽的刺激相结合时,可缓解气道阻塞[49]。尽管存在这些机制联系,但临床评估和计算机化声学气流技术均未显示给予3%高渗盐水可改善喘息或气流[50]。高渗盐水治疗病毒性细支气管炎的临床试验效果也不理想,大多数临床试验显示,当检查住院时间和症状评分时,3%高渗盐水能够适度缓解症状[51]。2017 年,Zhang 等[52]荟萃分析纳入了28 项试验,共纳入4 195 例急性细支气管炎婴儿,结果似乎有利于3%高渗盐水可以适度缩短住院时间。然而,随后的随机临床试验也未能证明3%高渗盐水与标准支持治疗相比有任何益处[53-54]。因此,雾化吸入高渗盐水仍然不是RSV 细支气管炎的标准治疗方法。
2.7 其他疗法
针对急性RSV 感染还有许多其他非特异性疗法,包括肾上腺素[55]和抗生素,例如阿奇霉素[56]以及上述药物的各种组合[57]。例如,雾化吸入肾上腺素与3%高渗盐水的联合使用在改善临床严重程度评分方面能够取得较好的结果[58]。然而,在推荐将其作为治疗药物之前,必须进行进一步的试验来重现这些结果。
一氧化氮(iNO)具有抗菌、抗病毒和抗炎特性,以及支气管扩张作用,高剂量吸入一氧化氮(iNO)也被推荐作为针对细支气管炎的非特异性疗法。一项小型试验纳入了89 例毛细支气管炎的住院婴儿,每日检查4 次,以150 μg·L-1的比例给予iNO 治疗,持续5 d,结果显示,与对照组相比毛细支气管炎住院婴儿耐受性好,临床改善时间缩短[59]。尽管如此,目前尚无推荐iNO 作为急性RSV感染的非特异性疗法。
3 呼吸道合胞病毒疫苗研究进展
保护高危人群免受严重RSV 感染的有效疫苗是必不可少的。在19世纪60年代,福尔马林灭活RSV 疫苗用于婴儿的临床试验加重了RSV 疾病,并最终导致两名婴儿死亡[60]。这种情况的发生可能与疫苗诱导的细支气管中免疫复合物的积累有关,疫苗诱导产生的抗体中和活性较弱,导致细胞免疫应答中Th2CD4+T 细胞受损[61-62]。目前,已有两种疫苗用于60 岁及以上人群预防RSV 引起的下呼吸道疾病,全球正在研发几十种疫苗来预防RSV 感染,它们主要包括减毒活疫苗(live attenuated vaccine,LAV)、亚单位疫苗和基于载体的疫苗。无论何种类型,RSV 疫苗设计的最基本原则始终遵循RSV 中和抗体需要以最合理的方式引入气道黏膜[63]。表1 列出了一些处于临床阶段的疫苗和相关信息。
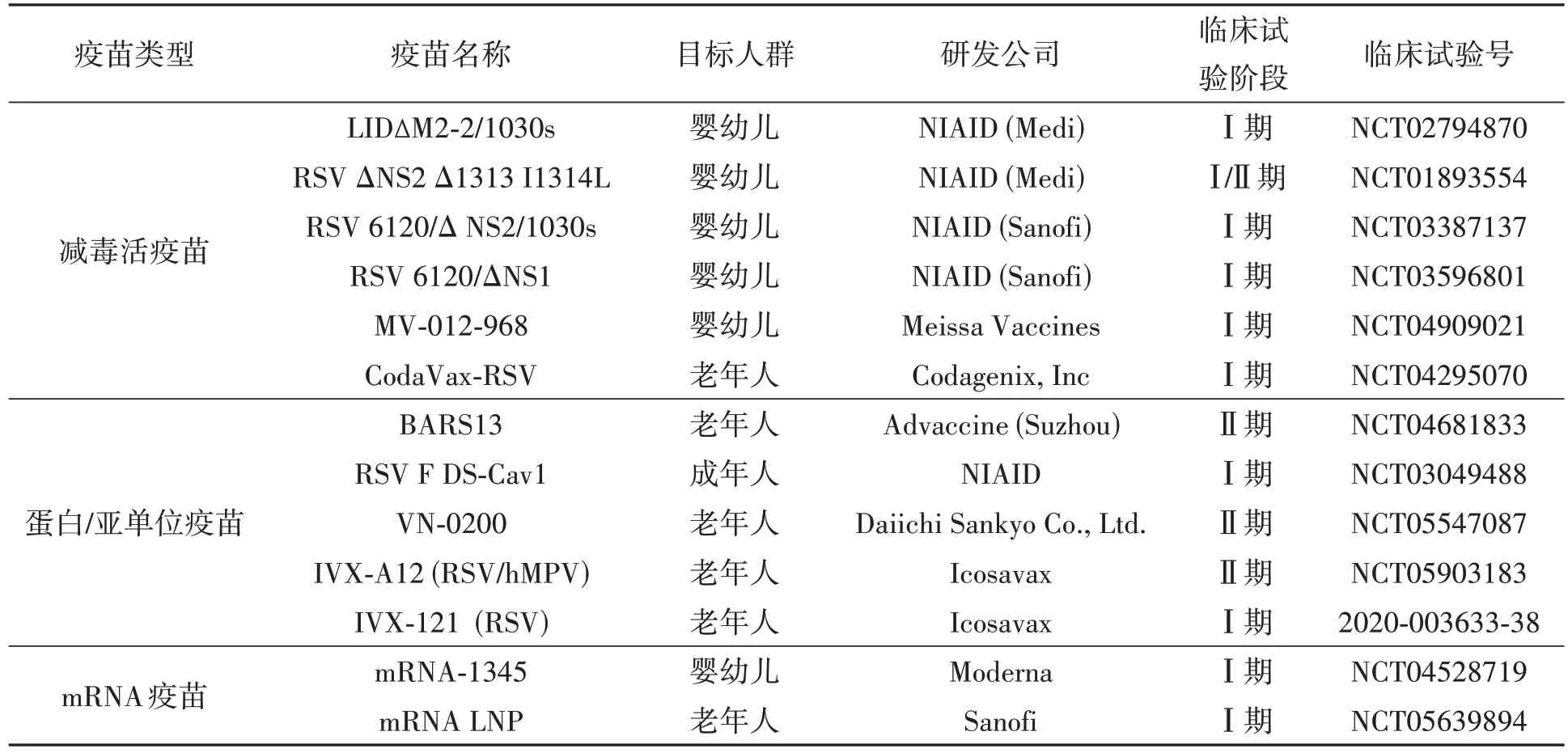
表1 处于临床试验阶段hRSV疫苗Table 1 The hRSV vaccines in clinical development
3.1 减毒活疫苗
减毒活疫苗的基本目标之一是通过传统方法(如加热或化学处理)或反向遗传技术限制RSV在受种者体内的复制,这类疫苗的主要挑战是在安全性(减毒)和产生强烈的免疫反应之间取得有利的平衡[64]。目前,美国临床试验注册库显示大约有15项正在进行的RSV 减毒活疫苗临床试验,这些疫苗中大多数通过M2、NS2/NS1 和L 基因的突变或剔除产生的基因来减毒。在L 基因上携带两个位点突变,例如LIDΔM2-2/1030s,其比母体疫苗具有更好的减毒效果和更高的RSV 中和抗体滴度[65]。基于NS2/NS1 缺失的疫苗,如RSV ΔNS2 Δ1313 I1314L、RSV 6120/Δ NS2/1030s 和RSV 6120/ΔNS1,正在接受临床评估。Meissa Vaccines通过优化NS2、NS1和G基因的密码子以及剔除SH基因来生产MV-012-968,SH基因已被证实在棉鼠模型中具有很强的保护作用[66]。最近,Jenkins等[67]通过引入两种修饰来设计并生产减毒活RSV候选疫苗rgRSV-L(G1857A-G(L208A),一种是L蛋白的衰减突变,另一种是G糖蛋白的突变。前一种突变在Vero细胞培养中没有抑制病毒的产生,但大大减少了病毒在人支气管上皮中的传播,后一种突变减少了疫苗病毒在Vero 细胞中的裂解,从而提高了产量,降低了生产成本。在接受该候选疫苗接种的棉鼠中,即使在105个PFU剂量下也检测不到RSV 复制,并且在接种500 PFU 疫苗病毒后足以完全预防RSV A2 感染,提示rgRSV-L 是RSV减毒活疫苗的潜在候选者。
3.2 亚单位/蛋白疫苗
亚单位/蛋白疫苗一般由纯化的病毒蛋白和佐剂蛋白组成,在RSVpre-F 的结构被解析清楚以前,大多以post-F 为基础制备疫苗,但并未获得成功。葛兰素史克已获批的3844766A疫苗由pref-F糖蛋白(RSVPreF3)与GSK 专有的佐剂AS01 组合而成[68]。辉瑞获批的二价呼吸道合胞病毒(RSV)疫苗ABRYSVO(RSVpreF,PF-06928316),是由等量的来自A 病毒株和B 病毒株的RSV pro-F 蛋白组成[69]。诺华RSV F蛋白纳米颗粒主要基于融合后的F构象,可以和抗原性位点Ⅱ结合,但在其Ⅲ期临床试验中,它未能保护接种疫苗的新生儿[70]。促成这一临床结果的原因之一可能是融合后构象不能像融合前构象那样引发产生更广泛的中和抗体[71]。BARS13 基于G 蛋白开发的蛋白质疫苗,目前正在对其在老年人中的安全性和有效性进行Ⅰ期临床评估(NCT04681833)。最近,Swanson 等[72]将RSV pre-F 蛋白融合成自组装的铁蛋白纳米颗粒,用聚糖修饰以覆盖非中和或中和性差的表位,每个优化的pre-F-NP 都含有8 个pre-F 蛋白。Pre-F-NP 诱导了持续的Pre-F 特异性抗体,并在小鼠和非人灵长类动物模型中产生了有效的中和抗体反应。与前F 三聚体DS-Cav1 相比,前F-NP刺激了更强的抗体反应。这些结果激励了纳米RSV疫苗的持续开发。
3.3 mRNA疫苗
mRNA 疫苗不仅可以免除发酵、纯化疫苗蛋白质/亚单位等步骤,而且还可能防止载体疫苗引发的抗载体免疫反应。mRNA 疫苗也可以同时诱导强烈的体液和细胞免疫反应。数据表明,包封在脂质纳米颗粒(mRNA/LNP)中的mRNA 在体外预防RSV 疾病可能安全有效[73]。mRNA-1345 由Moderna 开发,编码一种预融合F 糖蛋白,该公司正在进行一项Ⅰ期临床研究,以评估年轻人、育龄妇女、老年人和血清阳性儿童的耐受性和反应性。临床Ⅰ期中期结果显示,100 μg 剂量下无不良事件,该疫苗第1 个月产生的RSV 中和抗体是对照组的21倍以上[74]。
4 展望
在过去的十年中,人们对RSV 分子和结构生物学的认识以及人类对RSV 的免疫反应的研究取得了重大进展。一般来说,针对任何呼吸道病毒的具体疗法都很有限,因此预防是主要手段,未来的疫苗、长效单克隆抗体是RSV 感染预防治疗的热点。
疫苗是降低与呼吸道合胞病毒相关疾病的发病率和死亡率的最佳选择。目前,已有两种RSV疫苗获批,但都是用于老年人,用于孕妇和婴幼儿的疫苗尚处于临床研究阶段。国内RSV疫苗的开发也取得了一些进展,其中,艾棣维欣的ADV110 已进行至Ⅱ期临床试验,优锐医药从Bavarian Nordic 引进的MVA-BN RSV 疫苗(病毒载体疫苗)已在国内获批临床试验,相信在不远的未来,随着这些疫苗的获批和使用,RSV 病毒在全球内的感染及危害会逐渐降低。

