mRNA药物的结构和临床应用
常东峰,孙召朋
石药集团巨石生物有限责任公司,石家庄 050015
遗传信息存在于细胞核内染色体的DNA 中,直接决定了蛋白质的合成与表达。信使RNA(messager RNA,mRNA)将DNA 上的遗传信息传递出细胞核,在细胞质中的核糖体上将DNA 遗传信息翻译合成蛋白质[1]。
mRNA 药物是一种整合分子生物学和免疫学的新型先进技术,属于精准医学的应用。mRNA的药学概念是编码mRNA的遗传信息通过非病毒递送途径转入细胞质中,携带的遗传信息可以满足所有功能蛋白的编码和表达,通过蛋白质发挥治疗作用,其中的功能性活性成分为mRNA分子。1990 年mRNA 首次完成药物的概念验证[2]。mRNA 在疫苗方面显示出诸多优势,如自带佐剂特性使得不需额外的佐剂即可刺激机体产生强大而持久的免疫反应[3];体外转录(in vitro transcription,IVT)使mRNA 的生产成本较低,便于快速大规模生产,如新型冠状病毒(以下简称新冠病毒)大流行期间mRNA 疫苗的迅速应用[4-5];mRNA 不需进入细胞核内,在细胞基质中即可行使功能,避免了因整合宿主基因组导致的突变[6];能够避免菌株、毒株难以获取的问题。在作为治疗性药物应用时,缺乏CpG 岛结构使mRNA 诱导机体产生排斥反应的可能性也较小[7];mRNA 较短的分子寿命和内源性物质组成使机体易于将其代谢分解而不会给机体造成较大负担[1],与传统的蛋白质/肽类药物相比,mRNA 能够连续翻译成编码的蛋白质/肽,从而引发长时间的表达,因此在以蛋白质表达为手段的疾病治疗方面具有广阔的应用前景和较好的疗效[8]。2020 年,基于脂质体包裹的mRNA 疫苗(mRNA-1273 和BNT162b2)在缓解新型冠状病毒症状方面,有效性超过90%[9]。2023年,国家药品监督管理局批准石药集团新型冠状病毒mRNA疫苗(SYS6006)纳入紧急使用。
了解mRNA的分子结构将有助于解析药物功能,帮助设计药物,解决mRNA的不稳定性和不可成药性等问题,临床应用将为药物的发展提供方向和思路。
1 mRNA一级结构元件
基于mRNA的药物通过增加mRNA分子核苷修饰和结构元件等来影响免疫反应的强度和特异性。结构元件如帽子结构(Cap)、Poly(A)尾和非翻译区(UTRs)能够直接影响mRNA的稳定性和翻译效率[10],尤其是位于mRNA 5′和3′末端的Cap和Poly(A)尾对于mRNA 在细胞质中的稳定性至关重要。mRNA 还需要开放阅读框(open reading frame,ORF)周围的5′UTRs和3′UTRs来增加半衰期、表达水平和翻译效率[11]。Poly(A)尾的长度与翻译效率相关[12]。此外,增加mRNA的G-C组分可改善mRNA 的稳定性[13]。RNA 结构、翻译效率和蛋白质折叠机制最有可能通过稀有密码子替换mRNA序列和插入修饰核苷酸来改变[14]。
1.1 5' Cap结构
最简单的5' Cap结构是掉转方向的7-甲基鸟苷三磷酸,与mRNA 5'端核苷酸通过5'ppp5'连接,形成m7GpppN 结构。复杂的Cap 结构在后面的一个或两个核苷酸还有2'-O-甲基修饰。Cap结构的通式可写为m7GpppN(m)pN(m)……[15]。5'Cap 结构是真核生物mRNA 在进化上非常保守的修饰。5'Cap 可募集细胞蛋白并介导加帽相关的生物学功能,例如前mRNA 加工、核输出、帽依赖性蛋白质合成和免疫原性等[16]。
Cap 结构对稳定mRNA 及其翻译具有重要意义,它不仅可以将5'端封闭起来,避免被核酸外切酶水解,还可作为蛋白合成系统的辨认信号,被Cap 结合蛋白(Cap binding protein)eIF-4E 识别并结合,促使mRNA与核糖体小亚基结合,进而启动翻译过程[16]。另外,在病毒与固有免疫的博弈中,5'Cap 的结构也极为重要。因为固有免疫系统对没有5'Cap 结构的 RNA 具有较高的敏锐度,因此很多病毒进化出了丰富多样的加帽策略。而对这些病毒mRNA的加帽机制研究已拓展出诸如高效体外RNA 加帽系统和自扩增 mRNA 技术,大大促进了科研型与治疗型 mRNA 的大规模生产[17]。
1.2 5'非翻译区
5'非翻译区(5' untranslated region,5'UTR)是Cap 结构与编码区起始密码子之间的一段较短的序列,其中包括标志翻译起始的序列,如原核生物的SD 序列。5'UTR 是翻译起始的高度敏感区,其长度、二级结构以及AUG 的数量都会影响翻译的起始效率[18]。此外,还影响mRNA 的半衰期和蛋白表达水平[19]。5'UTR 的长度一般是100~200 个核苷酸,少于20 个碱基时会错过起始密码子AUG,称为遗漏扫描(leaky scanning)。过长的5'UTR 容易形成过多二级结构,不利于翻译起始[20],因此一般引入Kozak 序列或保持短散的设计来增强翻译效率[21]。
1.3 编码区
编码区由起始密码子AUG 开始,到终止密码子(UAG、UGA、UAA)截止。编码区的二级结构和密码子选择都可能影响翻译效率,过多的二级结构和稀有密码子都会降低翻译速度,通过密码子的优化(规避不常见/不安全组合)、核苷酸替换(使用假尿嘧啶、5-甲基胞嘧啶、N6-甲基腺苷等修饰核苷酸)等方法可增强mRNA 的稳定性和翻译效率,同时减少固有免疫反应和mRNA的降解[22]。
编码区中高GC 含量可能会影响mRNA 的二级结构,但比例较高的GC 序列比低GC 序列的翻译效率高100 倍[23]。翻译延伸率受同源tRNA 可及性和密码子修饰影响,以防止匹配稀有物种的tRNA 序列并整合与更常见tRNA 物种匹配的序列[24]。此外,密码子依赖性翻译延伸率是mRNA稳定性的主要参数,密码子修饰对mRNA 稳定性至关重要[25]。用相同的频繁密码子替换稀有密码子会提高产量,而重复使用相同的密码子会加速tRNA 翻译,这是由于tRNA 在核糖体附近的氨基酰化[26]。相邻的核苷酸和密码子也会影响翻译速率和效率[27]。起始密码子应包括Kozak 序列[28],并且可以修改终止密码子的序列[29]。此外,在正确的起始密码子之前,mRNA 中不应存在上游起始密码子。密码子优化的mRNA已被有效地利用在针对病毒感染的疫苗研究中,用于表达非病毒蛋白[30]。为了进行适当的折叠,一些蛋白质需要由不常见的密码子保证修饰来延迟翻译[31]。mRNA 序列的密码子选择可显著影响蛋白质生成速率和核糖体结合时间。研究发现,N1-甲基-假尿嘧啶核苷(1mΨ)核苷酸替换可增加碱基对的稳定性,形成复杂的二级结构和改善mRNA 的翻译效率[32]。此外,通过修改mRNA二级结构设计,可以提高mRNA对核酸内切酶裂解和化学降解的稳定性[33]。通常首选5-甲基胞苷(m5C)和假尿嘧啶核苷(ψ)核苷酸修饰来降低免疫原性的同时提高翻译效率[34]。
1.4 3'非翻译区
3'非翻译区(3'UTR)是位于终止密码子之后的转录序列,是mRNA不稳定因素的集中区,可影响转录后修饰和翻译过程。3'UTR 含有加尾信号,包括核心序列AAUAAA,以及下游10~30 bp处的一段富含GU 的辅助序列,这些都是导致mRNA 不稳定的常见因素[35-36]。因此,在设计mRNA 药物时,应该避免使用这些序列,例如BioNTech 在发明专利中使用了人类β-球蛋白3'UTR 的两个连续拷贝(2 hBg,也称2βgUTR),以提高转录稳定性和翻译效率(WO 2017/059902 Al;BioNTech RNA 制药有限公司)[37]。研究表明,人α 和β 球蛋白的3'UTR 可以提高mRNA 的稳定性和翻译效率,而头尾排列的两种人β 球蛋白的3'UTR 可以提高mRNA 的稳定性[38]。使用细胞和病毒5ʹUTR 和3ʹUTR 的不同区域可以提高mRNA的稳定性和翻译效率。通过将富含AU 的区域插入3'UTRs可以破坏mRNA 的稳定性,反而有助于缩短蛋白质合成时间,从而确保mRNA 快速分解和短时间内持续性的蛋白质合成[39]。
1.5 Poly(A)尾结构
多数真核生物mRNA的3'端都有几十到数百个碱基组成的Poly(A)尾[40]。成熟的mRNA 一般会在它的3'端加上长度为20~200 bp 的多聚Poly(A)尾,可以防止外切酶降解,也可以作为核膜孔转运系统的标志,与成熟的mRNA 通过核膜孔转运到胞浆有关[41]。然而,3'Poly(A)尾的长度在细胞核和细胞质中是受到高度调控的,不同长度的3'Poly(A)尾部可调节成熟mRNA 的稳定性、转运和翻译。一旦mRNA 到达细胞质,Poly(A)尾就会与5'Cap 协同,与eIF4F 复合体形成稳定的闭环结构,促进翻译起始[42]。3'Poly(A)尾与5'Cap、内部核糖体进入位点和各种其他决定因素共同作用,调节mRNA的稳定性和翻译效率。
3'Poly(A)尾的长度决定了mRNA 翻译的程度。3'Poly(A)尾的缩短和延长可以很好地反映其对基因表达在时间和空间上的调控。哺乳动物细胞mRNA 分子在细胞质中含有长约250 个核苷酸(nt)的Poly(A)尾,在其一生中从3′逐渐减少。约100 nt 的 Poly(A)尾是合成mRNA 药物的理想选择,因为尾大小可以通过调节3′外切核降解影响mRNA 的衰变[43]。Poly(A)的长度与翻译效率之间存在正相关关系,例如,100 nt 的 Poly(A)尾比64 nt 的 Poly(A)尾蛋白质表达水平高约35倍[44];120 nt 的 Poly(A)尾比51 nt 和42 nt 的 Poly(A)尾更有利于形成稳定的mRNA,保证有效的翻译[46];325 nt 的 Poly(A)尾比172 nt 的 Poly(A)尾显示出更高的效率[38]。然而,Poly(A)尾长度与 mRNA 翻译效率的正相关关系并不总是成立的,在人原代T 细胞中,425 nt和525 nt的Poly(A)尾仅比120 nt的 Poly(A)尾翻译效率高[45]。
对mRNA 的一级结构表征包括核苷酸序列、核苷酸修饰、帽子结构、Poly(A)尾和核苷酸修饰。目前,三代测序技术可以实现核苷酸碱基序列确定。基于DNA 测序技术,RNA 需逆转录为与之互补的DNA 进行测定,目前所用的逆转录酶的差错率在10-4~10-5数量级,这对于药物的质控可以忽略不计[46]。相对于核酸测序技术,基于酶切的高分辨质谱,包括三酶切方法和固定化RNaseT1 单酶部分酶切方法,序列覆盖率在70%左右[47]。加帽效率、Poly(A)尾长度及分布、核苷酸修饰等特殊结构通常需要其他技术手段进行表征。例如,液相色谱-质谱联用(liquid chromatograph-mass spectrometer,LC-MS)可用于监测体外转录反应的进程和确定关键质量属性(如5'加帽)的状态[47-48]。在工艺优化和放大过程中,依据不同需要可以选择不同的分析技术。在工艺表征和工艺验证过程中,mRNA 理化性质基本是固定的,其生物活性也是固定的,mRNA 的一级结构表征鉴定方法也基本固定。mRNA 自身的不稳定性决定了在检测时会优先考虑速度和效率,高效液相色谱的快捷性会成为一级结构表征的趋势。
2 mRNA的高级结构
单链mRNA 的堆叠、氢键结合以及与水和离子的额外相互作用和自身的折叠形成了各种mRNA的高级结构。
2.1 mRNA的二级结构
RNA 二级结构也称为茎环结构(stem-loop structure),包括互补碱基对构成的单链区结构、茎环结构以及双链结构等各种不同组件形成的平面结构,并通过这些结构进行自我折叠。RNA 的二级结构一般由以下几个基本构件组成:单链结构、茎、发卡环、凸环、内环以及多分支环[50-51]。
单链结构是RNA 分子折叠成平面结构后两端没有形成配对的单链状结构。
茎是指碱基逆向互补配对时这些碱基对组成的集合[52]。由空出来不配对的碱基形成的环状结构和“茎”组合成形似发夹的结构,得名为发夹环,茎至少由4个未配对碱基组成,其中5个碱基对最为稳定[52-53]。
内环是茎区的两条单链上都存在的未能形成碱基对的碱基,由碱基间作用力而形成向外突出的圆环状结构。通常发生在螺旋内的非典型碱基配对区域,并引起A型螺旋骨架的畸变,当两条链上的未配对碱基数相等时,内环是对称的[51]。
相对于内环,凸环则是由某段茎区的一条单链上存在着的未能形成碱基对的碱基形成的,这条单链上至少存在一个自由碱基。凸环的存在使得RNA 二级结构的茎区可以出现弯折现象,且凸环的存在会影响RNA的三级结构[54]。
多分支环也称为多重环,是多个茎区和环的连接组合,二级结构中经常可以看到1 个多分支环连接4个或更多的茎区[53]。
假结结构是由发夹环上碱基与发夹结构外部非茎区的碱基互补配对形成的氢键所组成,假结属于三级结构的范畴。假结对RNA 的功能具有重要影响,并在RNA 参与的生命过程中起重要作用[55]。
2.2 mRNA的三级结构
三级结构是一种三维空间形式的高级结构,这种三维结构以二级结构为基础,除了碱基配对产生的相互作用力外,分子内部还存在主链与主链间的相互作用力、主链与碱基间的相互作用力以及孤立氢键间的相互作用力等。这些相互作用力促使平面的二级结构折叠成紧凑的空间结构,通过几个同轴螺旋堆积形成三级结构[56]。其中,内环中连续腺嘌呤碱基可以形成伪Watson-Crick碱基对(沃森克里克模型,双链反向平行),这是形成稳定三级结构的基础,当发夹或内环的互补一级序列和单链区域通过Watson-Crick 碱基配对相互影响时,形成假结,也可以形成两个交替发夹结构。假结的形成通过发夹双螺旋茎和新形成的环-环相互作用的螺旋堆叠产生延伸的螺旋区域。尽管假结仅比两个发卡略稳定,但桥接环中未配对核苷酸与延伸螺旋内碱基对之间的相互作用(如碱基三倍)提高了三级结构的稳定性[57]。例如,三级结构中核糖拉链是最常见的形式[58]。此外,三级结构的稳定性要低于二级结构,其结构极易受到温度、环境等因素的影响。
2.3 mRNA的四级结构
在RNA 及其他生物大分子三级结构基础上,RNA 和RNA、RNA 和DNA、RNA 和蛋白质之间通过相互作用形成的复合物,即为RNA 的四级结构,这种相互作用大部分依赖Watson-Crick 碱基对。其中,核糖体就是由rRNA 和蛋白质组成的最为常见的RNA 四级结构,如Sarcin-Ricin(也称Bulged G-Motif)结构和Kink-Turns Motif 结构。Sarcin-Ricin 结构是核糖体的高度保守结构,对于维持核糖体活性、锚定mRNA 至关重要[59]。Kink-Turns Motif 结构又称扭结转角,大部分扭结转角与蛋白质结合,可以促进RNA之间的结合[60]。
mRNA 的高级结构中二级结构对于调控来说非常重要,尤其是二级结构的不同模式与编码区域、剪接点和多腺苷酸化点相关,细胞的代谢活动过程受mRNA 二级结构的影响明显不同,二级结构可以极大地影响三级结构。所以确定和表征mRNA 的二级结构,对分析和理解基因遗传信息的传递机制至关重要。mRNA 分子的三级结构和四级结构,对遗传信息的影响作用机理尚不完全清楚[61]。Huang等[62]尝试过使用RNA二级和三级结构预测程序最简单的技术,但充满不确定性,将输入的一级序列折叠成潜在的二级结构。这些程序都是通过计算许多碱基配对方案的自由能,找到总自由能最低的二级结构,并将最低能量电位的二级结构返回为最可能的结构。目前,这些高级结构的特性鉴定方法少有报道,mRNA 的实际结构表征方法应用仍需进一步探索。
3 mRNA的临床应用进展
迄今为止,大多数mRNA 的临床应用都集中在传染病和癌症疫苗领域(表1)。mRNA 在临床上的应用机理基本一致,包裹编码靶蛋白(抗原蛋白)mRNA 的脂质纳米颗粒(lipid nanoparticles,LNP)在体内给药时,LNP-mRNA 由于内吞作用被吞噬,mRNA 通过抗原呈递细胞中的内体逃逸机制释放到细胞质中[63]。在核糖体内部,mRNA 通过翻译形成蛋白质,涉及的蛋白质疗法使用合成的mRNA在人体内产生所需的蛋白质,如抗体、细胞因子和酶。对于疫苗,模仿病毒感染过程,细胞内产生的抗原主要引起细胞介导和抗体介导的免疫应答。
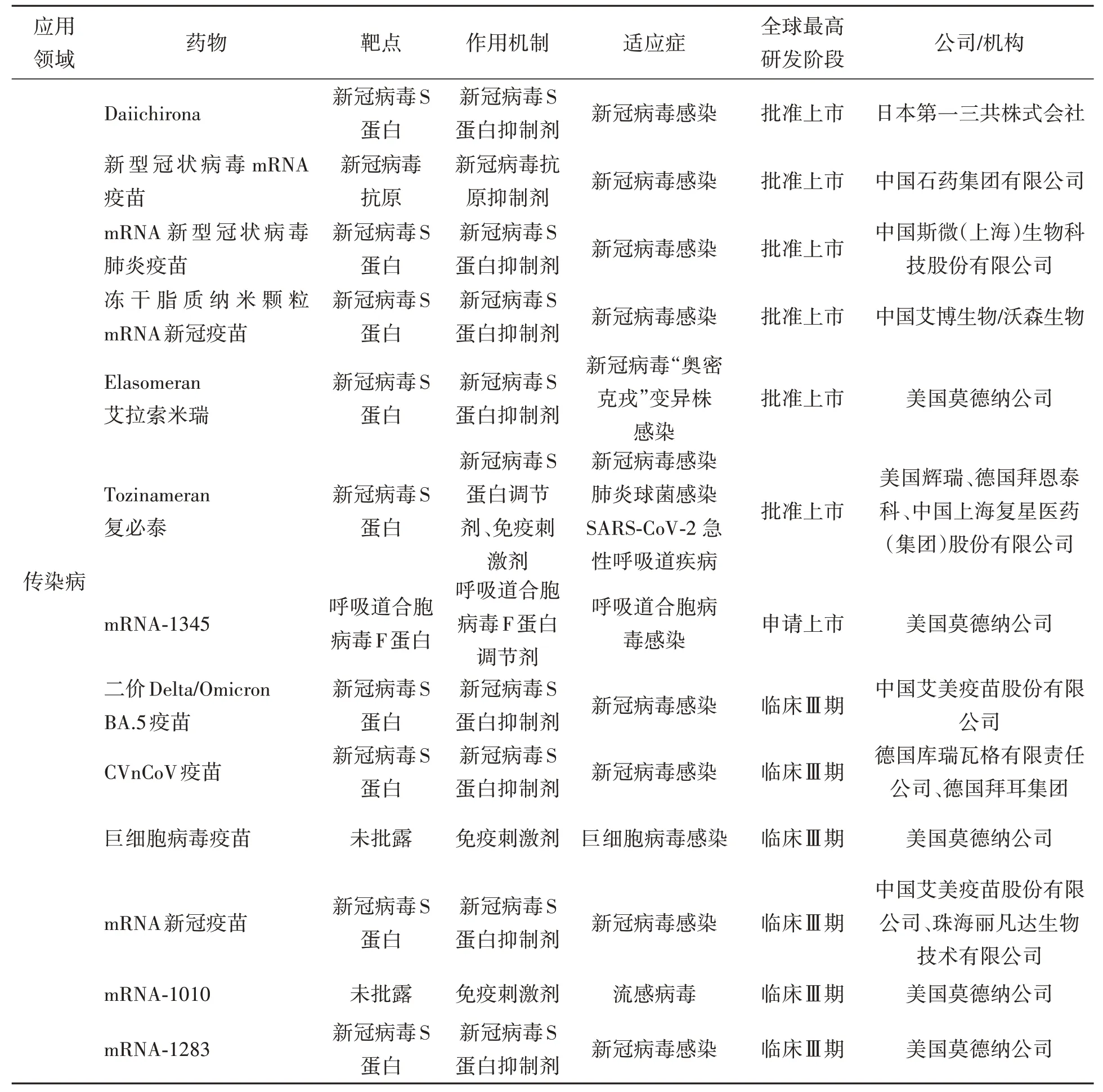
表1 临床阶段的mRNA药物Table1 mRNA drugs in clinical phase
3.1 mRNA在传染病上的应用
mRNA的临床应用大都集中在传染病领域(表1),在新冠病毒的预防上应用最多,季节性流感病毒、Epstein-Barr 病毒、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、呼吸道合胞病毒(respiratory syncytial virus,RSV)、寨卡病毒(Zika virus,ZIKV)、带状疱疹病毒(varicella zoster virus,VZV)也都取得了临床进展。此外,在狂犬病毒、埃博拉病毒、登革热病毒和猴痘病毒等预防方面均取得了积极效果[64-66]。针对链球菌、铜绿假单胞菌、肺结核杆菌和金黄色葡萄球菌等细菌性传染病也显示出潜在的实验效果[67-69]。在预防寄生虫,如疟疾、血吸虫和弓形虫等的感染上,mRNA 也提供了可能[69-71]。在动物传染病方面,如禽流感预防也显示出一定的效果[72-73]。mRNA在传染病的应用上具有许多共同特征,mRNA进入细胞质后可直接翻译成蛋白质,因此,mRNA疫苗是非整合的、非传染性的,且耐受性良好。mRNA 在细胞中短暂表达,允许重复接种。mRNA转录物中编码单位的选择是灵活多样的,允许编码抗原和免疫调节分子来诱导和调节适应性和先天免疫应答,并且含有多个表位的编码全长抗原可以由主要组织相容性复合体Ⅰ类(major histocompatibility complex-Ⅰ,MHC-Ⅰ)和Ⅱ类(MHC-Ⅱ)分子呈现,而不受MHC限制[69]。但是,在传染病的传播方式上,现有的mRNA 修饰技术和递送系统仍然没有完全解决mRNA本身的免疫原性[69]。
3.2 mRNA在癌症疗法上的应用
近年来,mRNA 疗法在癌症领域的应用逐渐成为研究热点。相对于传染病,mRNA 在癌症等疗法的开发方面临着更多挑战。在传染病预防上mRNA 只需要产生少量蛋白质,人体免疫系统会通过细胞和抗体介导的免疫反应放大免疫信号,而mRNA 癌症疗法需要mRNA 疫苗所表达的1 000 倍以上的蛋白质水平才能达到治疗阈值。通常情况下,mRNA 疗法需要作用于特定的靶通路、细胞、组织或器官。因此需要重视靶细胞对mRNA 的吸收,这决定了mRNA 表达的持续时间和水平。脂质载体递送到组织中的生物利用度、循环半衰期和递送效率都是限速因素。静脉注射可以很容易让mRNA 药物靶向肝脏,但将其有效递送到其他实体器官仍然具有挑战性。此外,对于慢性疾病的治疗通常需要多次给药,即使优化过的mRNA 和LNP 在多次给药后也会激活先天免疫,从而降低治疗性蛋白的表达[74]。
对于mRNA 癌症免疫疗法的机制,一种方法是通过编码表达肿瘤抗原蛋白来抑制肿瘤生长,或抑制肿瘤微环境。然而,目前的mRNA 递送方式不太可能到达患者的每个癌细胞。另外一种方法是通过mRNA作为治疗性疫苗来刺激免疫系统杀死癌细胞[75]。
3.2.1 基于肿瘤抗原的mRNA 癌症疗法 mRNA癌症疗法可根据癌细胞表达的肿瘤抗原特异性设计,激发体内抗肿瘤T 细胞或B 细胞反应。肿瘤包括肿瘤相关自身抗原(tumor associated autoantigens,TAAs)和肿瘤特异性抗原(tumor specific antigen,TSA)。其中,TAA在肿瘤细胞中过表达,但也存在于正常组织中,具有较弱的肿瘤特异性和免疫原性,而TSA是来源于肿瘤细胞突变的抗原,具有高的肿瘤特异性和免疫原性,但机体耐受性较弱。使用多个(如2~6 个)共享TAAs 的组合已成为临床开发靶向mRNA癌症疫苗的趋势。通常所选择的TAAs 在相关肿瘤中广泛表达,当与不同的载体或佐剂结合时,可以诱导抗肿瘤免疫反应。
与TAA 不同,TSA 是由于肿瘤细胞突变而产生的,不会影响中枢免疫耐受。因此,TSA 疫苗或新抗原疫苗是治疗癌症的一种有潜力的形式。一般来说,癌症细胞中的新抗原被蛋白酶降解为小肽,这些小肽在内质网上加工并呈现给细胞表面的分子。这些新表位MHC 被CD4+和CD8+T 细胞识别,以诱导细胞免疫反应。或者,释放到细胞外液中的TSA可以被肿瘤微环境中渗透的抗原呈递细胞吸收并呈递。癌症患者肿瘤细胞内的独特突变特征还可用于个性化疫苗设计[76]。
3.2.2 基于细胞因子的mRNA 癌症疗法 基于mRNA 产生的细胞因子来抑制肿瘤微环境,比重组细胞因子更有优势,因为它们理论上可以保持其信号活性。mRNA 技术可以快速且经济高效地生产大量基于细胞因子的治疗分子,使其成为与重组细胞因子相比更广泛使用的选择。此外,无论是系统注射还是肿瘤内给药,将编码细胞因子的mRNA封装在纳米颗粒中均可以延长细胞因子的半衰期[76]。
3.2.3 基于细胞治疗的mRNA 癌症疗法 基于mRNA 技术的细胞疗法,如树突状细胞在诱导特异性肿瘤抗原反应中至关重要,在诱导潜在的免疫反应中,树突状细胞(dendritic cell,DCs)发挥着关键的作用,DCs 能够指导细胞毒性T 淋巴细胞和自然杀伤细胞形成强大的抗肿瘤武器,从而攻击肿瘤细胞,是mRNA 癌症疫苗的理想递送目标。mRNA 可以在离体或细胞原位将DCs 工程化,用于癌症治疗。除了DCs,基于mRNA 的CAR-T 或TCR-T 细胞疗法也可用于癌症治疗,而且mRNA 编码CAR 或TCR 用于工程化T 细胞的策略优于逆转录病毒或慢病毒,因为转染率较高且无基因突变的风险[34]。
3.3 mRNA在其他治疗领域上的应用
在其他治疗领域(表1),例如,以色列Arcturus Therapeutics 公司正在研发一种用于治疗鸟氨酸氨甲酰基转移酶(ornithine transcarbamoylase,OTC)缺乏症的mRNA 治疗药物LUNAROTC。利用脂质核酸递送系统,评估其在OTC 缺乏症患者中的安全性和耐受性[77]。目前正处于Ⅱ期临床试验阶段(NCT05526066)。
英国阿斯利康公司和美国莫德纳公司合作开发了一种编码血管内皮生长因子(vascular endothelial growth factor-A,VEGF-A)的mRNA 治疗药物AZD8601。Ⅱ期临床试验(NCT03370887)研究了在接受冠状动脉搭桥手术的中度收缩功能受损患者的心肌内注射AZD8601 药物后的安全性和耐受性,并探索了其相关疗效。结果显示,AZD8601 药物无严重不良反应,且疗效呈上升趋势[78]。
美国SQZ生物技术公司与瑞士罗氏公司合作开发了一种基于mRNA 的细胞疗法,名为SQZeAPC HPV。SQZeAPC-HPV 向4 种不同类型的工程免疫细胞(单核细胞、T 细胞、B 细胞和NK 细胞)输送5 种针对HPV16 蛋白抗原和免疫刺激蛋白的mRNA 分子。目前正在招募一项Ⅰ/Ⅱ期临床试验(NCT05357898),以评估SQZeAPC HPV 作为单一疗法和联合派姆单抗治疗复发、局部晚期或转移性HPV16+实体瘤患者的安全性、耐受性、抗肿瘤活性、免疫原性和药效学效应等。
德国BioNTech 公司开发了一种可在体内编码分泌IgG 抗体的mRNA 药物BNT141。该药物目前正处于Ⅰ/Ⅱ期临床试验(NCT04683939)阶段,主要研究其在Claudin18.2 阳性实体瘤患者中的安全性和药代动力学[79]。
4 挑战与展望
mRNA 新冠疫苗的成功研制促进了mRNA 药物的高速发展,但是mRNA 技术仍然存在许多挑战有待解决。
首先,优化mRNA 从而提高体内蛋白质生产的时间和数量,利用基于核苷的化学修饰(如尿苷修饰)来增加蛋白质的表达[74,80]。除蛋白质的表达量外,缩短蛋白质翻译的时间、解决重复给药障碍也是mRNA 用于治疗慢性病的关键,如自我复制的mRNAs(saRNAs)在使用自身RNA 序列作为模板进行扩增后,在细胞质中可提高RNA 转录本的含量[81-82]。环状mRNAs(circRNAs)能够提供另外一种延长蛋白质翻译时间的方法,即环状结构可使circRNAs 免受核酸外切酶的攻击,通过延长RNA的寿命提高蛋白质的总产量[83]。
其次,各种智能的递送系统可以改善在血液中的循环时间、生物分布、装载和释放等关键功能。改进包装和递送系统,包括可电离的脂质纳米颗粒(LNP)、基于肽的纳米颗粒、细胞生物膜、基于细胞的胞外囊泡等,能够提高mRNA 药物靶向精准度,增强药效。阳离子和可电离的LNP 是目前研究最深入、应用最广泛、临床上最先进的mRNA 递送载体[84-86],但其可能的细胞毒性和相对较短的循环时间将阻碍其在临床上的应用[87-88]。目前已经合成并测试了各种新型脂质-聚乙二醇(polyethylene glycol,PEG)共轭物和可电离脂质。可电离脂质在生理pH条件下保持中性,降低毒性的同时,还能在一定程度上增加循环半衰期[89]。在酸性pH 下可电离脂质的质子化现象不仅能够封装mRNA,还能够使mRNA 从酸性核内体中逃逸[22]。由PEG 脂质化形成的PEG 外壳能够显著延长LNPs 的循环半衰期、减少聚集,从而减少与血清蛋白不利的相互作用[90]。另外一种有效的方法是使用细胞外囊泡(外泌体)。外泌体具有生物相容性、低免疫原性、无毒性、重复给药后耐受性良好等优点,在需要重复给药的情况下,被认为是未来最有前景的mRNA递送系统[91]。细胞穿透肽(cell penetrating peptide,CPPs)可以穿透细胞膜进入细胞质中,根据CPPs 和RNA 的性质,通过形成各种纳米复合物用于RNA 递送系统[92]。基于细胞的递送系统,其可以利用细胞的分泌能力直接将mRNA合成的蛋白质递送至离体细胞中。该递送系统具有生物相容性、无毒性、延长循环半衰期等优点,可将mRNA 导入免疫细胞等细胞中进行修饰[92]。研究人员还开发了一种细菌介导的口服mRNA 疫苗载体,该多靶点疫苗成功探索了基于沙门氏菌的工程化载体,以提供针对新冠病毒德尔塔和奥密克戎变异株的mRNA疫苗[93]。
另外,要实现mRNA疗法的全部潜力,还需要解决mRNA 的靶向性问题,特别是对于心脏、肾脏、大脑和肺等实体器官的特异性递送。目前,肝脏是大多数分子疗法的首选器官,其丰富的血管系统有利于有效的均匀递送和大颗粒通过。简单的静脉注射就可以将mRNA高效递送到肝脏细胞并表达出治疗性蛋白质。此外,GalNAc 与寡核苷酸的结合代表了一种可安全用于肝脏靶向递送的核酸治疗剂方法[94]。基于GalNAc 的递送主要依赖于肝细胞表达去唾液酸糖蛋白受体的能力,通过受体介导的内吞作用结合糖蛋白[95]。然而,将mRNA 治疗药物选择性递送到肝脏以外的器官需要专门开发具有适当亲和力的包装和递送系统。如近年开发的工程脂质纳米颗粒能够选择性地将mRNA 传递到肝外器官[96];内源性淋巴结导向脂质纳米颗粒系统[97];腹腔内给药将含有阳离子辅助性脂质纳米颗粒传递到胰腺,进而产生胰岛素细胞[98];基于LNP 的mRNA 治疗方法可增加PEG和胆固醇类似物β-谷固醇[99];允许重复给药治疗慢性疾病的策略。
尽管存在这些挑战,mRNA 疫苗在预防新冠病毒感染应用中的巨大成功,以及在致命癌症治疗中的多种尝试,验证了未来该技术的巨大应用前景。

