大豆皂苷结构及生理活性研究进展
朱力杰, 潘月影, 李英燕, 周英杰, 白昕雯,刘秀英, 刘 贺
(1.渤海大学 食品科学与工程学院/生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.武汉轻工大学 食品科学与工程学院, 湖北 武汉 430023)
我国是大豆生产大国,目前大豆总产量居世界第4。大豆富含蛋白质、油脂等人体必需的营养物质,可以生产丰富多样的加工产品,如豆腐、腐竹、豆豉、酱油、豆粉、豆奶等。近年来,大豆中皂苷类化合物丰富多样的结构与活性越来越受到研究者的关注[1]。已有研究表明,不同品种大豆的皂苷组成和含量均不同[2]。对比中国、日本和美国等主要种植区大豆中皂苷的含量后发现,中国产大豆中皂苷含量最高[3],大豆中皂苷的含量为0.17%~6.16%[4]。
大豆皂苷属于两亲性齐墩果烷型三萜糖苷,其极性糖链与非极性五环共轭[5],是大豆及其制品中的一类富含生物活性的小分子组分[6]。大豆皂苷具有广泛且有益的生物活性,包括抗肿瘤[7]、抗氧化[8]、抗菌[9]、降血糖[10]、降胆固醇[11]、保肝[12]、免疫调节[13]等。虽然已有关于大豆皂苷结构及生理活性的综述文章,但大多发表时间较早,且生理活性研究多为大豆粗皂苷,对结构与功能之间的关系没有深入分析与总结。本研究通过对大豆皂苷研究现状进行分析,重点介绍大豆皂苷化学结构和生理活性及两者间的关系,总结大豆皂苷基于生理活性的应用,剖析大豆皂苷在未来应用中存在的问题,以期为大豆皂苷进一步研究和开发利用提供参考。
1 大豆皂苷的结构
1.1 大豆皂苷的分类与结构
大豆皂苷一般由五环三萜类同系物的羟基和糖分子环状半缩醛羟基失水缩合而成,因其水溶液能形成像肥皂一样的持久性泡沫,故而得名。大豆皂苷具有1个或2个糖链[14],常见的有β-D-葡萄糖(β-D-Glc)、β-D-半乳糖(β-D-Gal)、α-L-鼠李糖(α-L-Rha)、β-D-木糖(β-D-Xyl)、α-L-阿拉伯糖(α-L-Ara)、β-D-葡萄糖醛酸(β-D-GlcUA)等,有时糖链还会伴有酰基化的情况[15]。目前已知大豆皂苷的种类超过百种[2],根据其苷元不同,可以分为7种类型,即A、B、E、DDMP、H、I和J型,这7种类型的大豆皂苷按照C-3、C-22及C-29连接官能团的不同,可以归纳为A、B和Sg-6三大类(表1[16])。
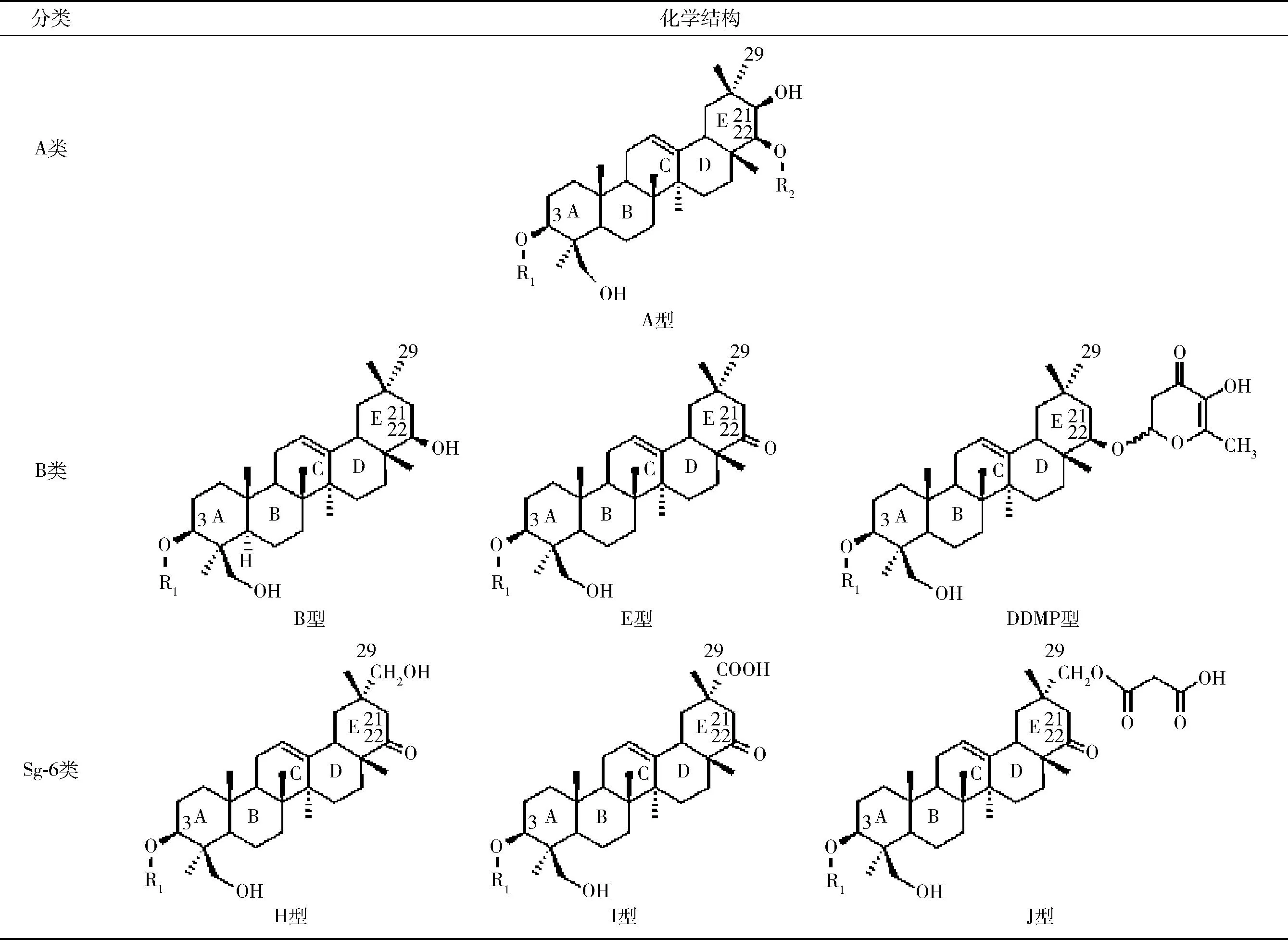
表1 大豆皂苷的化学结构
1.1.1A类大豆皂苷的结构
大豆皂苷在C-3、C-22及C-29连接官能团的差异见表2[16-17]。A类大豆皂苷以大豆皂醇A(3β,21β,22β,24-四羟基-齐墩果烷-12-烯)为母核结构,有两条糖链,分别连接在苷元的C-3和 C-22 上。不同A类大豆皂苷的区别在于R1、R2两个取代基的不同。A类大豆皂苷C-22上连接的第一个糖基(R1)都是α-L-Ara,大多数A类大豆皂苷会连接第二个糖基,此糖基为酰基化糖基,acetylXyl-或acetylGlc-[18]。
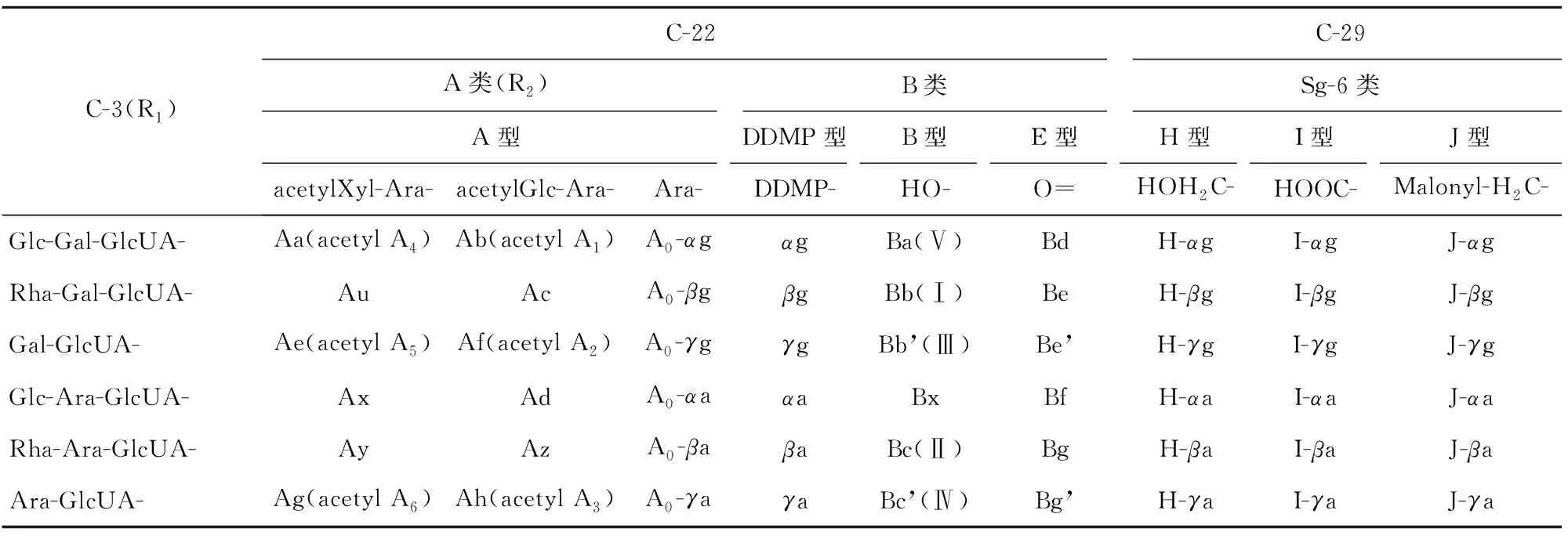
表2 大豆皂苷C-3、C-22、C-29结构差异
1.1.2B类大豆皂苷的结构
B类大豆皂苷以大豆皂醇B(3β,22β,24-三羟基-齐墩果烷-12-烯)为母核结构,具有与C-3连接的单糖链。根据C-22上官能团的不同主要分为B型、E型和DDMP型,其C-22上分别结合羟基、羰基和DDMP环(2,3-二氢-2,5-二羟基-6-甲基-4-氢-吡喃-4-酮)。
1.1.3Sg-6类大豆皂苷的结构
Sg-6类大豆皂苷主要有H、I、J三种类型,由日本学者Krishnamurthy团队首次从野生大豆中分离得到,这些皂苷由一个显性等位基因共同遗传,并且与Sg-6基因表达有关[19]。Sg-6类大豆皂苷的特点是C-22位是羰基,并且C-29位双甲基中的一个可以被羟甲基(—CH2OH)、甲酸(—COOH)、亚甲基丙二酸(—CH2OOCCH2COOH)取代形成H、I、J型大豆皂苷[20]。并非所有的野生大豆都含有Sg-6类皂苷,含有Sg-6类皂苷的野生大豆可用于大豆育种计划以及大豆皂苷生物合成研究[16]。
1.2 大豆皂苷的结构与生物合成
1.2.1大豆皂苷的生物合成途径
大豆等豆科植物在异戊二烯代谢途径中会通过生物合成产生大豆皂苷(图1)[21-22]。在大豆皂苷的生物合成过程中,首先通过细胞质中的甲羟戊酸代谢途径,将乙酰辅酶A转化为大豆皂苷的底物异戊烯二磷酸。该途径是合成大豆皂苷前体底物的主要途径,3-羟基-3-甲基戊二酰辅酶A还原酶是该途径的第一个限速酶[23],在大豆皂苷生物合成中起重要作用。之后,异戊烯二磷酸和二甲基烯丙基焦磷酸相互转化,经过一系列酶的催化,最终转变为2,3-氧化鲨烯[24]。2,3-氧化鲨烯会在氧化鲨烯环化酶的催化下环化生成不同的三萜类化合物骨架。目前,已在大豆中发现参与大豆皂苷合成的氧化鲨烯环化酶基因。在氧化鲨烯环化酶和β-香树脂醇合成酶的共同催化下,2,3-氧化鲨烯环化生成五环三萜骨架β-香树脂醇。β-香树脂醇是通过椅式-椅式-椅式构象衍生出来的,其经过羟基化、糖基化等修饰后可形成种类多样的大豆皂苷[25]。
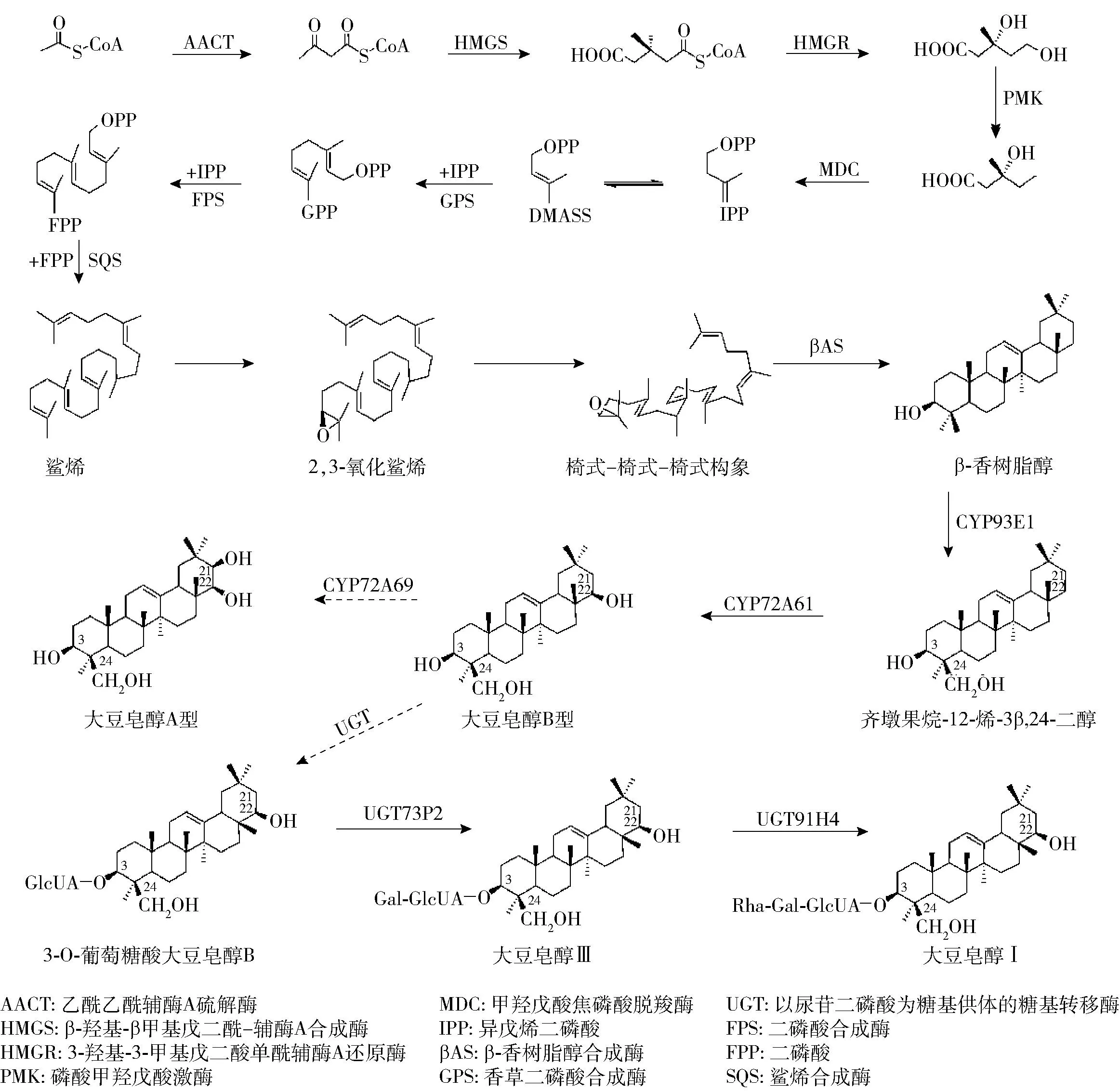
图1 大豆皂苷生物合成途径Fig.1 Biosynthetic pathways of soyasaponins
1.2.2细胞色素与糖基转移酶在大豆皂苷合成中发挥的作用
在大豆皂苷的生物合成过程中,细胞色素(CYP93E1、CYP72A61、CYP72A69)和以尿苷二磷酸(uridine diphosphate glycoside,UDP)为糖基供体的糖基转移酶(UGT73P2、UGT73K1、UGT73F2、UGT73F4、UGT91H4)介导不同的反应,产生不同的分支途径和中间体[26]。具体表现在:
1)细胞色素主要介导羧基化反应,在大豆皂苷生物合成中产生不同的中间体。例如,大豆中CYP93E1属于C24-羟化酶[27],其与CYP72A61可将β-香树脂醇转化为大豆皂醇B,大豆皂醇B可被CYP72A69羟基化修饰形成大豆皂醇A[22]。
2)UDP糖基转移酶主要介导糖基化反应,能够在大豆皂苷生物合成过程中添加不同的糖基。大豆皂苷的糖基化反应主要发生在苷元的C-3、C-22和C-23位。例如,UGT73K1可催化大豆皂苷C-3、C-22和C-23位的葡萄糖糖基化[28];UGT73F4和UGT73F2可依次转移UDP-木糖基和UDP-葡萄糖基到大豆皂苷A0-αg C-22位的阿拉伯糖基上,生成22-O-木糖-葡萄糖-大豆皂苷A[29];UGT73P2可转移UDP-半乳糖基到大豆皂醇B单葡糖醛酸苷上形成大豆皂醇Ⅲ,UGT91H4可转移UDP-鼠李糖基到大豆皂醇Ⅲ的C3-3位生成大豆皂醇Ⅰ[30]。
细胞色素和UDP糖基转移酶在大豆皂苷生物合成中的协同作用共同构成了生物合成的复杂网络,它们介导的化学反应不仅能增加大豆皂苷的多样性,也能改变大豆皂苷的极性和稳定性,从而影响其生理活性。
1.3 加工方式对大豆皂苷结构的影响
大豆皂苷的生理活性取决于其化学结构,而化学结构可以通过食品加工改变或修饰。不同加工方式可使乙酰化A型大豆皂苷发生不同程度的降解,其降解程度可用全乙酰化与去乙酰化(包括部分去乙酰化和完全去乙酰化)A型大豆皂苷的比值来表示。研究发现,生大豆食品、热加工大豆食品和发酵大豆食品中全乙酰化与去乙酰化A型大豆皂苷的比值分别为10.61、2.28和0.34[31],其中发酵大豆食品显示出最高的去乙酰基A型大豆皂苷比例,这可能是由于发酵过程中热处理和酶反应等产生的影响。对于热加工大豆食品中,煮沸的幼大豆和未改性的豆浆中全乙酰化A型大豆皂苷含量较高,但改性豆浆中的全乙酰化A型大豆皂苷含量非常低,去乙酰化A型大豆皂苷含量较高,这与改性过程中酸化和均质处理导致水解反应的发生有关[31]。因此,从全乙酰化A型大豆皂苷到去乙酰化A型大豆皂苷的脱乙酰作用可能在发酵过程中通过水解激活。
B型和E型大豆皂苷是DDMP型的衍生物,DDMP型不稳定,容易脱去DDMP基团降解为B型和E型大豆皂苷[32]。降解条件决定了产物类型,如蒸煮和烹饪等热降解过程将DDMP型降解为B型,而酶降解则表达为B型或E型。DDMP型大豆皂苷主要在生豆食品中检出,加工大豆食品中DDMP型大豆皂苷含量均低于生豆食品,说明前者中的皂苷多发生了降解。B型大豆皂苷是加工大豆食品中的主要皂苷成分,尤其是发酵大豆食品。生大豆食品、热加工大豆食品和发酵大豆食品中B型与DDMP型大豆皂苷的比值分别为0.1、0.7和1.0[31]。热加工和发酵等加工方式可使DDMP型大豆皂苷降解为B型和E型大豆皂苷,主要为B型。因此,热处理、发酵和酶反应等加工方式可以将完全乙酰化的A型大豆皂苷降解为去乙酰化的A型大豆皂苷,并将DDMP型大豆皂苷降解为B型和E型大豆皂苷。
2 大豆皂苷生理活性及构效关系
2.1 抗肿瘤作用与机制
作为一种具有两亲性结构的次级代谢产物[33],大豆皂苷在与癌症发展相关的各种过程中具有多方面作用,它可以抑制肿瘤细胞的增殖和诱导细胞凋亡,降低其侵袭活性,它还可以通过调节与氧化应激和炎症相关的细胞内信号通路来影响癌细胞[34]。
大豆皂苷抗肿瘤作用机理主要为对肿瘤细胞的直接毒作用和生长抑制作用。尹学哲等[35]分别研究了单糖链大豆皂苷和双糖链大豆皂苷对结肠癌HT-29细胞增殖的影响,发现两者均可抑制癌细胞的增殖,诱导癌细胞的凋亡,但极性较差的单糖链大豆皂苷诱导癌细胞凋亡作用更强,故大豆皂苷的抗肿瘤活性与其结构密切相关。Gurfinkel等[36]通过研究8种不同结构的大豆皂苷和苷元对结肠癌 HT-29 细胞的影响,发现疏水性大豆皂苷苷元(即皂苷脱去糖链后余下的部分)A和B及苷元B连接1个GlcUA后形成的糖苷都能抑制癌细胞的生长,而亲水性糖链对癌细胞的生长没有影响,故大豆皂苷疏水性苷元在抗肿瘤活性中发挥重要作用,大豆皂苷抗肿瘤活性随着亲脂性的增加而增加。
大豆皂苷抑制肿瘤细胞生长和促进肿瘤细胞凋亡的机制与PI3K/PTEN/Akt和NF-κB信号通路有关(图2)。大豆皂苷Bb可通过降低人食管癌Eca-9706细胞中的c-met和VEGF恶性标志的过高表达,并通过抑制HDAC1和NF-κB,激活抑癌基因PTEN和Caspase3信号传导途径来诱导食管癌细胞凋亡[37]。也有研究表明[38],大豆皂苷Bb可以通过上调抑癌基因PTEN的表达和下调细胞周期蛋白D1的表达,阻抑PI3K/Akt的促细胞增殖信号途径,从而抑制细胞的增殖。此外,大豆皂苷抑制结肠癌细胞的生长作用与其激活Caspase9,裂解的Caspase9进一步处理Caspase3和Caspase7,启动caspase级联反应,诱导细胞凋亡的作用有关[39]。因此,大豆皂苷可通过抑制PI3K/PTEN/Akt和NF-κB等促细胞增殖信号途径、启动诱导肿瘤细胞凋亡的Caspase级联反应发挥抗肿瘤活性。
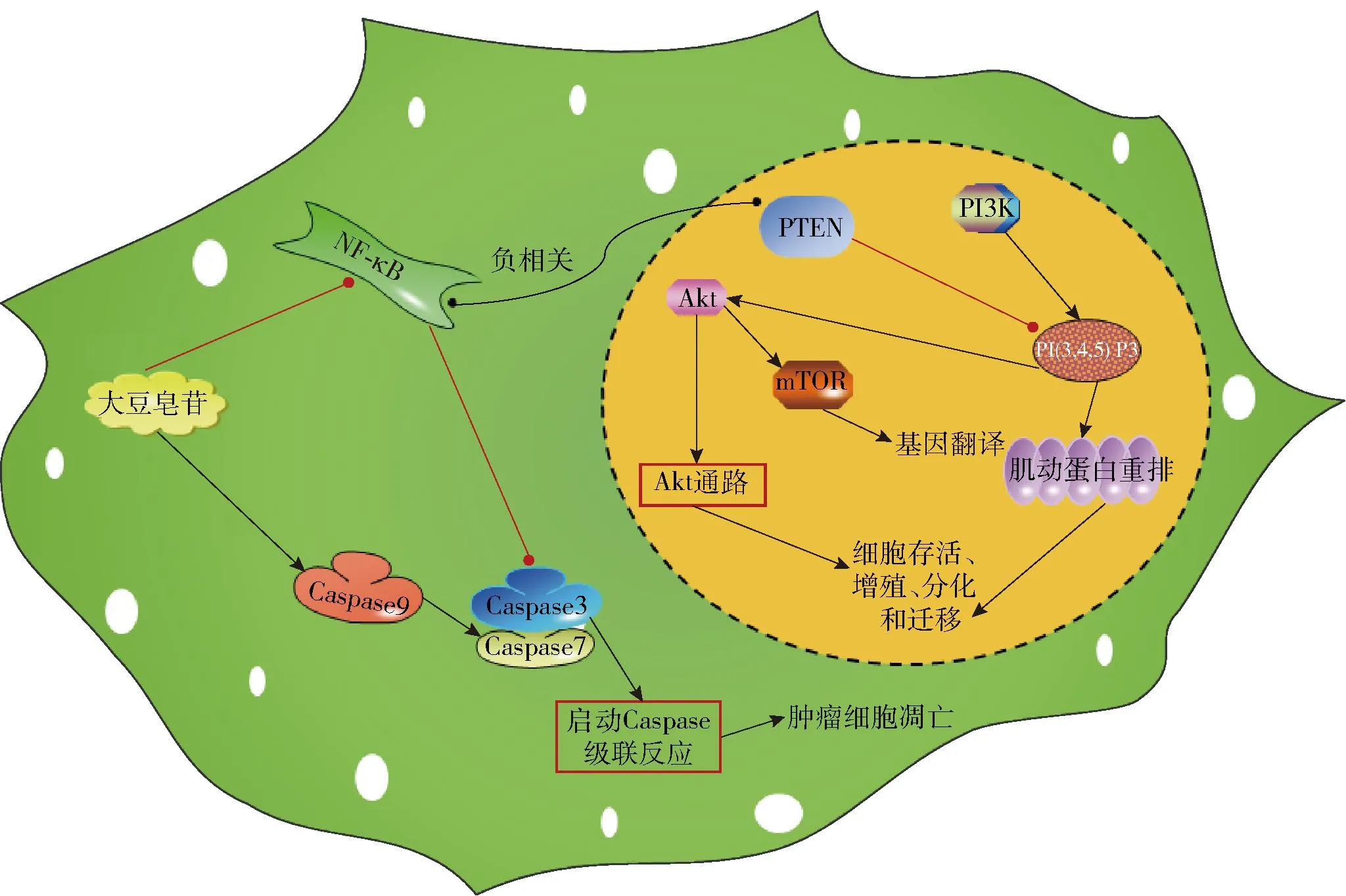
图2 大豆皂苷抗肿瘤机制Fig.2 Anti-tumor mechanism of soyasaponins
2.2 抗炎作用与机制
近年来,大量的体外细胞实验或动物研究证实了大豆皂苷在巨噬细胞介导的炎症反应中具有抗炎活性[40-41]。大豆皂苷可抑制脂多糖(LPS)刺激的巨噬细胞中炎症细胞因子(TNF-α和IL-1β)、炎症介质(NO、PGE2和MCP-1)、炎症酶(COX-2和iNOS)的分泌,也可抑制核转录因子NF-κB的抑制剂IκB-α的降解。IκB-α的磷酸化和降解使NF-κB易位至细胞核,与特定的启动子序列结合,诱导炎症基因的表达[42-43],因此,大豆皂苷可通过抑制NF-κB的活性发挥抗炎作用。研究表明[44],大豆皂苷A1、A2和I可以通过减弱NF-κB介导的iNOS表达来抑制LPS刺激的巨噬细胞中NO的产生,从而表现出抗炎特性,而不含糖链的皂苷苷元A和B没有此活性。
大豆皂苷A1、A2、Ⅰ和Ⅱ已被证实有抗炎活性[45]。Lee等[42]证明,大豆皂苷Ⅰ可显著抑制3,4,5-三硝基苯磺酸(TNBS)诱导的小鼠结肠炎症标志物、促炎症细胞因子的分泌和NF-κB的活化,发挥抗炎作用。Wang等[46]发现,大豆皂苷Ⅱ可以通过减少巨噬细胞中YB-1磷酸化和核转位,抑制Nlrp3炎症小体启动,发挥抗炎作用,预防脂多糖/D-半乳糖胺(LPS/GalN)刺激的小鼠急性肝衰竭。
在与炎症相关的诸多受体中,TLR4是巨噬细胞上的一种受体,能够通过IL-1受体相关激酶(IRAKs)与NF-κB通路相连,并识别LPS等与病原体相关的分子。大豆皂苷A1、A2和I可以通过下调MyD88的表达,抑制TLR4和MyD88进入脂筏,减轻炎症[47]。研究发现,大豆皂苷可能通过3种机制调控TLR4信号传导:1)抑制TLR4与其配体(如LPS)的结合[41,48];2)抑制分子(TLR4、MyD88和TRIF)进入脂筏[49];3)降低信号分子的表达[41](图3)。

红色T形虚线表示大豆皂苷调节TLR4信号的可能靶点。CD14: 分化簇14; COX-2: 环氧酶2; IL-1β: 白细胞介素1; IL-6: 白细胞介素6; IRAK1&4: 白细胞介素-1受体相关激酶1&4; IκBα: 核因子κB抑制因子α; MD-2: 髓样分化蛋白2; MES: 2-吗啉乙磺酸; MyD88: 骨髓分化因子88; PGE2: 前列腺素E2; TIRAP: 白细胞介素1受体衔接蛋白抗体; TLR4: 类酊样受体4; TRAF6: TNF受体相关因子6; TRAM: 易位相关膜蛋白; TRIF: β干扰素TIR结构域衔接蛋白; Ubc13: 泛素偶联酶13; Uev1A: 泛素偶联酶E2变体1异构体A。
此外,细胞间黏附分子-1(ICAM-1)作为黏附分子免疫球蛋白超家族的成员,可能导致急性和慢性炎症性疾病。大豆皂苷苷元B可以强抑制TNF-α诱导的THP-1(人单核细胞白血病)细胞ICAM-1的表达,而大豆皂苷苷元A轻度激活ICAM-1的表达,表明C-21上的羟基影响对ICAM-1的抑制作用。与大豆皂苷苷元A相比,大豆皂苷A3对ICAM-1有轻微的抑制活性,这可能与C-3上的糖基有关[50]。
总的来说,大豆皂苷的亲水性糖链结构在抗炎活性中能够发挥重要作用,其抗炎活性与多种信号分子相关。
2.3 抗氧化、抗自由基作用与机制
活性氧(ROS)的过度存在会破坏细胞防御,导致氧化应激,进而诱发衰老、癌症及心脏病等各种疾病。磷脂是构成生物膜的重要成分,富含不饱和脂肪酸,这些不饱和脂肪酸在一系列ROS作用下会酸败变性,即生成过氧化脂质(LPO)。大豆皂苷的抗氧化机理是抑制LPO的生成和促进LPO的分解,抗氧化能力与其所含糖基紧密相关,双糖链大豆皂苷的抗氧化能力优于单糖链大豆皂苷[51]。
大豆皂苷可以清除ROS和DPPH自由基,抑制LPO的生成。Zhu等[52]通过研究4种大豆皂苷(Aa、Ab、Ba和Bb)在HepG2细胞中的体外抗氧化活性、细胞毒性及对过氧化氢的保护作用,发现大豆皂苷可缓解H2O2导致HepG2细胞产生的氧化应激,且B型大豆皂苷对ROS的去除效果更好;进一步研究表明,A型大豆皂苷具有较好的细胞抗氧化活性和抗氧化酶活性,这归因于化学结构的差异。A型和B型大豆皂苷在三萜骨架中的C-3位置均含有糖链,而A型皂苷具有额外的乙酰糖链,在C-22上具有更多活性基团;另外,两组大豆皂苷羟基和羰基的数量差异也可能是造成其抗氧化性能不同的原因。大豆皂苷的抗氧化能力不仅与清除自由基有关,也与其激活抗氧化酶的活性紧密相关。Zhu等[53]研究表明,大豆皂苷Bb可以保护大鼠肝细胞免受酒精诱导的氧化应激,其抗氧化能力不仅仅是通过去除ROS来实现的,还与其激活血红素加氧酶-1(HO-1)的表达密切相关。并且,Liu等[54]表明,大豆皂苷Ab不仅可浓度依赖性地清除DPPH自由基,表现出良好的脂质过氧化抑制作用,还可通过激活ERK1/2信号通路,使Nrf2从细胞质转运到细胞核,促进与Nrf2相关的抗氧化酶HO-1和NQO1的表达,保护HepG2细胞免受氧化应激。此外,大豆皂苷还可通过分解LPO发挥抗氧化作用,Ishii等[55]发现,大豆皂苷可提高甲状腺素水平,促进LPO的分解,从而减少组织中LPO,减轻脂质过氧化程度。目前,有关A型和B型大豆皂苷抗氧化、抗自由基的研究较多,缺乏对DDMP型皂苷的研究,但DDMP型皂苷DDMP基团独特的反应性结构赋予其消除ROS的能力。DDMP皂苷具有脱氢作用,与氢供体共存时,消除ROS的能力更强,显示出协同抗氧化作用。用分子轨道法分析DDMP大豆皂苷的电子存在概率,发现DDMP基团的C-6部位参与了ROS的消除反应,是该反应的活性部位[56]。因此,A型、B型和DDMP型大豆皂苷均具有抗氧化、抗自由基活性,各型间活性的差异主要归因于化学结构的不同,如羟基和羰基的数量。A型大豆皂苷的双糖链结构赋予其更多活性基团,具有较好的抗氧化活性;DDMP型大豆皂苷DDMP基团的C-6部位是其介导抗氧化、抗自由基活性的关键部位。
2.4 抗菌作用与机制
在目前所发现的抗生素中,很多抗生素的抑菌机制为抑制细菌细胞壁的合成,如β-内酰胺类抗生素可与细菌竞争转肽酶,抑制细菌细胞壁黏肽的合成,造成细胞壁缺损,使菌体膨胀变形、破裂死亡,产生杀菌作用[57];或者通过使细菌细胞膜丧失选择透过性,导致大量物质进入细胞,使细胞破裂死亡。目前抗生素的使用越来越多,采取措施使其从自然环境中去除尤为重要。天然表面活性剂支持生物降解,提高了微生物降解杂质的生物利用度,这引发了其对细菌细胞影响的问题[58]。
大豆皂苷属于两亲性齐墩果烷型三萜糖苷,由极性糖链与非极性苷元组成,是一种天然表面活性剂,能在一定程度上降低细胞膜的表面张力,改变细胞膜的选择通透性,理论上应具有一定的抗菌作用。Rojewska等[58]通过分析呋喃妥因和皂苷在细菌膜和模拟它的模型磷脂膜上的相互作用,发现抗菌药呋喃妥因降低了膜渗透性。当皂苷浓度高于临界胶束浓度时,皂苷分子嵌入磷脂POPE单分子层,皂苷被结合到细菌膜中,但它们的亲水性糖链保留在外面,这改变了细胞表面的吸附特性以及膜的渗透性。然而,并不是所有的表面活性剂都有抗菌活性,因此通过降低细胞膜的表面张力达到抗菌目的并不是大豆皂苷抗菌活性的主要因素。大豆皂苷也可通过抑制β-内酰胺酶的活性,增强β-内酰胺类抗生素的抗菌活性,从而达到抗菌目的,其中大豆皂苷V对β-内酰胺酶具有最高的抑制活性,可用于开发新的治疗剂,有作为抗生素替代品的潜质[9,59]。皂苷的结构对其抗菌活性具有很大影响,糖链是否存在,糖链的位置,糖基的数目,糖链或苷元上是否有其他官能团及其类型均会影响皂苷的抗菌活性。在研究齐墩果烷型皂苷抗菌活性的构效关系时发现,皂苷A环C-3位连接的糖链对其抗菌活性影响较大。当皂苷C-3位连接的糖基为葡萄糖时,其抗菌活性最强;若将皂苷C-3位连接的糖链去掉,将导致其抗菌活性降低甚至丧失;单糖链皂苷的抗菌活性优于双糖链皂苷,且糖链连接在C-3位置的皂苷抗菌活性更好[60]。并且,有学者认为C环C-12和C-13间的双键对皂苷的抗菌活性至关重要[61]。
2.5 调节脂质代谢、降血糖作用与机制
大量研究表明,大豆皂苷对脂质代谢具有有益作用,可以改善胆固醇状况。研究人员考察了大豆皂苷对高脂饮食喂养动物的影响[62- 65],认为大豆皂苷改善血脂的能力在很大程度上归因于其与胆固醇形成不溶性复合物的功能,干扰胆汁酸在胃肠道的代谢,从而促进胆固醇在粪便中的排泄。大豆皂苷糖链的连接位置、苷元的极性基团或苷元的总化学结构可能是与胆固醇相互作用有关的重要因素[66]。大豆皂苷的苷元结构可以直接影响脂质代谢酶的活性,抑制甘油三酯和胆固醇的合成,进而降低血脂和胆固醇水平,如皂苷分子C-28位的游离羧酸是成功抑制胰脂肪酶的必需基团[67]。Tsai等[68]研究表明,大豆皂苷将附睾脂肪组织中固醇调节元件结合蛋白-1c(SREBP-1c)mRNA水平降低32%,将肝脏中SREBP-1c和脂肪酸合酶mRNA水平降低52%和61%;Xiao等[69]研究表明,大豆皂苷可以降低高脂饮食诱导的小鼠脂蛋白脂肪酶(LPL)mRNA的表达水平。
在降血糖方面,大豆皂苷C-3位的葡萄糖醛酸可以抑制α-葡萄糖苷酶和α-淀粉酶的活性[70],从而抑制寡糖和多糖的消化和吸收,减缓血糖的升高速度。总大豆皂苷[71]和B、E、DDMP型大豆皂苷[72]均显示出很强的α-葡萄糖苷酶抑制活性,IC50为10~40 μmol/L时,具有良好的改善葡萄糖稳态的生物活性。此外,皂苷可以保护胰腺β细胞谱系免受高糖损伤[73]。大豆皂苷降血糖、血脂、胆固醇生理活性与其苷元结构和糖基构象密切相关,其中苷元结构会影响胆固醇吸收和脂肪酸代谢的过程,而C-3位的糖基构象则会影响葡萄糖转运的过程。
2.6 其他功能
2.6.1肾素抑制作用
大豆皂苷Ⅰ可以使肾素-血管紧张素-醛固酮系统失活,降低血压,能够与肾素活性位点和活性位点附近的区域结合,并通过与底物竞争对肾素产生抑制作用[74];除大豆皂苷Ⅰ外,在3β-羟基位置的第一个糖链中含有葡萄糖醛酸残基的其他皂苷也对自发性高血压大鼠的降压有效,表明皂苷中的3-O-β-D-吡喃葡萄糖醛酸对皂苷的肾素抑制活性至关重要[75]。
2.6.2免疫促进作用
大豆皂苷具有免疫促进功能。Qiao等[76]表明,大豆皂苷Ab因具有高免疫活性和较低的或无溶血作用,可能是有效的疫苗佐剂候选物;de Groot等[77]通过脂质膜法设计了含有脂质成分[胆固醇、二棕榈酰磷脂酰胆碱(DPPH)]的大豆皂苷(Ab/Bb)微结构,研究了大豆皂苷与胆固醇和DPPC组成的朗缪尔单分子层(模型膜)之间的相互作用,表明大豆皂苷和脂质成分(DPPC、胆固醇)的新型胶体结合物可以作为疫苗的潜在佐剂。大豆皂苷的佐剂活性与其两亲性分子结构有关,Oda等[78]比较了8种纯化大豆皂苷对鸡卵清蛋白(OVA)的抗体反应和大豆皂苷的亲水亲油平衡值(HLB),发现大豆皂苷苷元没有佐剂活性,A型大豆皂苷中具有长糖侧链的大豆皂苷A1的抗体反应比A2强,B型大豆皂苷抗体反应由强到弱顺序为:大豆皂苷Ⅰ、大豆皂苷Ⅱ、大豆皂苷Ⅲ。大豆皂苷的佐剂活性随着HLB值的增加而增加,而HLB值的大小受糖链的长度、数目和位置的影响。
2.6.3护肝作用
大豆皂苷能够通过减少氧化损伤、抑制脂肪变性和炎症的发生,来缓解小鼠急性酒精性肝损伤[79];大豆皂苷也可通过调节肠道菌群稳态、胆汁酸分泌及其转运受体的功能,发挥预防非酒精性脂肪肝炎的活性[80];此外,大豆皂苷的C-3糖链被认为在护肝功能中发挥重要作用[81]。
2.6.4抗突变作用
大豆皂苷可以降低电离辐射导致的小鼠细胞遗传学损伤[82]。辐射对DNA的损伤可分为两种,一种是直接使DNA断裂,另一种是通过加快小鼠体内产自由基的速度间接损伤DNA。大豆皂苷的结构决定其不能阻碍辐射所致的DNA断裂,因此大豆皂苷可能是通过抑制自由基的产生或清除多余的自由基来保护DNA免受辐射损伤。有资料显示,大豆皂苷的抗突变作用也可能与其结构“O←CH-OH-”能氧化-SH密切相关。
2.7 基于大豆皂苷生理活性的应用
大豆皂苷具有防止体内过氧化脂质生成,降低血中胆固醇含量,抑制体内脂肪吸收,促进中性脂肪分解等功效,还能提高机体抗氧化能力,增强免疫力,是开发抗衰老、抗肥胖、降血脂等功能食品的良好原料,也是有希望开发防治高血脂症、肥胖症、心血管疾病药物的因子。学者们在大豆皂苷的生理活性方面已有了较为深入的研究,开发出多种含有大豆皂苷的保健食品、减肥食品以及健身酒饮料等[83],如具有调节血脂、延缓衰老作用的大豆皂苷胶囊和冲剂[84];含有醋制麦芽浆和大豆皂苷的保健食品,研究表明,该保健食品具有改善健康状况、预防衰老、抗肥胖等功效[85-86]。
此外,利用大豆皂苷开发的药物在治疗皮肤炎症、降血压、抗肿瘤等方面也有较好的临床效果[87-88]。总之,大豆皂苷作为一种天然的植物提取物,具有良好的生物降解性和安全性,不会对人体和环境造成危害,且易于获得,在食品、医药等行业具有广阔的应用前景。
3 结 语
本文介绍了大豆皂苷的分类、结构与生物合成代谢途径,分析了加工方式对大豆皂苷结构的影响,重点阐述了大豆皂苷生理活性的产生机制与结构-活性关系,并总结了目前大豆皂苷基于生理活性的应用。天然大豆皂苷结构的多样性,主要取决于糖基化和羧基化反应形成的多种中间体与糖配基,而皂苷经热处理等常规食品加工方式作用后也会发生结构改变。大豆皂苷具有抗肿瘤、抗炎、抗氧化、抗菌、降血糖、护肝等多种生理活性,这主要归因于大豆皂苷的特殊化学结构和特性,其两亲性结构(亲水性糖链和亲脂性苷元)与类固醇的亲脂性、结构相似性与活性的表达密切相关。此外糖链的数量、大小、组成和位置,以及皂苷与其他分子的相互作用等都会影响大豆皂苷的生理活性。
大豆皂苷因具有多种对人体有益的生理活性而广泛应用于食品、药品及化妆品等领域,但目前仍存在一些问题亟待解决:1)大豆皂苷具有一定的苦味,如何在不影响皂苷生理活性的前提下实现苦味调控,是影响含皂苷食品进一步推广需要解决的关键问题。2)目前涉及大豆皂苷的研究以生理活性为主,实际投产的产品品种仍很有限,应针对不同人群的需求,开发多种形态的皂苷功能食品,推动皂苷产业高质量发展。3)大豆皂苷同传统的铝盐佐剂相比,免疫活性较高且副作用较小,但目前关于大豆皂苷在人体作为免疫佐剂的适宜剂量尚未明确,其在该领域的应用有待进一步探究。

