生血宝合剂药渣对新西兰兔饲喂效果的研究
贺 宇, 于金高 , 宋忠兴, 唐志书,2 , 段金廒,朱华旭, 刘红娜, 周建平, 曹兆军
(1.陕西中医药大学陕西中药资源产业化省部共建协同创新中心秦药特色资源研究开发国家重点实验室(培育),陕西 咸阳 712046;2.中国中医科学院,北京 100700;3.南京中医药大学江苏省植物药深加工工程研究中心江苏省中药资源产业化过程协同创新中心,江苏 南京 210023;4.清华德人西安幸福制药有限公司,陕西 西安 710043)
在中药制药行业, 每年会产生数万吨的废弃中药渣。中草药渣中不仅含有粗蛋白质、粗脂肪和粗纤维等多种营养物质, 还包含丰富的未提取完全的萜类、黄酮类和甾类等药用活性成分。 Saleh等(2018)发现,留兰香、百里香和丝兰等药渣添加饲料可有效提升肉鸡的生产性能和抗氧化应激能力。此外,也有试验将中草药渣应用到反刍动物的养殖上,Wang 等(2021)将黄芪添加到藏羊的饲料中, 发现藏羊的血清抗氧化水平和免疫因子显著提升。
生血宝合剂是由制何首乌(Polygoni Multiflori Radix Praeparata)、 女贞子 (Ligustri Lucidi Fructus)、桑椹(Mori Fructus)、墨旱莲(Ecliptae Herba)、白芍(Paeoniae Radix Alba)、 黄芪(Astragali Radix)、狗脊(Cibotii Rhizomi)七种中药材制成的补益类中成药,主要功效为滋养肝肾和益气补血,临床上用于各类贫血的治疗(彭舟丽,2017)。其在制剂过程中会产生大量药渣, 对其进行饲料化开发不仅可改善药企药渣污染问题, 还能开发新型饲料资源,促进中草药行业及畜牧业协调发展。
本研究首先通过营养物质考察及UPLCTOF-MS 活性成分测定对生血宝药渣 (SXBR)进行成分表征。 随后设计低、中、高比例的SXBR 添加饲料进行动物饲养,考察体重增长、屠宰率、滴水损失率等生产性能指标,并从抗氧化应激能力、肠道菌群和骨髓造血功能等方面进行功能性考察。最后通过组织病理切片观察、血清生化和免疫指标检测进行潜在毒性表征, 以确定生血宝药渣开发为优质动物饲料的可行性。
1 材料与方法
1.1 仪器与材料 UPLC-TOF-MS (Waters ACQUITY UPLC H-Class 型, 美国Waters 公司;Triple TOFTM 5600,美国AB SCIEX 公司);UPLC(Agilent1290 型,美国Agilent 公司); 纯化水系统(Milli - Q,美国Millipore 公司);全自动饲料机(YZ-160,安徽扬子工业科技有限公司);分光测色仪(YS6060,深圳市三恩时科技有限公司);全自动血清生化分析仪(BS-330E 型,迈瑞医疗国际有限公司)。
SXBR(09 批,清华德人西安幸福制药有限公司);苜蓿草(20210816,新沂市乐泽宠物用品有限公司);浓缩饲料(PK0807T3,英国Supreme Selective 公司);IgA ELISA 试剂盒(20210711,艾莱萨生物科技有限公司, 上海); IgG ELISA 试剂盒(20210618, 艾莱萨生物科技有限公司, 上海);IgM ELISA 试剂盒(20210706,艾莱萨生物科技有限公司,上海) 。
1.2 SXBR 营养成分含量测定 SXBR 干物质(DM)、有机物(OM)、粗蛋白质(CP)、粗脂肪(CFAT)、粗纤维(CF)、总碳水含量(TC)和能量(NRG) 均依照中国药典2020 版或中华人民共和国国家标准进行测定和计算。
1.3 SXBR 次生代谢产物鉴定 供试样品配制:对SXBR 打粉, 称取0.05 g 并加入50.0 mL 的甲醇,采用超声法超声提取40 min,过0.22 μm 的微孔滤膜,即得SXBR 供试品。
液相色谱条件: 以0.1%甲酸水(A) 和乙腈(B)作为流动相,使用ACQUITY UPLC HSS T3 柱进行洗脱, 洗脱条件为:0 ~25 min,2% ~10%B;25 ~75 min,10% ~24.5%B;75 ~77 min,24.5% ~40%B;77 ~97 min,40%B;97 ~102 min,40% ~48%B;102 ~132 min,48%~80%B;132 ~133 min,80% ~80.03%B;133 ~138 min,80.03% ~2%B;138 ~140 min,2%B。 设置5 μL 的进样量,0.3 mL/min的流速及254 nm 的检测波长。
质谱条件: 使用超高效液相-三重四级杆高分辨液质联用仪,电喷雾离子源(ESI),在正负离子模式下, 以IDA、DBS 和高灵敏度模式采集前10 个峰度最高的母离子。
1.4 饲料制备与动物试验设计 浓缩饲料、苜蓿草、SXBR 打粉, 使用饲料机制备为颗粒饲料,晾干后封装待用。 12 只90 d 的新西兰兔随机分为四组,即对照组(SXBRc,饲喂70%浓缩饲料+30%苜蓿草)、低比例添加组(SXBRl,饲喂5%SXBR+70%浓缩饲料+25%苜蓿草)、 中比例添加组(SXBRm, 饲喂10%SXBR+70%浓缩饲料+20%苜蓿草)及高比例添加组(SXBRh,饲喂20%SXBR+70%浓缩饲料+10%苜蓿草), 浓缩饲料营养水平见表1。 每只兔子每天分4 次喂90 g 饲料,饮水自由。 60 d 后使用戊巴比妥钠麻醉兔子,取血液以及各器官组织进行分析。

表1 浓缩饲料的营养水平 %
1.5 动物生产性能测定 每天固定时间称量兔子体重。饲养期结束后,参照高凤磊等(2021)的方法计算料重比及屠宰率,参考何长晟等(2019)的方法安装滴水损失装置,计算滴水损失率。
1.6 饲料功能性考察
1.6.1 生物标志物测定 采集兔子全血制备血清, 采用试剂盒检测法分别对血清总抗氧化能力(AOC)、谷胱甘肽过氧化物酶(GSH-Px)活性、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量进行测定; 同时取各组新西兰兔股骨固定进行TUNEL 检测及骨髓造血功能考察。
1.6.2 肠道菌群测序分析 将新鲜的兔子粪便收集在冰上, 半小时内收集完毕后在-80 ℃环境中保存。提取粪便总DNA,采用1%琼脂糖凝胶电泳对DNA 进行检测 (Yu 等,2018)。 PCR 扩增16S V3 ~V4 区(细菌,引物:GGACTACHVGGGTWTCTAAT)和ITS1 区(真菌,引物:CTTGGTCATTTAGAGGAAGTAA), 纯化后进行测序 (Wen 等,2017), 使用UPARSE 软件按相似度阈值为97%进行聚类,即得OTUs(Clare 等,2016)。
1.7 饲料安全性考察 饲喂周期结束后,解剖兔子,取兔子心、肝、脾、肺、肾、胃、盲肠、回肠和结肠组织固定,进行病理切片观察。 采集兔子血液,检测血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、尿酸(UA)、尿素(UREA)、血糖(GLU)、肌酐(CREA)、C-反应蛋白(CRP)、肌酸磷酸激酶(CK)和乳酸脱氢酶(LDH)等血清生化指标, 使用试剂盒检测肠道屏障功能标志物磷酸酯多糖(LPS)和IgA、IgG、IgM 水平。
1.8 数据统计与作图 通过AB SCIEX Peakview 2.2软件进行UPLC-TOF-MS 数据分析,以master view 1.1.0.0 版块联合中草药成分数据库鉴定SXBR 中的活性成分。 匹配检索条件为: 与TCM MS/MS 库中标准品的二级质量碎片重合(Yao 等,2019)。
肠道菌群数据分析以物种丰度列表为基础,分别利用细菌和真菌OTUs 作组间比较韦恩图,以OTUs 丰度、 属水平丰度数据采用R 语言软件和在线工具进行主成分分析、 聚类热图分析和LefSe 分析,LDA 阈值为2,显著性阈值设置为P<0.05。 宏基因组功能预测使用PICRUSt2 软件进行, 其丰度数据使用STAMP 软件进行非参数检验并作图。
其余数据采用K-W 检验进行组间比较,显著性阈值设置为P<0.05。 折线图和柱形图使用GraphPad Prism 9.0 制作。
2 结果
2.1 SXBR 营养价值 为探究SXBR 的营养价值, 本研究首先对SXBR 的营养成分含量进行测定。研究发现SXBR 富含碳水化合物、粗脂肪和粗纤维等物质(表2)。 数据显示SXBR 的DM 含量高达952.80 g/kg, 其中OM 含量为865.30 g/kg,TC 含量为703.76 g/kg, 其CP、CFAT 和CF 水平也较为可观。 根据营养成分计算的总能量高达16029.38 kJ/kg。从营养水平来看,SXBR 具有作为饲料添加剂的潜力。

表2 SXBR 组成及营养水平
饲料原料或饲料添加剂中的功能性次生代谢物是其发挥保健作用的基础。 SXBR 是7 味补益类药食两用中草药水提取后的药渣, 本研究应用UPLC-TOF-MS 技术对其中残留的次生代谢产物进行了鉴定(表3),结果表明在SXBR 中总共鉴定出51 种化合物,主要为三萜、黄酮、皂苷、氨基酸、维生素等小分子化学成分,这些物质具有良好的抗炎、抗氧化、调节肠道菌群和促进消化等活性。
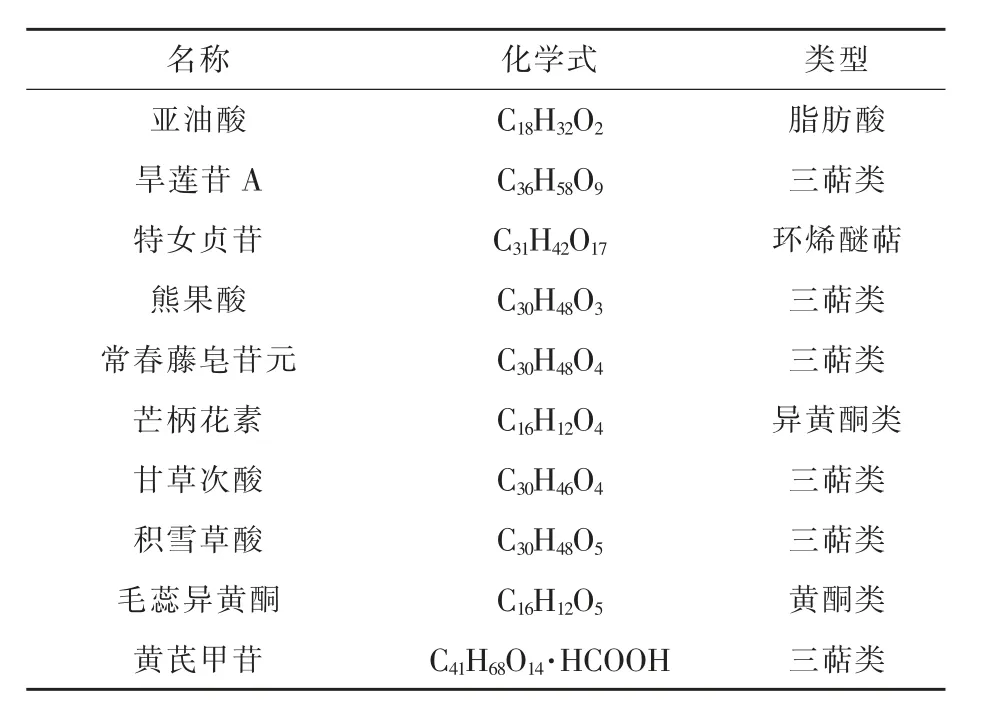
表3 SXBR 中功能性成分表征
以上数据表明SXBR 营养价值高, 活性成分丰富,有潜力开发为优质动物饲料。 考虑到SXBR富含粗纤维, 故本研究进一步采用草食性动物新西兰兔验证SXBR 的营养价值、 保健价值并对其安全性进行了考察。
2.2 SXBR 对新西兰兔生产性能的影响 在新西兰兔的基础日粮中添加5%~20%的SXBR,在定量饲喂的条件下, 发现SXBR 混合饲料适口性良好,基本不影响兔子的采食量。在饲喂过程中通过各组新西兰兔体重增加趋势可知,SXBRh 组的体重增长速度总体高于SXBRc、SXBRh 组新西兰兔在第44天(P =0.024)、54 天(P =0.009)和57 天(P =0.024)的体重增量, 相比SXBRh 组分别显著提高了62.08%、72.38%、64.96%。 SXBRm 组和SXBRl 组体重增量与SXBRc 组之间无显著差异(图1A)。 料重比可直接反映饲料生产效能, 饲喂周期结束后,通过计算可知SXBRh 组新西兰兔的料重比相比SXBRc 组显著降低了43.85%(P=0.042)(图1B)。

图1 各组生产性能指标测试结果
屠宰率反映动物可利用部位的比率, 是衡量饲料产肉性能的经济指标。 研究发现各添加饲料组屠宰率均大于SXBRc 组,添加量从低到高分别比SXBRc 组的屠宰率增加了9.02%、6.54%、8.94%,当采用t 检验进行组间比较时,其P 均<0.05(图1C)。 同时,饲料中添加SXBR 后,兔肉的滴水损失率有降低趋势,即兔肉趋于紧致,且其变化趋势与添加比例呈正相关(图1D)。
2.3 SXBR 对新西兰兔抗氧化因子水平的影响鉴于SXBR 中含有调节机体代谢、抗炎、抗氧化等活性的成分, 本研究进一步考察了新西兰兔血清中的抗氧化因子水平, 结果表明SXBR 各添加比例虽然不影响血清T-AOC 和GSH-Px 活性,但明显增加了SOD 活力, 降低了MDA 水平 (图2),量-效关系明显。 SXBRh 组新西兰兔的SOD 活力相比于SXBRc 组显著增加了91.70%(P =0.003),MDA 含量相比SXBRc 组显著降低了80.62%(P =0.010)。 由此可见,饲料中添加SXBR 可显著增加新西兰兔的血清抗氧化因子水平, 降低机体脂质过氧化水平。

图2 各组抗氧化指标检测结果
2.4 SXBR 对肠道微生态的影响 肠道菌群稳态是机体健康的基础之一, 特别是肠道菌群代谢是肠道消化代谢过程的重要一环。 为探讨SXBR对肠道菌群的影响, 本研究分别对各组新西兰兔粪便样本进行16S rRNA 以及ITS1 进行基因测序分析。 韦恩图分析表明各处理组细菌群落大体相似,共有OTU 数量约占总数的60%(图3A);而真菌各组之间相差较大,可能与OTU 数量较少而个体差异较大有关(图3B)。
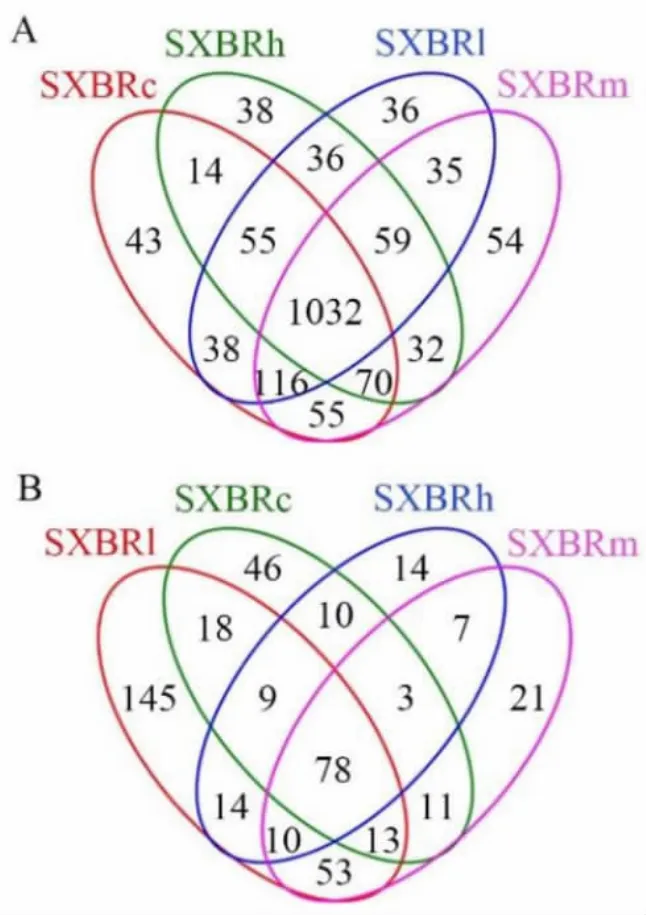
图3 各组细菌(A)和真菌(B)的OUTs 韦恩图
SXBR 对新西兰兔肠道细菌群落结构影响有限,PCA 分析和聚类分析显示(图4A、图4B),各组肠道菌群结构无明显差异。 但PICRUSt 分析(图4C)显示,SXBR 可减弱肠道细菌多糖代谢和次级胆汁酸代谢通路, 增强氯代烷烃和氯烯烃降解以及抗生素合成和抗药性相关代谢通路。

图4 各组肠道菌群细菌种属差异分析
SXBR 对新西兰兔肠道真菌群落影响较细菌更为明显,PCA 分析和热图分析(图5A、图5B)表明各处理组之间群落结构差异明显, 特别是SXBRh 与SXBRc 的菌群轮廓完全分离。 采用LefSe 软件分析两组间各生物分类水平差异 (图5C、图5D),发现酵母纲(Saccharomycetes)酒精酵母属(Zygosaccharomyces)真菌在SXBR 处理组相对富集,而散囊菌纲(Eurotiomycetes)曲霉科(Aspergillaceae)以及锤舌菌纲(Leotiomycetes)小毛盘菌属(Cistella)真菌相对减少。
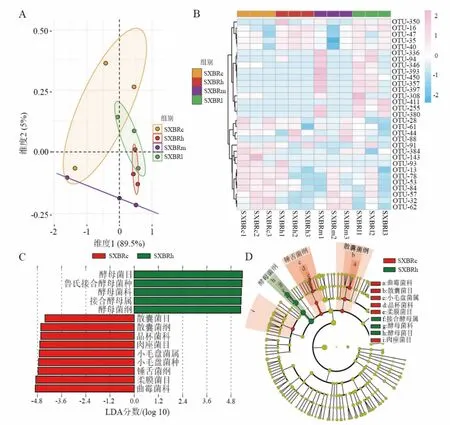
图5 各组肠道菌群真菌种属差异分析
2.5 SXBR 对新西兰兔骨髓造血的影响 由前述活性成分鉴定可知,SXBR 中存留丰富的药用成分,为考察其对新西兰兔造血功能的影响,本研究取各处理组股骨固定并进行骨髓细胞TUNEL检测。 由图6 可见,随着SXBR 的添加,新西兰兔骨髓中造血干细胞凋亡信号(绿色)明显减少。

图6 各组股骨骨髓细胞的TUNEL 检测
2.6 SXBR 添加饲料的安全性及对新西兰兔各项生理功能的影响 一种新型饲料资源的开发,其安全性往往是人们特别关注的问题。 SXBR 来源于中草药提取残渣, 其潜在的慢性毒性问题不容忽视。 为此,本研究在60 d 饲养周期之后从组织病理切片、血清生化指标、血清免疫球蛋白以及LPS 几个方面对其潜在毒性进行表征。 结果表明各组新西兰兔组织病理切片未见异常 (图7),血清生化结果表明除SXBRm 组 (P =0.007)和SXBRh 组 (P =0.024)UREA 含量比SXBRc 组显著降低23.23%、20.65%外, 其余各项指标各组间均无显著差异(表4)。 血清免疫球蛋白和LPS 测定发现, 各组IgA、IgG、IgM 以及反映肠道屏障功能的血清LPS 含量均无显著差异(表5)。

图7 各组组织病理切片显微图

表4 各组血清生化测定结果
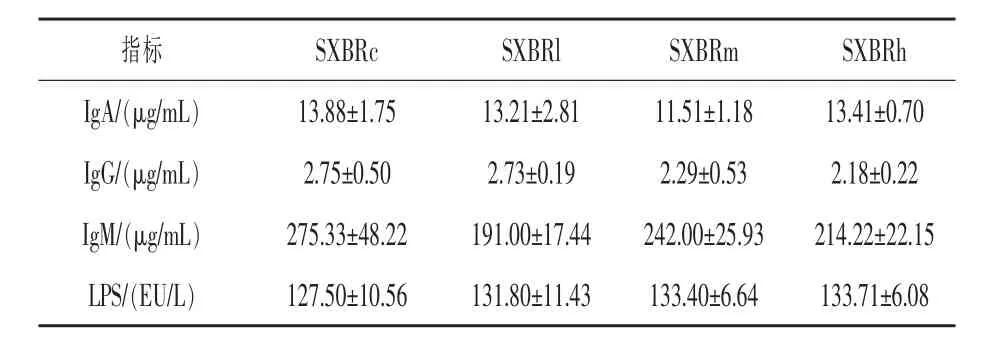
表5 各组免疫功能指标测定结果
综合以上数据, 认为在饲料中添加SXBR 并长期饲喂新西兰兔,对其心、肝、脾、肺、肾等主要脏器功能、免疫功能、肠道屏障功能均无明显损伤作用, 证明SXBR 作为食草动物饲料添加剂具有良好的安全性。
3 讨论
3.1 SXBR 营养价值可观并富含多种小分子活性成分 作为饲料原料或饲料添加剂, 需具备可观的营养价值以保证动物生长,维持机体健康。蒋苏苏等(2017)研究表明,添加5%的由白芍、太子参、牛蒡、党参和川芎组成的混合中草药渣,饲料的粗蛋白质、粗脂肪、磷含量明显高于未添加组。刘倩等(2022)发现,通脉颗粒药渣和咽炎片药渣的干物质含量分别达到了99.10%和71.86%,参茸补肾片药渣的粗蛋白质和粗脂肪含量也较为可观。 SXBR 是由七种药食同源中药材经水提后的产物,结合此前研究结果表明,其干物质、有机物、总能量及粗脂肪含量均大于多数常规饲料,总体与玉米相似, 具有相当可观的营养价值(于金高等,2022)。中草药渣因其来源特殊性,还残留有一部分药用成分,有促进动物生长、提高抗氧化应激能力、增强免疫力和调节肠道菌群等多种作用。据文献报道, 中草药渣中的残留活性成分超过30%(Lu 和Li,2021)。夏禹等(2022)采用响应面法使温莪术药渣的总姜黄素产率提升至6.38 mg/g, 且其抗氧化活性较强。李双等(2019)采用水提醇沉法及离子树脂柱提取纯化已经提取过三七皂苷的工业三七药渣中的三七素,三七素产率达0.72%,并且具有良好的凝血活性。 本研究结果表明,SXBR 中还富含三萜类、黄酮类等具有抗氧化、抗炎、抗菌活性的药用成分,有开发为功能性饲料添加剂的潜力。
3.2 SXBR 可促进新西兰兔体重增长,生产性能良好 动物养殖追求效益,以最短的时间、最少的成本换取更多的收益是增加养殖场利润、 节约粮食资源的有效途径。孙晓燕(2019)将发酵的香菇、金针菇、银耳等八种药渣应用于猪的养殖,发现药渣组猪的腹泻率及料重比显著降低。 Liang 等(2013)研究表明,黄芪、当归、白术药渣可显著提升绵阳的体重增长水平。 从本研究结果来看,SXBR 可有效促进动物体重增加,降低料重比,增加屠宰率,大大提高生产效益,这可能与其可促进有氧代谢,减少糖酵解和肌内脂肪沉积,增加肌内蛋白水平有关。
3.3 SXBR 可增强新西兰兔抗氧化应激能力,调节肠道菌群, 促进骨髓造血 动物受到诸如恶劣气候、 饲料配方改变和周围环境污染等外界刺激时,机体会出现代谢失衡并产生大量自由基。当自由基水平高于动物自身抗氧化能力时, 过量的自由基存于组织、细胞中,引起氧化应激反应,导致严重的氧化损伤,影响采食量,危害动物健康,降低生产力(Chauhan 等,2021)。 因此,在畜禽养殖中, 提倡选择抗氧化作用强的饲料来增加动物抗氧化应激能力。本试验结果表明,生血宝药渣可显著增强新西兰兔血清SOD 活力, 减少血清MDA含量,可见其抗氧化应激能力较为突出。
肠道菌群稳态是保证动物正常进食、体重增加的基础,其与动物免疫能力息息相关(Fetissov 等,2017)。 次级胆汁酸与肠道消化功能以及炎症的发生密切相关(Sinha 等,2020),而抗生素相关代谢主要参与肠道菌群群落相互竞争相互调节,SXBR 调节细菌这些代谢功能意味着其能够影响新西兰兔肠道消化代谢、 肠道炎症以及肠道内环境的稳定性。酒精酵母是一种能够利用纤维素等多糖类物质产生乙醇的真菌, 能够促进食草动物消化粗饲料。曲霉科和小毛盘菌属真菌主要存在于植物根际土壤,曲霉科真菌常见于根腐病植物根际,有些种属能够产生剧毒的真菌毒素。这些真菌的减少可能与新西兰兔肠道内环境改变有关,SXBR 或可减少食草动物肠道不良发酵和食物中毒的几率。
已有研究表明, 生血宝可用于由铁摄入不足、营养不良、 术后、 妊娠、 衰老等引起的各类贫血(Zhou 等,2021)。 由骨髓细胞TUNEL 检测结果可见,随着SXBR 的增加,新西兰兔骨髓凋亡细胞明显减少,与60 d 内动物体重增长的趋势一致,都能说明SXBR 可以促进动物造血和机体生长。据相关文献分析,SXBR 减弱凋亡很可能与其抗氧化作用有关(Meng 等,2020)。
3.4 SXBR 安全性良好 生血宝合剂是由七种药食同源中药材组成的补益类中成药,研究表明其安全性良好,且此前课题组对生血宝合剂提取液沉淀物的饲料化开发研究也未见异常 (于金高等,2022)。 本研究与此前研究结果一致,SXBR 对新西兰兔脏器形态、血清生化和免疫功能基本无影响。
4 结论
本试验结果表明,SXBR 营养价值高,含有丰富的小分子活性物质, 有开发为优质动物饲料的潜力。 SXBR 作为动物饲料其生产性能优良,能够促进新西兰兔生长, 同时有效提升动物抗氧化应激能力、调节肠道菌群结构,对机体器官形态和功能未造成不良影响,安全性良好。

