重组人糖蛋白激素β5/α2融合蛋白在CHO-S细胞中的表达纯化及功能活性分析
千爱君,萧耿苗,李 壮,梁志成,穆云萍,赵子建,李芳红
(1. 广东工业大学生物医药学院,2. 华南理工大学医学院,广东 广州 510006)
糖蛋白激素家族,包括促甲状腺激素(TSH)、促卵泡激素(FSH)、促黄体素(LH)和绒毛膜促性腺激素(CG),参与调节机体多项生理活动,包括生殖、生长和发育以及能量代谢[1-2]。2002年发现了一种新的糖蛋白激素,称为糖蛋白激素β5/α2 (glycoprotein hormone beta5/alpha2, GPHB5/GPHA2, CGH)[3]。它是一种促肾上腺皮质激素衍生的糖蛋白激素(corticotroph-derived glycoprotein hormone, CGH),由α(GPA2)和β(GPB5)亚单位组成,是人类中唯一含有这些特定亚单位的糖蛋白分子。研究表明,CGH能够刺激甲状腺,通过与细胞表面跨膜促甲状腺激素受体(thyroid stimulating hrmone receptor, TSHR)结合,激活腺苷酸环化酶,使细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)水平升高,进而发挥生物学效应[4]。值得注意的是,与TSH相比,CGH与TSHR的亲和力更强。此外,CGH的β亚基GPHB5基因高度保守,从低等无脊椎动物线虫到人类一直被保留[5]。虽然CGH的作用因物种而异,但在刺激甲状腺[6]、骨骼发育[7]、癌症[8]以及生殖[9]等调节过程中发挥重要的作用,是极具应用潜力的蛋白类候选药物。
有研究采用基因工程技术将具有生物学活性的功能蛋白分子(如细胞因子、激素、生长因子、酶等)与CG的β亚基羧基末端肽CTP基因融合表达,发现获得的融合蛋白不但具有常用重组卵泡刺激素(rFSH)的生物活性,还具有融合伴侣分子的特殊功能,显著延长药物在体内的半衰期[10]。
为了显著提高蛋白表达量及研究潜在的更长效的CGH制剂,本研究运用基因重组技术,首次将CTP与单链CGH有序连接,即融合蛋白氨基酸序列从N端到C端依次是GPHB5亚基、CTP、GPHA2亚基,得到重组人源CGH-CTP基因,进而构建pcDNA3.1-rhCGH-CTP表达载体,并于悬浮CHO-S细胞中大量表达,经亲和层析及离子交换层析纯化后,通过高表达TSHR基因的成熟脂肪细胞3T3-L1验证CGH-CTP蛋白生物学活性。该研究将为进一步探索CGH蛋白功能及研究长效hCGH奠定基础。
1 材料与方法
1.1 实验材料
1.1.1载体、菌株和细胞株 大肠杆菌E.coliJM109感受态细胞由本实验室保存;pcDNA3.1(-) 载体购于上海捷瑞生物工程有限公司;悬浮CHO-S细胞购于赛默飞公司;小鼠胚胎成纤维细胞3T3-L1由中国科学院干细胞库提供。

Fig 2 Scheme of 3T3-L1 cell differentiation experiment n=3)

Fig 3 Restriction endonuclease digestion of recombinant pcDNA3.1-GPHB5-CTP-GPHA2
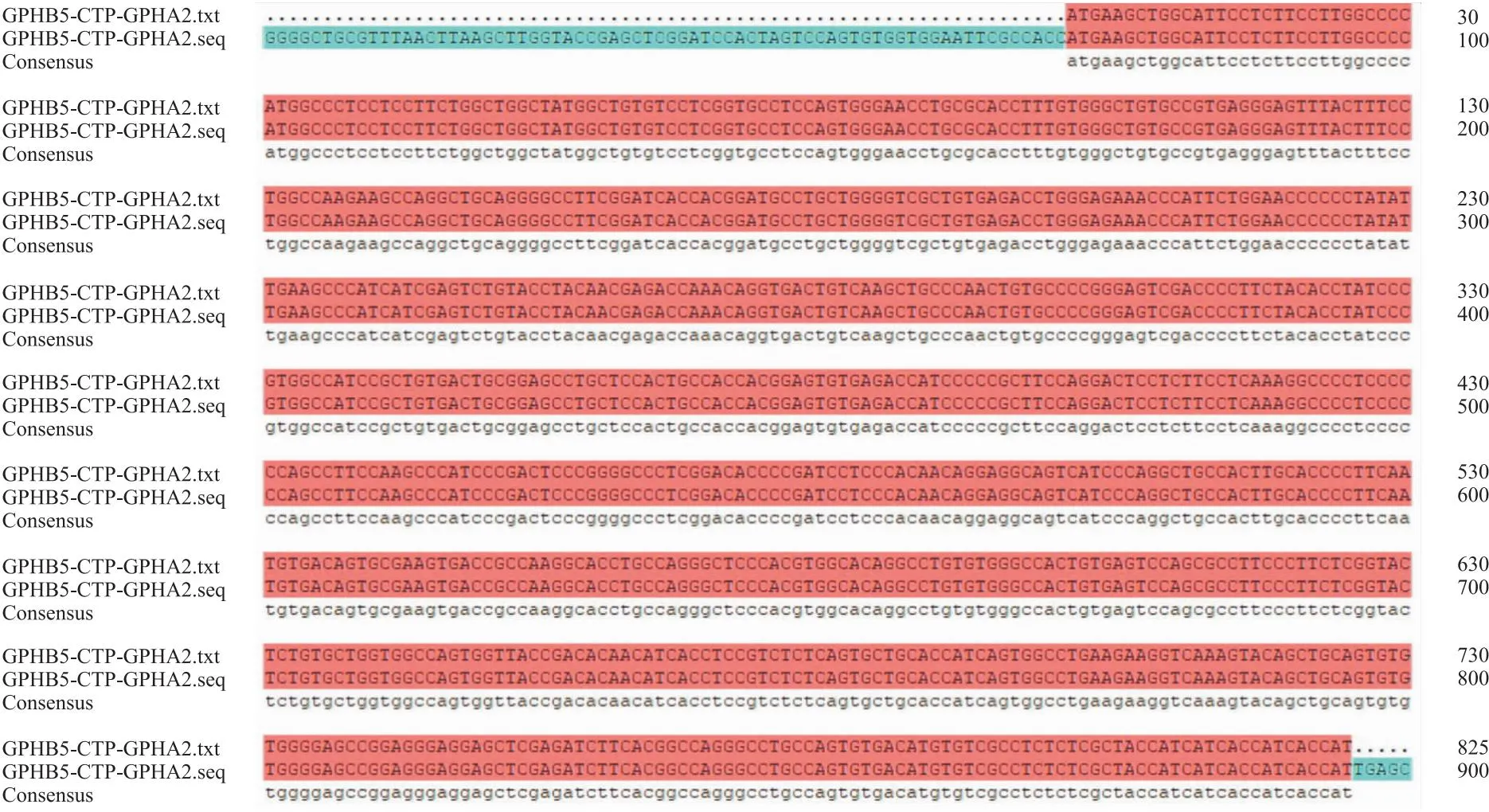
Fig 4 Sequence alignment of GPHB5-CTP-GPHA2
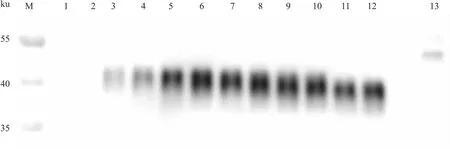
Fig 5 Western blot analysis of rhCGH-CTP expression in CHO-S cell culture supernatant
1.1.2试剂与仪器 限制性内切酶NotⅠ、EcoRⅠ、DNA Marker均购自TaKaRa公司;DMEM(12800017)和胰酶(25200072)均购自Gibco公司;新生牛血清(04-102-1A)购自BI公司;胎牛血清(164210-50×10)购自武汉普诺赛生命科技有限公司;PierceTMBCA Protein Assay Kit试剂盒(23225)、质粒中提试剂盒(K210005)、ExpiCHOTMExpression Medium (A29100-01)、ExpiFectamineTMCHO Transfection Kit(A29129)、OptiPROTMSFM (12309-050)均购自于赛默飞公司;His-Tag (D3I1O) XP® Rabbit mAb(12698S)抗体购自CST公司;含His标签的Recombinant Human alpha-Galactosidase A/GLA Protein(6146-GH)及cAMP Parameter Assay Kit(KGE002B)购于RD公司;饱和油红O染色液(G1260)购于北京索莱宝科技有限公司;SDS-PAGE蛋白考马斯亮蓝染色液(P0017F)购于碧云天公司;LB肉汤培养基(A500859-0005)及基因测序由上海生工生物完成;PrePack Ni-NTA purose 6FF(ZA41002-02)购于江苏千纯生物有限公司;HiTrapTMCaptoTMS 1 mL购于Cytiva公司;其余试剂均为分析纯。CO2细胞培养箱(ESCO/艺思高)、冰柜(美菱公司)、电泳和转印系统&化学发光凝胶成像系统(美国Bio-Rad公司)、低温离心机(美国Thermo)、-80 ℃冰箱(中国美菱)、AKTA pure 25L蛋白纯化系统(美国GE公司)。
1.2 实验方法
1.2.1重组hGPHB5-CTP-GPHA2真核表达载体的构建和鉴定 根据NCBI基因库获取hGPHB5(NCBI Gene ID: 122876)和hGPHA2(NCBI Gene ID: 170589)基因组序列委托上海捷瑞生物工程有限公司合成。通过连接肽CTP (GGGGS)3将hGPHB5的C端连接至hGPHA2的N端。利用NotⅠ、EcoR Ⅰ酶切位点亚克隆到pcDNA3.1(-) 表达载体,将该重组基因命名为rhCGH-CTP, 重组质粒命名为pcDNA3.1-rhCGH-CTP,其中基因合成及矢量构建均由上海捷瑞生物工程有限公司进行(Fig 1)。连接产物转化至大肠杆菌感受态细胞JM109,挑取转化子,提取质粒送生工生物工程(上海)股份有限公司完成测序。
1.2.2重组hCGH-CTP蛋白的表达和纯化 在37 ℃、8% CO2饱和湿度及附加摇床速度为109r·min-1的恒温培养箱条件下[11],CHO-S悬浮细胞在ExpiCHOTMExpression Medium培养基中培养和传代。待细胞生长密度达7×(109~1010) L-1时,将转染细胞稀释为6×109L-1,在ExpiFectamineTMCHO Reagent的介导下,取25 μg重组质粒pcDNA3.1-rhCGH-CTP转入CHO-S悬浮细胞中,转染20 h后分别添加150 μL ExpiCHOTMEnhancer和6 mL ExpiCHOTMFeed,继续培养。转染后,每24 h收集100 μL细胞混悬液直至CHO-S细胞活率显著降低。将收取的细胞混悬液4 ℃、12 000 r·min-1离心10 min以去除细胞碎片,收集培养上清液加入5×SDS上样缓冲液混匀,置于95 ℃金属浴中变性10 min,样品稀释100倍取10 μL进行Western blot检测,实验中使用的抗体为HRP标记的兔单抗His标签抗体。
5×SDS上样缓冲液混匀,置于95 ℃金属浴中变性10 min,样品稀释100倍取10 μL进行Western blot检测,实验中使用的抗体为HRP标记的兔单抗His标签抗体。
将培养6 d后的CHO-S细胞培养液离心后收集上清,上清经0.22 μm滤膜过滤,使用Ni2+柱在AKTA pure 25 L蛋白纯化系统上进行亲和色谱纯化, 用含有500 mmol·L-1咪唑的磷酸盐缓冲液(2 mmol·L-1KH2PO4, 10 mmol·L-1Na2HPO4, 2.7 mmol·L-1KCl, 137 mmol·L-1NaCl)梯度洗脱收集目的蛋白,置于3 ku超滤管中浓缩透析,利用SDS-PAGE分析纯化后蛋白纯度。再通过HiTrapTMCaptoTMS柱进一步纯化,用含有800 mmol·L-1NaCl的MES缓冲液梯度洗脱收集目的蛋白,并用BCA蛋白测定试剂盒对纯化后的蛋白进行定量。
1.2.3重组hCGH-CTP蛋白生物学活性检测 3T3-L1前脂肪细胞以每孔8×104细胞分至6孔板中,在含有0.5 mmol·L-1IBMX、1 μmol·L-1地塞米松及10 μmol·L-1胰岛素分化诱导剂的DMEM培养基诱导分化为具有明显脂滴的成熟脂肪细胞,3T3-L1细胞诱导分化实验过程及结果见Fig 2。
TRIzol法提取3T3-L1前脂肪细胞分化为脂肪细胞的-3、0、4、 6、 8、10 d的RNA, 定量检测 RNA浓度,逆转录合成cDNA,进行RT-PCR实验。反应条件为95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火延伸20 s,循环进行40次。采用△△CT法分析CT值,以 2-△△CT法计算TSHR基因表达。
以质量浓度分别为0、0.5、1、2 mg·L-1重组hCGH-CTP蛋白孵育细胞1 h,收取样品。利用ELISA试剂盒检测细胞内cAMP含量。

Tab 1 Sequence of Real-time PCR primers
1.2.4油红O染色 经不同浓度0.25、0.5、1 μmol·L-1重组hCGH-CTP蛋白处理3T3-L1细胞24 h后,用磷酸盐缓冲液(PBS)洗涤3次,用4%多聚甲醛固定10 min,蒸馏水充分洗涤,60%异丙醇浸洗,然后加入60%油红O染色工作液染色15 min,60%异丙醇分化至间质清晰,蒸馏水浸洗3次直至没有多余油红O染液残留。显微镜观察染色情况并拍照。在各孔中加入等体积异丙醇,室温静置10 min将油红O溶出,测量450 nm处的吸光度A值。
1.3 统计学分析所有数据均使用Prism 9.4.1进行统计学分析,两组间数据采用t检验。
2 结果
2.1 重组hGPHB5-CTP-GPHA2表达载体pcDNA3.1-rhCGH-CTP的鉴定重组表达质粒pcDNA3.1-rhCGH-CTP的PCR扩增产物经2%琼脂糖凝胶电泳分析,可见6333 bp的pcDNA3.1-rhGPHB5-CTP-GPHA2基因片段,大小与预期一致;经NotⅠ和EcoRⅠ双酶切,可见约5427 bp的载体片段和约906 bp目的基因片段(Fig 3),大小均与理论值相一致。将重组质粒送至上海生工生物进行测序, 测序结果与hGPHB5-CTP-GPHA2基因序列完全符合(Fig 4),表明重组表达质粒pcDNA3.1-rhCGH-CTP构建成功。
2.2 重组hCGH-CTP在悬浮CHO-S细胞中表达用重组质粒pcDNA3.1-rhGPHB5-CTP-GPHA2瞬时转染CHO-S悬浮细胞,每24 h收集100 μL细胞混悬液直至CHO-S细胞活率显著降低。通过Western blot实验验证hCGH-CTP蛋白表达分析结果(Fig 5),CHO-S的细胞发酵上清液在约40 ku处出现目的条带,说明rhCGH-CTP蛋白在CHO-S悬浮细胞中成
功表达。且随着CHO-S细胞培养时间的延长,细胞上清液中hCGH-CTP蛋白的表达量先升高后下降,其中以含有5 ng His标准品相对定量,计算出蛋白表达量可高达715.4 mg·L-1。
2.3 重组hCGH-CTP在悬浮CHO-S细胞中纯化利用AKTA pure 25L蛋白纯化系统首先对收取的重组蛋白进行Ni2+亲和色谱纯化(Fig 6A),并利用考马斯亮蓝染色SDS-PAGE验证纯化蛋白的纯度(Fig 6B),结果显示在170~300 mmol·L-1咪唑范围内梯度洗脱可获得纯度相对较高的重组蛋白。通过HiTrapTMCaptoTMS阳离子交换层析柱对蛋白进一步纯化(Fig 6C),结合SDS-PAGE图分析在230~390 mmol·L-1NaCl的MES缓冲液范围内梯度洗脱可获得纯度相对较高的目的蛋白(Fig 6D)。以上结果表明成功表达和纯化出了hCGH-CTP蛋白。
2.4 重组hCGH-CTP蛋白生物学活性检测在高表达TSHR基因的成熟脂肪细胞3T3-L1中(Fig 7A),不同浓度重组hCGH-CTP融合蛋白可刺激细胞内cAMP水平明显升高(Fig 7B),说明重组hCGH-CTP融合蛋白具有生物活性。
2.5 重组hCGH-CTP蛋白对3T3-L1成熟脂肪细胞内TG水平影响油红O染色结果显示,对照组脂肪细胞内充满红染大脂滴,少数细胞胞浆中有数颗小脂滴,说明对照组脂肪细胞内脂质含量多;与对照组相比,不同浓度rhCGH-CTP蛋白刺激24 h后,脂肪细胞内大脂滴数量明显减少,其中1 μmol·L-1CGH剂量组中红染脂滴明显变小变密(Fig 8)。表明rhCGH-CTP蛋白可呈浓度依赖性降低脂肪细胞内TG水平。

Fig 6 Purification of hCGH-CTP recombinant protein

Fig 7 Biological activity of purified recombinant hCGH-CTP protein n=6)
3 讨论
肥胖和超重已经成为一种全球性流行病,影响了全球超过24亿人群的健康[12]。据世界卫生组织统计,全世界约有13%的成年人患有肥胖症。肥胖会引发代谢综合症并伴随一系列并发症,与2型糖尿病、心血管疾病、不孕不育、脂肪肝、以及多种癌症都紧密相关[13-16]。非遗传性肥胖和超重的主要原因是摄入和消耗的卡路里之间存在能量失衡,从而导致机体脂肪含量过多或脂肪分布异常。脂肪细胞具有很强的脂质存储能力,同一个脂肪细胞直径能长大20倍,理论上能存储近8 000倍的甘油三酯[17]。有报道指出[18],生长分化因子15及其受体可能成为治疗肥胖和消耗类疾病的新靶点。随着全球超重、肥胖和代谢综合征发病率的持续增加,我们必须提高对白色脂肪组织,尤其是内脏白色脂肪组织能量代谢利用的认知。本研究新发现的糖蛋白激素家族新成员CGH可为抗肥胖和抗代谢疾病药物提供一个良好的治疗窗口。
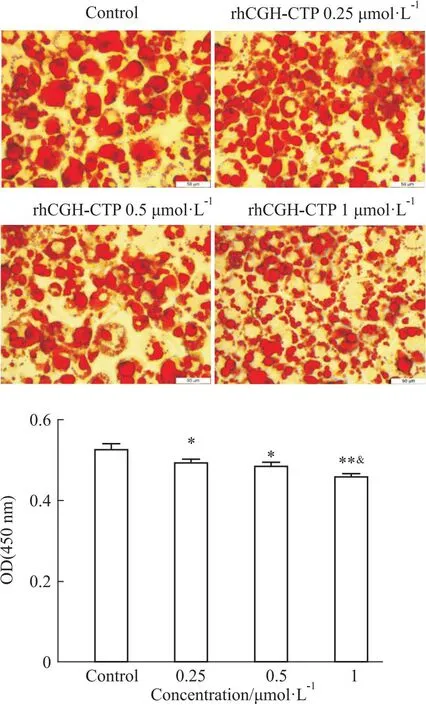
Fig 8 Effect of recombinant hCGH-CTP protein on fat accumulation in mature adipocytes 3T3-L1 (×400) n=3)
糖蛋白激素β5/α2是2002年新发现的一种异二聚体糖蛋白,存在于不同物种的各组织中,具有多功能性。从通过增加代谢率减肥到人类卵巢癌的进展,提示它是一个重要的信号分子。作为一治疗性蛋白,后续研究离不开高效的异源表达和具有更长半衰期的重组CGH。先前研究通过从组织中提取GPHB5及GPHA2全长cDNA,亚克隆至双启动表达载体pBudCE4.1,通过转染293T及COS-7细胞表达并纯化蛋白[4,7],虽然都成功验证了其蛋白生物学活性,但在贴壁细胞中表达量低及循环半衰期短的问题极大限制了其研究。因此,本研究采用CHO-S悬浮表达系统表达rhCGH-CTP,并验证其生物学功能活性。CTP技术的应用为延长蛋白质药物的半衰期提供了一种新的方法,利用重组技术将一段天然存在的28个氨基酸序列与蛋白质融合,增加唾液酸含量,唾液酸能增加黏蛋白的黏度,遮蔽蛋白上的糖链,使其不被糖苷酶水解,保护蛋白质免受蛋白酶降解;同时可提高蛋白糖基化程度,增加分子量使蛋白质排泄速度减慢。本研究通过合成人源CGH-CTP基因并在CHO-S细胞中成功进行外源性表达且具有生物学活性,但目前商业化CHO-S表达体系表达外源蛋白最高可达g·L-1,因此,我们仍需进一步优化实验条件提高rhCGH-CTP蛋白表达量。后续我们将进一步使用密码子优化算法设计最佳的编码序列并选择最合适的表达载体;调整表达条件参数来提高蛋白质的溶解度,如:温度(在转染24 h后将温度从37 ℃降至33 ℃培养)、培养基添加剂(添加生长因子;添加组蛋白脱乙酰基酶抑制剂,使染色质解聚并增加整合基因的转录活性)、优化纯化方法提高蛋白表达。
本研究旨在提出一种大量表达rhCGH-CTP蛋白方法,为进一步探索GPHB5/ GPHA2在代谢疾病中研究奠定基础。综上所述,在CHO-S细胞中成功表达并纯化rhCGH-CTP融合蛋白,且具有良好的生物学活性,并能有效降低脂肪细胞内甘油三酯含量。本研究所表达的CGH蛋白可作为一种潜在的减肥减脂分子靶标,在未来我们将进一步探索CGH蛋白在糖脂代谢方面的作用并在细胞层面探索其分子机理,本研究也为探索 CGH在其它领域作为治疗性蛋白提供重要基础。