槲皮素通过介导JNK信号通路抑制线粒体凋亡途径的神经保护作用
姚思凡,张 鑫,戴月英,沈丽霞
(河北北方学院药学院,河北省神经药理学重点实验室,河北 张家口 075000)
阿尔茨海默病(Alzheimer′s disease,AD)是一种原发性退行性脑病,根据经过流行病学调查的结果显示,AD发病情况在性别之间存在明显的差异,绝经后妇女相较于同龄男性,患上AD的几率要高1.5~3.0倍。多年来,医学界经常采用人工合成的雌激素替代治疗方法来降低患上AD的风险,这种治疗方式已经被证明能够使风险降低50%,由于雌激素可能会增加患上生殖系统肿瘤和乳腺癌的风险,因此人们一直在寻求更安全的替代物来代替雌激素的应用。槲皮素(quercetin,Que)是与雌激素近似的植物雌激素类[1]。课题组前期研究显示,Que雌激素样作用对PC12细胞起神经保护效应[2]。
AD作为一种多因素疾病,线粒体功能障碍在AD的发病机制中扮演着早期事件的角色,甚至在临床症状出现之前就已经发生[3]。JNK可被应激、辐射和生长因子等多种细胞外刺激激活,介导多种细胞功能,如凋亡、自噬、增殖、侵袭和迁移[4]。近年来,研究发现JNK信号通路在细胞凋亡过程中有着重要的作用[5]。JNK诱导细胞凋亡的分子机制可能涉及线粒体介导的细胞凋亡通路的参与,且JNK信号通路与雌激素之间亦存在联系,JNK信号通路既参与了线粒体的凋亡[6-7],也有通过雌激素来调控细胞凋亡[8],针对JNK的治疗策略有望改善AD。
本实验分别从雌激素受体α/β拮抗剂MPP/PHTPP和JNK特异性抑制剂SP600125入手,研究Que通过对Aβ25-35诱导的PC12线粒体途径的凋亡,并探讨其保护作用及机制,为发展AD防治药物提供新的思路和策略,同时为探索植物雌激素调节剂在绝经后女性AD防治中替代雌激素的临床应用提供实验基础。
1 材料与方法
1.1 材料PC12细胞购自中国科学院昆明细胞库。MPP(批号:sc-204098)和PHTPP(批号:sc-204191)购自Santa Cruz公司;DAPI 染色液(批号:S0001)、Aβ25-35Peptide(批号:Y0044)、Goat Anti-Rabbit IgG H&L/HRP antibody(批号:bs-0295G-HRP)购自北京博奥森生物技术有限公司;Que(批号:100081-201610)和金雀异黄素(genistein,Gen批号:111704-201703)购自中国药品生物制品检定研究所;SP600125(批号:S5567)购自sigma公司;caspase 3活性检测试剂盒(批号:C1116)和Fluo-4 AM(批号:S1060)购自碧云天生物技术研究所;17β-E2(批号:ab120657)、Cytochrome C抗体(批号:ab133504)、Bim抗体(批号:ab32158)、羊抗兔荧光二抗(批号:ab150080)购自abcam公司;HRP-conjugated β-Actin Rabbit mAb(批号:AC028)购自abclonal公司;JNK antibody(批号:9252T)、Phospho-JNK (Thr183/Tyr185) Antibody(批号:9251s)、Bcl-W Rabbit mAb(批号:2724s)购自美国CST公司。
1.2 仪器CO2培养箱购自Thermo公司,Cytation5细胞成像微孔板检测仪购自BioTek公司,超速冷冻离心机购自sigma公司,倒置显微镜购自Nikon公司,FV3000激光共聚焦扫描显微镜购自OLYMPUS公司,化学发光成像系统购自Protein Simple公司。
1.3 方法
1.3.1Fluo-4 AM检测PC12细胞钙离子变化 将细胞以每个激光共聚焦小皿容纳2×104个的密度接种,每个小皿中加入1 mL的培养液,经过24 h将培养基吸出。实验分组为Control、Aβ组(终浓度为20 μmol·L-1)、Aβ+17β-E2(终浓度为0.1 μmol·L-1)、Aβ+Gen(终浓度为50 μmol·L-1)、Aβ+Que(40、60、80 μmol·L-1)。给药培养24 h后,避光加入Fluo-4工作液(终浓度为0.5 μmol·L-1) 1 mL,室温孵育20~30 min,去染色液,DPBS清洗3遍(每次5 min),激光共聚焦显微镜进行观察,快速采集图像,使用ImageJ软件分析结果。
1.3.2Rhodamine 123染色液检测PC12细胞线粒体膜电位变化 将细胞以每个激光共聚焦小皿容纳2×104个的密度接种,每个小皿中加入1 mL的培养液,经过24 h将培养基吸出。实验分组同“1.3.1”。各组给药24 h后,弃液,加入37 ℃预热的染色液(10 μmol·L-1) 1 mL,室温孵育20 min,DAPI染核5 min,以上两步需要避光,最后使用激光共聚焦显微镜快速采集图像,ImageJ软件分析结果。
1.3.3Caspase-3含量检测 将细胞以每个6孔板容纳5×105个的密度接种,每个小皿中加入2.5 mL的培养液,当细胞生长1~2 d,汇合度达70%-80%时,实验分组:①分组同“1.3.1”; ②在建立研究模型和进行药物干预之前,加入2 μmol·L-1的MPP/PHTPP,37 ℃孵育1 h,弃液,分组:Control、Aβ组、Aβ+中剂量Que(60 μmol·L-1)组、Aβ+MPP组、Aβ+中剂量Que(60 μmol·L-1)+MPP组、Aβ+PHTPP组、Aβ+中剂量Que(60 μmol·L-1)+PHTPP组,继续加药培养24 h。③在造模之前,加入10 μmol·L-1的SP600126预孵育培养1 h,分组:Control、Aβ组、Aβ+中剂量Que(60 μmol·L-1)、Aβ+SP600125组、Aβ+中剂量Que(60 μmol·L-1)+SP600125组,继续加药培养24 h。按照试剂盒说明书检测Caspase-3含量。
1.3.4细胞免疫荧光染色法检测PC12损伤细胞内蛋白的表达 将细胞以每个激光共聚焦小皿容纳2×104个的密度接种,每孔100 μL,37 ℃孵育4 h后,补液1 mL继续培养。实验分组同“1.3.1”,弃去培养液,固定细胞30 min,0.1%透化液透化细胞20 min,封闭液封闭2 h,p-JNK(1 ∶200),4 ℃过夜,TBST进行清洗3次(每次10 min),室温孵育荧光二抗(1 ∶500) 2 h,DAPI染核,PBST清洗,激光共聚焦显微镜下采集图像并分析。
1.3.5Western blot法细胞中ERα、ERβ、p-JNK、JNK、Bcl-W、Bim和Cytochrome C蛋白的表达 实验分组同“1.3.1”,收集各组细胞提取蛋白并进行进一步实验。加入一抗β-actin、ERα、ERβ、p-JNK、JNK、Bcl-W、Bim、Cytochrome C,4 ℃冰箱孵育过夜,室温摇床孵育二抗2 h,ECL曝光显影,ImageJ 软件分析条带灰度值。

2 结果
2.1 槲皮素对PC12细胞钙离子浓度变化的影响与正常对照组相比,Aβ25-35模型组钙离子荧光强度增强(P<0.01),细胞突触比正常对照组明显减少。钙离子大量外流,浓度升高,荧光值升高,说明Aβ25-35造成PC12受损。与Aβ25-35组相比,Aβ25-35与17β-E2、Gen和Que共培养后,钙离子浓度显著降低(P<0.01),其中在低、中、高剂量的Que中,中剂量Que作用效果最为明显(P<0.01)(Fig 1-1,Fig 1-2)。
2.2 槲皮素对线粒体膜电位的影响与正常对照组相比,Aβ25-35模型组线粒体膜电位的荧光强度明显增强(P<0.01),表明线粒体跨膜电位较低;阳性药17β-E2、Gen和不同浓度的Que与Aβ25-35共培养后,与模型对照组相比,荧光强度减弱(P<0.01)(Fig 2-1,Fig 2-2);各组线粒体跨膜电位明显升高,差异有统计学意义。提示,Que可调节Aβ25-35诱导PC12细胞导致的线粒体跨膜电位降低,从而保护细胞。
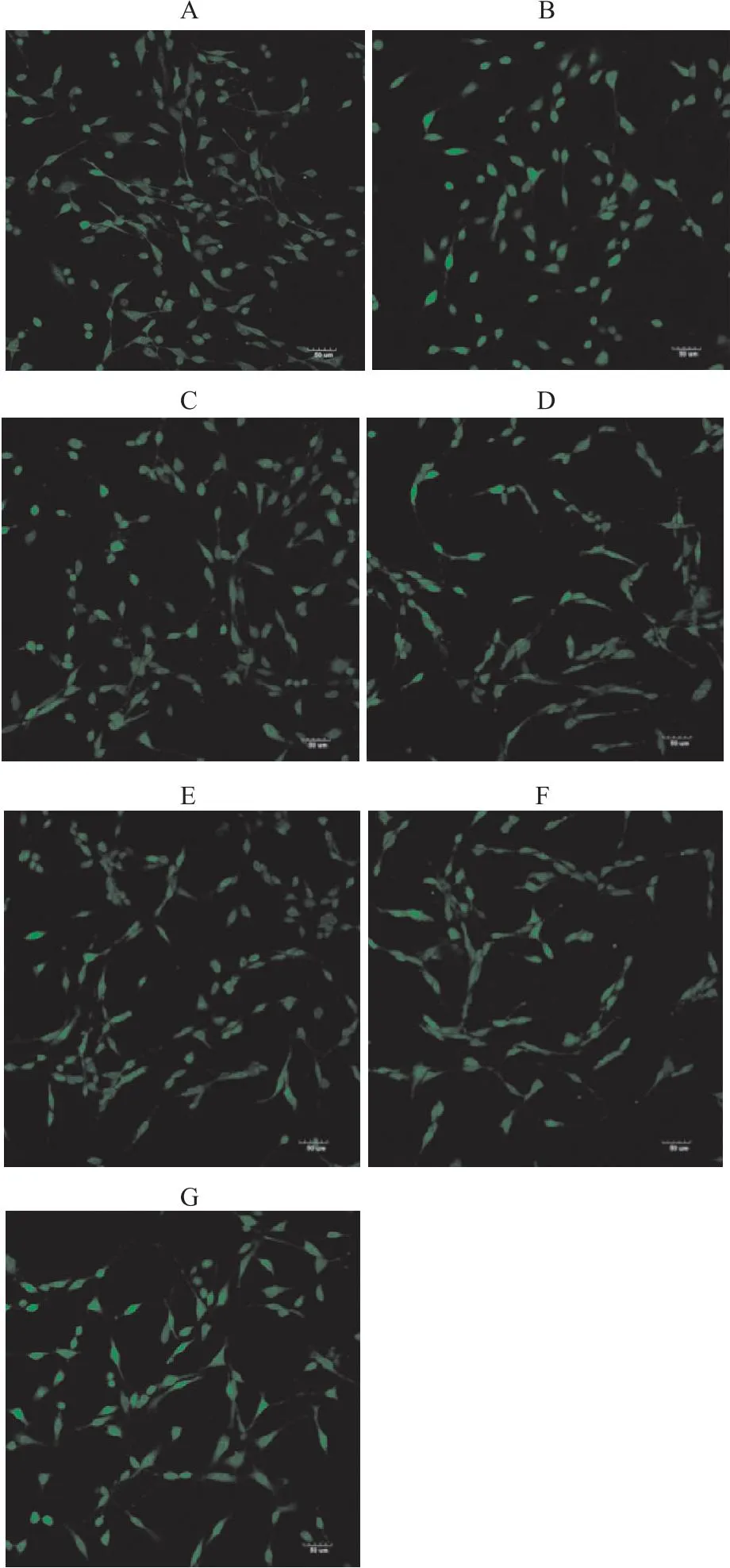
Fig 1-1 Immunofluorescence map of effect of Que on Ca2+ concentration in PC12 cells induced by Aβ25-35 (×200)

Fig 1-2 Effect of Que on Ca2+ concentration in PC12 cells
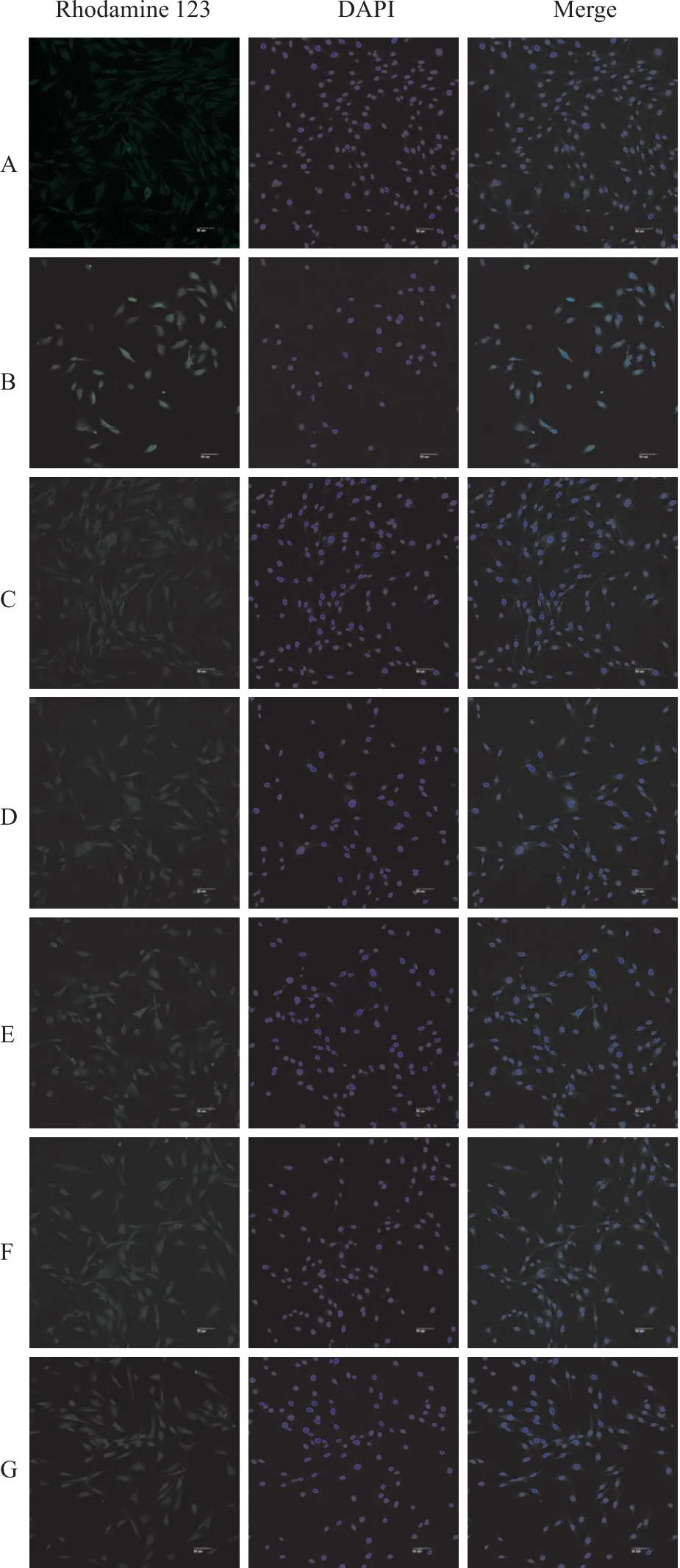
Fig 2-1 Immunofluorescence of Que on mitochondrial membrane potential in PC12 cells (×200)
2.3 槲皮素对PC12细胞Caspase-3表达的影响与正常对照组相比,Aβ25-35处理PC12细胞24 h后Caspase-3含量升高(P<0.01)。与Aβ25-35组相比,阳性药17β-E2、Gen和低、中、高剂量的Que与Aβ25-35共培养后,Caspase-3含量降低(P<0.01),其中在低、中、高剂量的Que中,中剂量Que作用效果最为明显(P<0.01)。
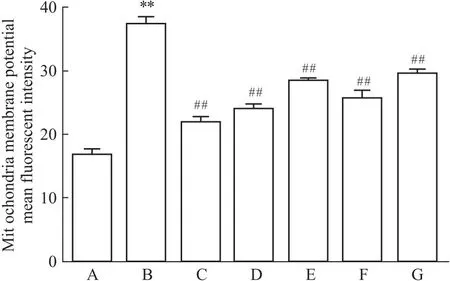
Fig 2-2 Immunofluorescence analysis of Que on mitochondrialmembrane potential of Rhodamine 123-labeled
ERs抑制剂组中结果表明,与Aβ25-35模型组相比,Aβ25-35+中剂量Que组细胞Caspase-3水平显著提高(P<0.01),Aβ25-35+中剂量Que+MPP组Caspase-3与Aβ25-35+中剂量Que组相比明显上升,差异具有统计学意义(P<0.05)。表明MPP可阻碍Que对PC12细胞Caspase-3表达的抑制。
SP600125抑制剂组中结果表明,与Aβ25-35模型组相比,Aβ25-35+中剂量Que组和Aβ25-35+SP600125组Caspase-3水平降低(P<0.01)。表明,SP600125可抑制Aβ25-35诱导的PC12细胞Caspase-3表达的增加,而且相比于单独Que组,Que和SP600125两者合用效果最强(Fig 3)。
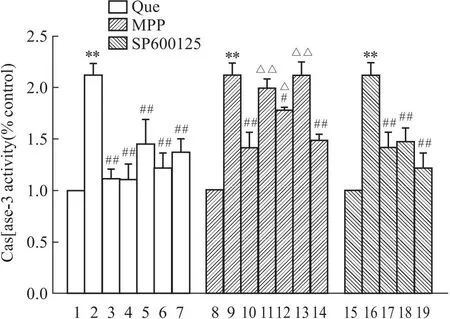
Fig 3 Effect of Que ,MPP ,SP600125 on Caspase-3
2.4 槲皮素对PC12损伤细胞内p-JNK荧光强度表达的影响Aβ25-35处理后增强p-JNK荧光强度(P<0.01),Aβ25-35与17β-E2、Gen和Que共同处理组p-JNK荧光强度减弱(P<0.01),表明,Que可通过影响JNK磷酸化表达发挥对PC12损伤细胞的保护作用(Fig 4-1,Fig 4-2)。

Fig 4-1 Aβ25-35 induced change of p-JNK immunofluorescenceintensity in PC12 cells(×200)
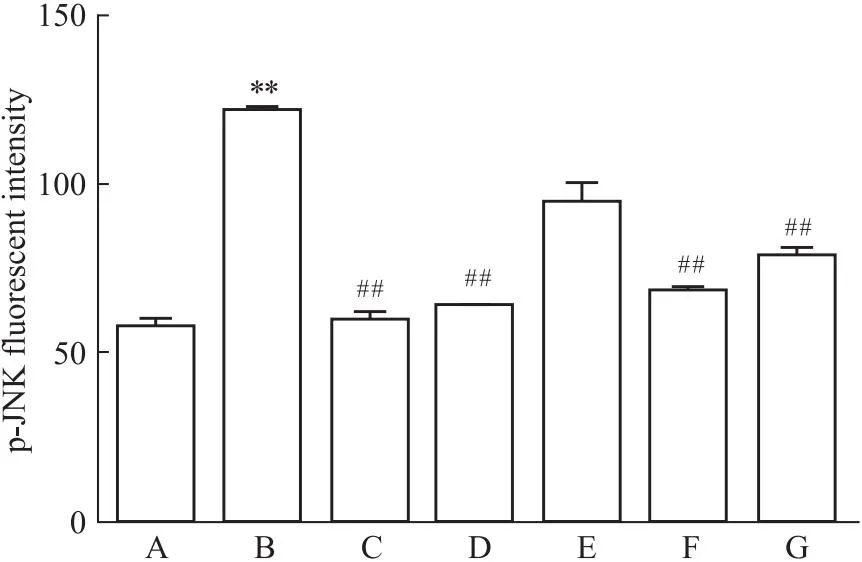
Fig 4-2 Effect of Que on fluorescence expression
2.5 槲皮素对PC12损伤细胞蛋白表达的影响与正常对照组相比,Aβ25-35组ERα表达降低(P<0.01)。ERβ表达差异无统计学意义(P>0.05)。与Aβ25-35模型组比较,阳性药17β-E2、Gen和不同浓度的Que与Aβ25-35共培养后,ERα表达明显上调(P<0.01)。药物组ERβ表达与Aβ25-35模型组相比,无差别(P>0.05)。与正常对照组相比,Aβ25-35模型组p-JNK的两个亚型表达均有升高,差异明显(P<0.01),而JNK两个亚型的表达均不明显(P>0.05)。与Aβ25-35模型组比较,阳性药E2、Gen和低、中、高剂量的Que与Aβ25-35共培养后,p-JNK的两个亚型的表达明显下降(P<0.01)(Fig 5-1,Fig 5-2,Fig 5-3)。
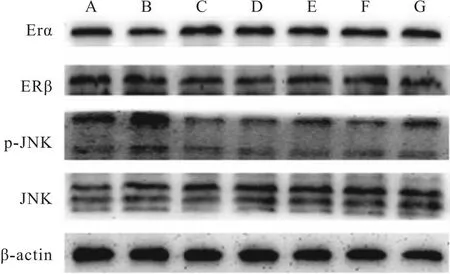
Fig 5-1 Detection of protein levels of ERα,ERβ,p-JNK and JNK by Western
与正常组相比,Aβ25-35作用细胞24 h后升高Bim、Cyt C表达(P<0.05),抑制Bcl-W表达,差异明显(P<0.01),SP600125预处理1 h后,Aβ+SP600125组与Aβ组相比,Bim、Cyt C表达降低(P<0.01),Bcl-W表达升高(P<0.01),差异具有统计学意义。同时,在Aβ损伤的情况下,相比于单独Que组所起的保护作用,Que和SP600125两者合用效果最强。表明Que可通过JNK信号通路抑制Aβ25-35诱导的线粒体凋亡(Fig 5-4,Fig 5-5)。
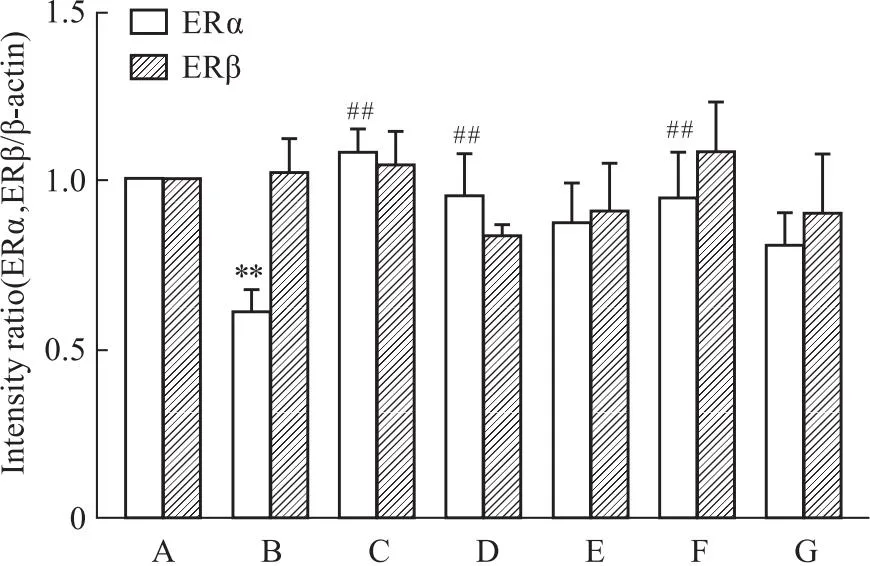
Fig 5-2 Quantification analysis of ERα,ERβ
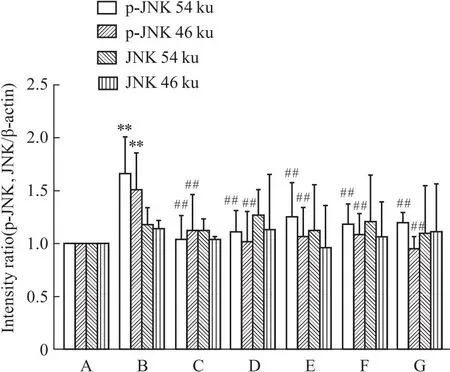
Fig 5-3 Quantification analysis of p-JNK ,JNK
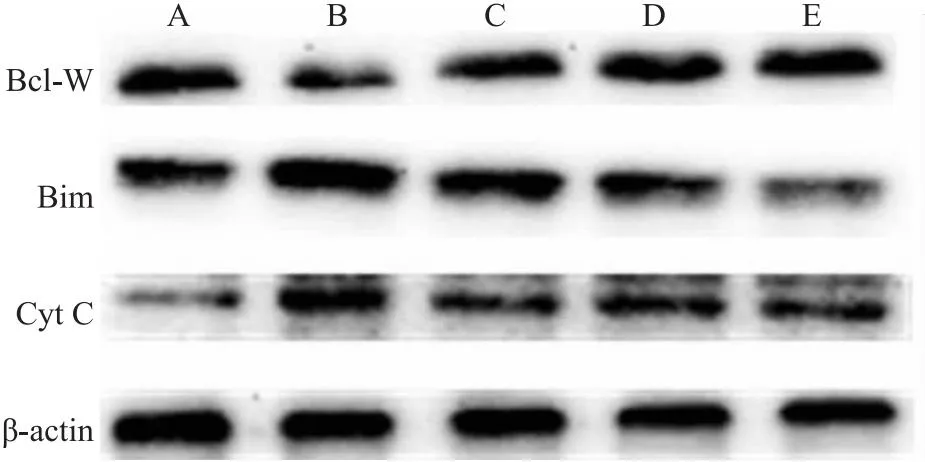
Fig 5-4 Effect of SP600125 on protein levels of Bcl-W,Bimand Cyt C in PC12
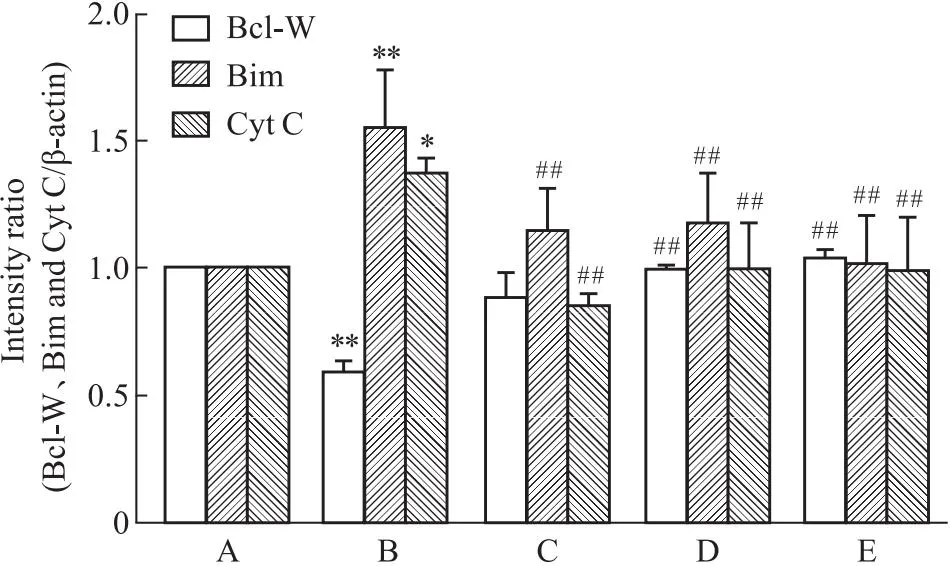
Fig 5-5 Effect of SP600125 on protein level of Bcl-W,Bimand Cyt C in PC12
3 讨论
雌激素受体分为雌激素受体α(ERα)和雌激素受体β(ERβ),课题组前期研究Que与雌激素受体之间的关系,加入雌激素受体拮抗剂ICI 182780干预后,结果显示Que主要通过ERα起到雌激素样神经保护作用[9]。进一步研究雌激素受体拮抗剂在AD模型中的应用,采用了Aβ25-35来诱导PC12细胞的损伤,并分别使用了ERα拮抗剂MPP和ERβ拮抗剂PHTPP进行干预。结果显示,Que展现出对AD体外模型中的细胞损伤有较好的改善作用,并显示出类似于雌激素的神经保护特性。
AD患者大脑中存在线粒体异常,线粒体功能障碍被认为是该疾病的早期和显著特征,甚至在认知障碍出现之前已经观察到[10]。线粒体功能损伤是AD常见现象,与Aβ有关。因此,改善线粒体损伤已成为AD预防和治疗的重要问题。AD神经元丢失主要通过凋亡方式进行,其中线粒体途径凋亡起关键作用,涉及Caspase-9参与的线粒体通路和Caspase-3参与的神经元凋亡过程。钙离子与细胞凋亡之间存在紧密关联,线粒体内钙离子水平的升高会导致线粒体受损,进一步激活caspase,促进细胞凋亡[11]。本实验结果显示,Que能够稳定线粒体跨膜电位,细胞内钙离子降低,抑制Caspase-3,减少Cyt C,发挥神经保护作用,本研究的结果与以前的研究一致,表明Que在一定程度上对细胞线粒体具有保护作用[12]。当凋亡信号刺激细胞,Bcl-2家族含量失衡,亦会改变线粒体膜通透性,促使线粒体膜电位下降或者消失,Cyt C促凋亡蛋白从线粒体释放,活化细胞凋亡的主要执行者Caspase-3[13]。本实验显示,Que可以逆转 Aβ25-35引起的Bcl-W和Bim蛋白水平的表达,有效降低胞质中Cyt C和Caspase-3的水平。表明Que可通过线粒体途径减弱Aβ25-35的神经毒性,发挥神经保护作用。
c-Jun N-末端激酶(JNK)在细胞内外应激下对平衡细胞生存和死亡起着关键作用。在本实验中,经Aβ25-35诱导PC12细胞后,Caspase-3活性的相对变化,说明使用JNK特异性抑制剂SP600125进行干预后,抑制了Aβ25-35导致的细胞活性下降,起到神经保护作用,由此也说明了JNK信号通路参与了细胞凋亡的过程[14],其中Que和SP600125两者合用保护效果更强。当细胞受到刺激时,活化的JNK会从细胞质迅速转移到细胞核内,并导致基因表达的变化[15]。活跃的JNK也会定位到线粒体上。JNK在线粒体上的磷酸化作用可以影响Bcl-2和Bcl-xL等抗凋亡蛋白的功能,导致线粒体膜的通透性发生改变,激活caspase等特定的蛋白酶,这些蛋白酶是细胞凋亡过程中的关键执行者,它们能够引发细胞内部的一系列级联反应,最终导致细胞凋亡的发生。因此,JNK在细胞凋亡中发挥了重要的作用,它通过转位到线粒体上,拮抗其抗凋亡活性,释放Cyt C,激活Caspase-9和Caspase-3,进而引发细胞凋亡的过程。本实验结果显示,SP600125预处理组Bim和Cyt C表达增多,抗凋亡因子Bcl-W表达下降。表明JNK信号通路参与了Aβ25-35介导的PC12细胞线粒体凋亡途径,SP600125抑制JNK磷酸化表达,可逆转Aβ25-35诱导的细胞凋亡。另外,本实验通过免疫荧光法和Western blot法标记了p-JNK,结果揭示了给予药物共培养后,Aβ25-35诱导的JNK的磷酸化表达被显著抑制。以上表明Que可能通过对JNK信号通路的调节作用抵抗Aβ25-35诱导的细胞线粒体凋亡通路。
综上所述,Que通过抑制JNK信号通路,对线粒体途径凋亡起到了神经保护作用。这为开发Que及其类似物作为潜在的治疗神经退行性疾病的药物奠定了基础。Que有望作为AD的潜在治疗药物,并探索其临床应用的潜力。