EGFR抑制剂AG1478联合奥沙利铂抑制PI3K/AKT通路促进H1975细胞自噬的作用机制
黄金清,李 洋,韦东雪,江 山,江绍锋
(桂林医学院基础医学院,广西肿瘤免疫与微环境调控重点实验室,广西 桂林 541199)
根据国家癌症中心数据显示,2022年全国癌症患者中肺癌死亡人数最多,其中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%[1]。NSCLC临床上常采用外科手术切除治疗,但在切除手术后也可能会出现癌症复发[2-3]。此外,常用含铂类和紫杉类药物化疗联合治疗,但其效率较低,且易发生耐药性[4-5]。NSCLC最常见的突变是表皮生长因子受体(EGFR)发生突变,而AG1478作为一种EGFR酪氨酸激酶抑制剂,通过竞争性结合EGFR结构域中ATP结合位点,阻断信号传导从而达到抑制肿瘤的效果[6]。奥沙利铂 (oxaliplatin,OXA)是第三代抗肿瘤铂类化疗药,同前两代铂类化疗药一样存在临床耐药的问题,而联合治疗成为OXA解决这一问题的有效手段[7]。韦东雪等[8]研究表明,AG1478可增加结直肠癌细胞对OXA的药物敏感性。自噬是细胞质物质被运送到溶酶体进行降解的过程,在控制细胞代谢中起着至关重要的作用[9]。自噬在肿瘤细胞中的作用是一把双刃剑,它既可以抑制肿瘤也可以促进肿瘤的发生[10]。Lu 等[11]研究发现,人PINK1基因( PTEN induced kinase 1,PINK1) 是肺癌的不良预后因子,通过调节自噬促进肺癌细胞的增殖。Zhang 等[12]研究表明,lncRNA PANDAR作为一种肿瘤抑制因子,通过上调 BECN1表达来激活自噬和凋亡途径,从而抑制NSCLC细胞的增殖,这表明自噬与肺癌的发生发展及治疗密切相关。因此,本文探究AG1478联合OXA对NSCLC H1975细胞自噬的影响,以期为临床应用于NSCLC治疗提供数据基础与理论依据。
1 材料与试剂
1.1 细胞株人肺癌细胞H1975购自中国科学院细胞库。
1.2 药物与试剂OXA购自索莱宝(货号08390);AG1478购自Med Chem Express(货号HY-13524);PI3K抑制剂LY294002购自MCE(货号HY-10108);N-乙酰半胱胺酸NAC购自MCE(货号HY-B0215);MTT购自索莱宝(货号M8180);ECL极敏化学发光试剂购自Affinity(货号);一抗(PI3K、p-PI3K、AKT、p-AKT、Beclin-1、LC3,ABcam)。
2 方法
2.1 细胞培养采取青-链霉素 ∶胎牛血清 ∶DMEM基础培养基为1 ∶10 ∶89的DMEM完全培养基在培养条件为37℃,5% CO2的培养箱进行孵育培养H1975肺癌细胞(以下培养条件相同)。后续实验研究取对数生长期细胞进行。
2.2 MTT法检测药物半数致死浓度
2.2.1检测OXA以及AG1478对H1975肺癌细胞药物半数致死浓度 将对数生长期H1975肺癌细胞以5×107个/L密度、每孔100 μL接种至96孔板中,培养至细胞贴壁后,再分别更换成100 μL含OXA培养基(0、25、50、75、88、100、112、125、150 μmol·L-1)或者含 AG1478培养基(0、5、10、15、20、25、30、35、40 μmol· L-1)。更换为含药培养基48 h后,每孔避光快速加入10 μL MTT溶液,培养箱中避光孵育4 h,每孔避光快速加入150 μL DMSO,在酶标仪(490 nm)处测定吸光度。
2.3 分组给药根据实验结果进行分组:Control组(不含药)、OXA-25、OXA-50、OXA-100(OXA浓度分别为25、50和100 μmol·L-1的培养处理)、AG-20(AG1478浓度为20 μmol· L-1的培养处理)和OXA-25+AG-20(以OXA浓度为25 μmol· L-1和AG1478浓度为20 μmol·L-1的培养联合处理)。
2.4 H2DCFDA检测ROS水平以3×108个/L细胞密度将H1975细胞均匀接种于6孔板中,每孔2 mL培养基。细胞贴壁后,实验分组同“2.3”项。加药48 h后,PBS洗涤两次,加入1 mL含10 μmol· L-1H2DCFDA的培养基,放回培养箱孵育30 min,PBS轻柔清洗3次后加入适量胰酶消化,离心后PBS重悬细胞沉淀,将其以每孔5 000个细胞数接种于96孔板,用多功能荧光酶标仪进行分析(Ex/Em=488/525 nm)。
2.5 MDC法检测细胞自噬接种方式同“2.4”项。细胞贴壁后,细胞分组同“2.3”项。加药处理后,PBS洗涤2次,加入MDC染液,继续孵育30 min,洗涤液清洗3次,充分去除未进入细胞的MDC染液,胰酶消化后使用Assay Buffer重悬细胞沉淀,将其以每孔5 000个细胞数接种于96孔板,用多功能荧光酶标仪分析(Ex/Em=335/512 nm)。
2.6 Western blot法检测PI3K、p-PI3K、AKT、p-AKT、Beclin-1、LC3II蛋白表达水平接种方式同“2.4”项。细胞贴壁后,细胞分组同“2.3”项。加入含药培养基48 h后进行收集细胞进行裂解,收集蛋白上清液,并对各组蛋白进行定量。对定量好的蛋白进行电泳(选用10% SDS-PAEG),最终上样蛋白质量为10 μg。电泳分离结束后,对凝胶上的蛋白进行转印、封闭2 h、一抗4 ℃孵育过夜。封闭液用5%脱脂牛奶和TBST配制,一抗稀释比例为1 ∶1 000。次日用TBST洗涤3次(每次10 min)后,进行二抗孵育90 min(1 ∶10 000),用化学发光成像系统进行成像拍照分析。ImageJ计算各组蛋白表达量。

3 结果
3.1 OXA和AG1478分别作用于H1975细胞的半数抑制浓度(IC50)根据MTT实验检测不同浓度OXA、AG1478作用H1975细胞48 h后细胞活力,结果显示,与对照组比较,OXA对H1975细胞增殖有明显抑制作用,IC50值为70.86 μmol·L-1(Fig 1A);AG1478对H1975细胞增殖有明显抑制作用,IC50值为24.24 μmol·L-1(Fig 1B)。因此,后续研究中选择低于OXA半数抑制浓度的剂量(25 μmol·L-1)和低于AG1478半数抑制浓度的剂量(20 μmol·L-1)进行两药联合剂量研究。

Fig 1 Activity of AG1478 and OXA on H1975 cells measured by
3.2 OXA联合AG1478对H1975细胞ROS水平的影响通过ROS探针H2DCFDA检测H1975细胞ROS水平,实验结果显示,与对照组比较,OXA单药组 (OXA-25、OXA-50、OXA-100)、AG1478单药组及联合用药组 ROS水平升高,差异均有统计学意义(P<0.01,P<0.05,P<0.01)(Fig 2A);与对照组相比,联合用药组ROS水平升高,NAC处理组ROS水平降低,差异均有统计学意义(P<0.01)(Fig 2B);NAC为ROS清除剂,与联合用药组相比较,NAC预处理的联合用药组ROS水平下降(P<0.01);因此,AG1478与OXA联合使用明显升高H1975细胞内ROS水平,联合用药对ROS水平升高作用高于OXA单独用药。
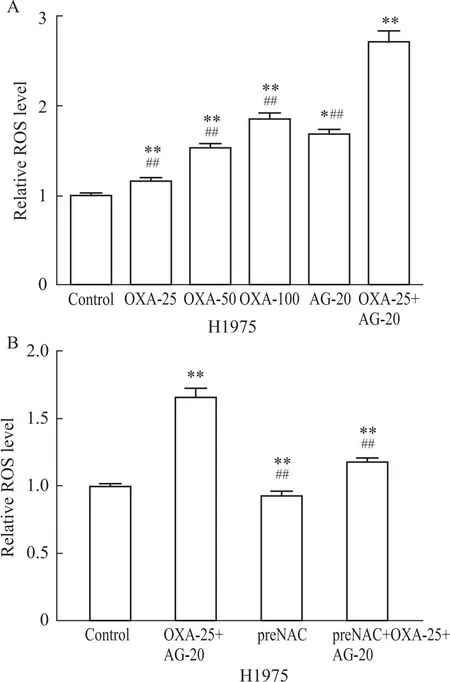
Fig 2 ROS levels on H1975 cells detected by
3.3 OXA联合AG1478对H1975细胞自噬水平的影响
3.3.1MDC法检测H1975细胞中的自噬水平情况 MDC实验结果显示,与对照组比较,OXA单药组(OXA-25、OXA-50、OXA-100)、AG1478单药组及联合用药组自噬水平升高, 差异均有统计学意义(P<0.01,P<0.01,P<0.01);与OXA单药组(OXA-25)比较,联合用药组自噬水平升高,差异均有统计学意义(P<0.01), 结果表明,单药组与联合用药组促进H1975细胞自噬水平的表达(Fig 3)。
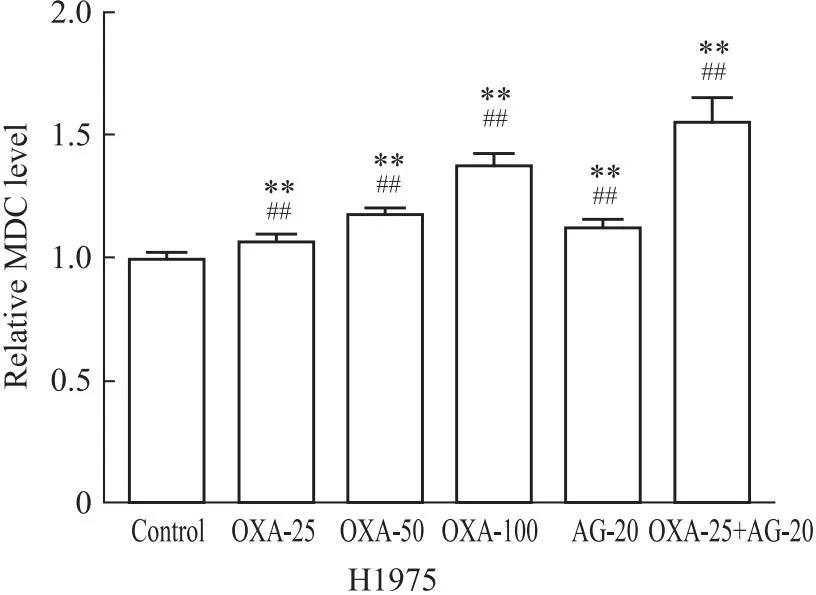
Fig 3 Intensity of autophagy fluorescence detected by MDC assay in H1975 cells n=3)
3.3.2Western blot法检测H1975细胞自噬相关蛋白表达情况 Western blot结果显示,与对照组比较,OXA单药组(OXA-25、OXA-50、OXA-100)、AG1478单药组及联合用药组Beclin-1、LC3Ⅱ的蛋白表达上调,差异均有统计学意义(P<0.05,P<0.05);与OXA单药组(OXA-25)比较,联合用药组Beclin-1、LC3Ⅱ的蛋白表达水平升高,差异均有统计学意义(P<0.05,P<0.01)(Fig 4), 结果表明,单药组与联合用药组均促进H1975细胞自噬蛋白LC3II、Beclin-1表达,同时AG1478促进OXA对H1975细胞自噬作用。
3.4 OXA联合AG1478对H1975细胞内PI3K信号通路的影响与对照组比较,OXA单药组(OXA-25、OXA-50、OXA-100)、AG1478单药组及联合用药组PI3K、p-PI3K、AKT、p-AKT蛋白表达均下调,差异均有统计学意义(P<0.01,P<0.05,P<0.05,P<0.05);与OXA单药组(OXA-25)比较,联合用药组PI3K、p-PI3K、AKT、p-AKT的蛋白表达水平均下降,差异均有统计学意义(均P<0.01);结果表明,单药组与联合用药组均抑制PI3K信号通路(PI3K、p-PI3K、AKT、p-AKT)的蛋白表达,同时AG1478增强了OXA抑制PI3K信号通路相关蛋白表达,见Fig 5。
3.5 OXA联合AG1478调控ROS对H1975细胞自噬蛋白Beclin-1和LC3Ⅱ表达的影响与对照组比较,联合用药组Beclin-1、LC3Ⅱ表达上调,差异均有统计学意义(P<0.01,P<0.01),应用10 μmol·L-1NAC预处理后,联合用药组Beclin-1、LC3Ⅱ上调水平被抑制,差异均有统计学意义(P<0.01,P<0.05),表明联合用药调控ROS水平升高进而促进H1975细胞自噬(Fig 6)。
3.6 OXA联合AG1478对H1975细胞自噬蛋白Beclin-1和LC3Ⅱ表达的影响与对照组比较,联合用药组Beclin-1、LC3Ⅱ表达上调,差异均有统计学意义(P<0.05,P<0.05),LY294002是一种广谱PI3K抑制剂,应用10 μmol·L-1浓度LY294002预处理后,联合用药组Beclin-1、LC3Ⅱ上调水平更明显,差异均有统计学意义(P<0.05,P<0.05);表明联合用药抑制PI3K信号通路激活进而促进H1975细胞自噬(Fig 7)。
3.7 OXA联合AG1478调控ROS对H1975细胞PI3K信号通路相关蛋白表达的影响与对照组比较,联合用药组PI3K、p-PI3K、AKT、p-AKT的蛋白表达均下调,差异均有统计学意义(均P<0.01);应用10 μmol·L-1NAC预处理后,联合用药组PI3K、p-PI3K、AKT、p-AKT下调水平被抑制,差异均有统计学意义(均P<0.01);表明联合用药调控ROS水平升高进而抑制PI3K信号通路的激活(Fig 8)。
4 讨论
OXA可诱导ROS生成,进而增强肿瘤初期进展中的化疗效果[13]。ROS是由一系列含氧的高活性物质如过氧化氢、自由基和氧阴离子组成,可导致细胞损伤[14-15]。Navarro-Yepes等[16]研究表明,ROS可以促进自噬的发生,而自噬与癌症抑制密切相关。PI3K/AKT信号通路是与磷脂酰肌醇有关的信号通路,参与调控癌细胞代谢、增殖、转录及蛋白质合成等多个生物学过程,在细胞生存中发挥重要作用[17]。为进一步验证自噬、ROS和PI3K信号通路之间的关系,我们利用NAC预处理后发现,ROS水平有所下降,OXA联合AG1478作用于H1975细胞对自噬的促进作用被抑制;当使用LY预处理后,PI3K水平有所下降,OXA联合AG1478作用于H1975细胞对自噬的促进作用被抑制;当使用NAC预处理后,ROS水平有所下降,OXA联合AG1478作用于H1975细胞对PI3K/AKT信号通路的抑制作用有所回升。
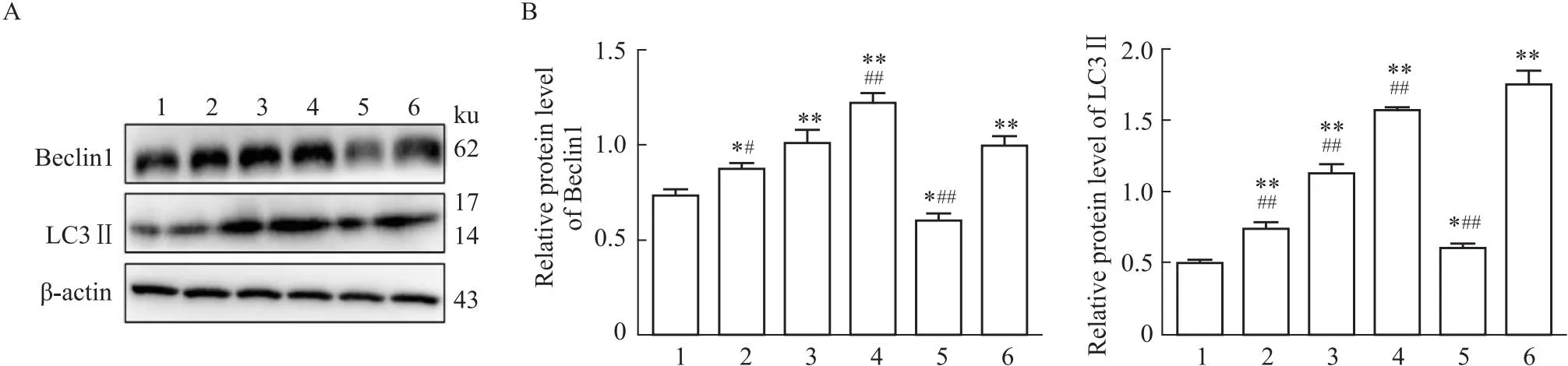
Fig 4 Effects of AG1478 combined with OXA on expression of Beclin-1 and LC3Ⅱ in H1975 cells n=3)
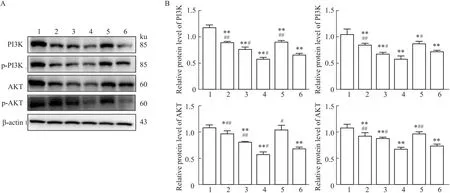
Fig 5 Effects of AG1478 combined with OXA on expression of PI3K, p-PI3K, AKT, p-AKT in H1975 cells n=3)

Fig 6 Effects of AG1478 combined with OXA on expression of Beclin-1 and LC3Ⅱ in H1975 cells regulated by ROS n=3)

Fig 7 Effects of AG1478 combined with OXA on expression of Beclin-1 and LC3Ⅱ in H1975 cells regulated by PI3K signaling pathway n=3)
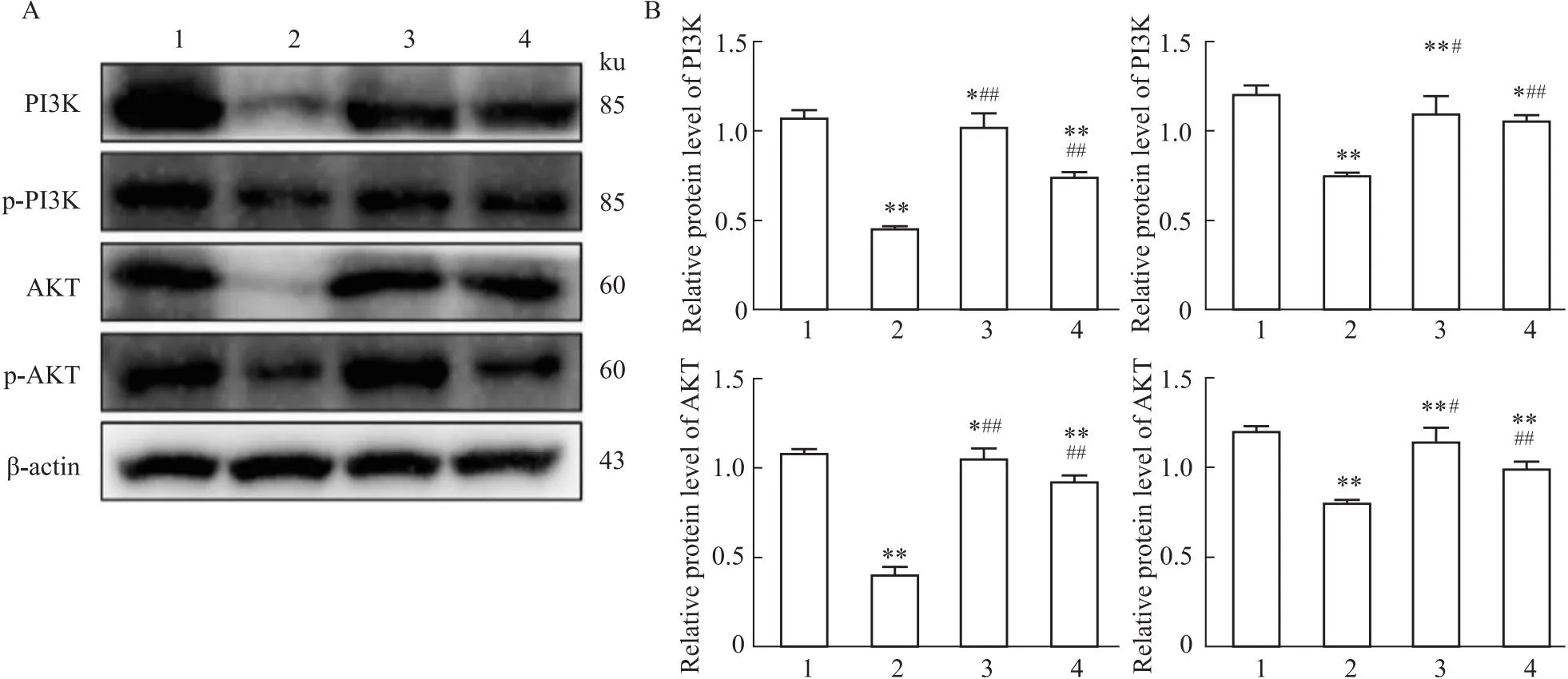
Fig 8 Effects of AG1478 combined with OXA on expression of PI3K, p-PI3K, AKT, p-AKT in H1975 cells regulated by ROS n=3)
综上所述,本实验通过AG1478联合OXA作用于NSCLC H1975细胞,探究了AG1478联合OXA对NSCLC H1975细胞自噬的影响,实验结果表明细胞内ROS水平升高,PI3K/AKT信号通路的激活被抑制,促进H1975细胞发生自噬。本研究结果为AG1478进一步开发为EGFR小分子抑制剂联合OXA抗NSCLC提供了实验数据基础与理论依据。