秋水仙碱对LPS诱导内皮间质转化的影响及机制
郭 俊,唐光能,赵 祺,曹 政,涂 强
(1.中国医学科学院阜外医院,北京 100037;2.十堰市太和医院,湖北 十堰 442000)
血管内皮细胞是裱衬于心、血管和淋巴管内表面的单层扁平上皮细胞,其在维持血管稳态方面具有重要作用[1]。内皮细胞在各种刺激因子的作用下,其内皮特性逐渐消失而获得间充质特性,这一过程被称为内皮间质转化(endothelial to mesenchymal transition, EndMT)。现有研究表明,EndMT与心血管疾病的发生发展密切相关,并且可能是内皮功能障碍与血管损伤之间的关键联系[2-3]。炎症在心血管疾病的发生发展中均扮演着重要的角色,而抗炎药物能够改善心血管疾病的预后。长久以来,秋水仙碱(colchicine, Col)作为治疗痛风和家族性地中海热的药物,具有良好的安全性及耐受性,并且已被证明对心血管疾病也有效[4]。然而,Col在调控EndMT方面的作用目前尚不明确。因此,本研究初步探讨Col对脂多糖(lipopolysaccharide, LPS)诱导内皮细胞EndMT的影响及其可能机制。
1 材料与方法
1.1 材料人脐静脉血管内皮细胞(human umbilical vein endothelial cells, HUVECs)购自中国科学院上海细胞所;ECM培养基购自美国Sciencell公司;Col(货号:C3915)、LPS(批号:L4391)购自美国Sigma公司;Transwell小室购自美国Corning公司;Matrigel胶购自美国BD公司;CCK-8检测试剂盒、LDH检测试剂盒、RIPA裂解液、BCA蛋白浓度测定试剂盒及SDS-PAGE凝胶配制试剂盒均为碧云天公司产;CD31、VE-cadherin、α-SMA、FSP-1、NF-κB p65、p-p65、IκBα和Snail抗体均购自CST公司;TransAMTMNF-κB p65比色试剂盒购自美国Active Motif公司;其他试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1CCK-8检测细胞活力 将HUVECs接种于96孔板中,在37 ℃条件下用Col(0.1、1、10、100 nmol·L-1)处理72 h。然后每孔中加入含有10 μL CCK-8的新鲜培养基100 μL,在37 ℃避光孵育3 h,使用多功能酶标仪测定450 nm处吸光度。
1.2.2细胞毒性检测 将HUVECs接种于96孔板,在37 ℃条件下用Col(0.1、1、10、100 nmol·L-1)处理72 h,使用细胞毒性测定试剂盒评估培养基中乳酸脱氢酶(LDH)的含量来反映细胞毒性。
1.2.3细胞培养与分组 参考既往方法[5],采用LPS处理HUVECs构建EndMT模型。将细胞随机分为4组:(1)正常对照组:不含LPS和Col的培养基培养细胞72 h; (2)正常对照+Col组:含10 nmol·L-1的Col培养细胞72 h; (3)模型组:含10 mg·L-1LPS培养细胞72 h;(4)LPS+Col组:含10 mg·L-1LPS联合10 nmol·L-1的Col共同培养细胞72 h。
1.2.4细胞形态学观察 各组细胞在处理72 h后,采用4%多聚甲醛室温固定10 min,之后采用倒置光学显微镜观察并记录各组细胞形态学变化情况。
1.2.5细胞迁移能力检测 用无血清ECM将5×104个HUVECs接种于Transwell小室的上室。然后,在下室中加入700 μL完全培养基。孵育24 h后,取出培养基,轻轻擦去滤网上未迁移的细胞。将迁移的细胞固定在4%多聚甲醛中,结晶紫染色10 min后于倒置显微镜下拍照并记录迁移细胞个数。
1.2.6Western blot检测蛋白表达情况 各组细胞处理72 h后采用含有蛋白酶抑制剂及RIPA裂解液裂解细胞,于4 ℃ 15 000 r·min-1离心15 min,并取上清采用BCA法测定蛋白浓度。蛋白经SDS-PAGE电泳,并转印CD31、VE-cadherin、α-SMA、FSP-1、NF-κB p65、p-p65、IκBα和Snail蛋白至PVDF膜上,用5% BSA封闭1 h,用相应的特异性一抗4 ℃孵育过夜,再经洗膜,然后孵育相应二抗室温1.5 h后再次洗膜,最后采用ECL化学发光法显影,经Image-Pro Plus 8.0软件进行吸光度测定,并与内参GAPDH吸光度相比较得到各组蛋白条带相对值。
1.2.7NF-κB p65活性检测 获取HUVECs核提取物后进一步按照TransAMTMNF-κB p65比色试剂盒说明检测NF-κB p65的DNA结合活性。

2 结果
2.1 Col对HUVECs细胞活力的影响为探讨Col最为合适的药物作用浓度,我们采用了CCK-8实验评估细胞活力,同时检测Col处理后HUVECs中LDH的释放情况来反映药物毒性。实验结果显示,与正常对照组相比,Col浓度在0.1~10 nmol·L-1范围的内对HUVECs细胞活力无明显影响且无明显毒副作用。因此,在后续实验中采用10 nmol·L-1的Col作为最佳处理浓度,见Fig 1。

Fig 1 Effects of colchicine at different concentrations on
2.2 Col对LPS诱导EndMT过程中细胞形态学的影响体外实验表明,LPS作用HUVECs 72 h可明显改变HUVECs形态,HUVECs由正常的扁平型转化为梭形及不规则性,提示LPS诱导EndMT的发生,而使用Col干预后细胞形态明显好转,由此表明Col可抑制LPS诱导的EndMT过程,见Fig 2。
2.3 Col对LPS诱导的EndMT过程中细胞迁移能力的影响采用Transwell小室法观察Col对HUVECs体外迁移能力的影响。与正常对照组相比,LPS组HUVECs迁移能力明显增加(P<0.05),与LPS组相比,Col干预组HUVECs体外迁移能力明显降低(P<0.05),见Fig 3。
2.4 Col对LPS诱导EndMT过程中小管形成能力的影响采用Matrigel检测Col对HUVECs小管形成能力的影响。结果表明,正常对照组相比,LPS组HUVECs小管形成能力明显减弱(P<0.05),与LPS组相比,Col干预组HUVECs体外小管形成能力明显增加(P<0.05),见Fig 4。
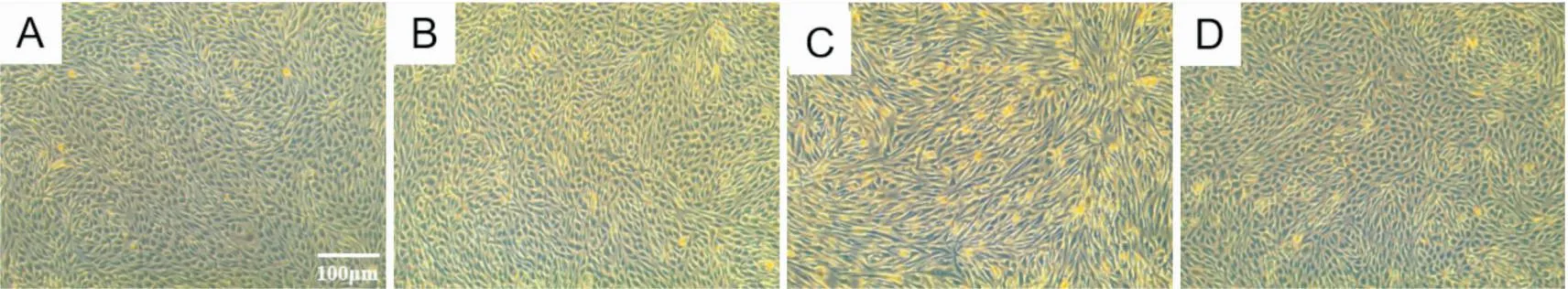
Fig 2 Effects of colchicine on cell morphology during LPS induced EndMT

Fig 3 Representative photographs and quantification analysis of migratory activity of n=3)
2.5 Col对LPS诱导EndMT标志物表达的影响EndMT过程中伴随内皮标志物的丢失及间质标志物的获得。本研究中我们检测了Col对内皮细胞特异性标志物CD31、VE-cadherin及间质细胞标志物α-SMA、FSP-1表达的影响。Western blot结果显示:LPS处理可明显下调CD31、VE-cadherin蛋白表达,同时上调α-SMA、FSP-1蛋白表达(P<0.05),而Col处理则逆转了这种效应(P<0.05),见Fig 5。
2.6 Col通过调控NF-κB/Snail信号通路抑制LPS诱导的EndMT各组HUVECs在处理72 h后检测NF-κB信号通路的变化情况。结果显示,与对照组相比,LPS处理之后NF-κB通路被显著激活,表现为p-p65上调,IκBα降解以及p65与DNA结合活性增加(P<0.05),而Col可抑制NF-κB通路的激活。Snail作为锌指蛋白转录因子,在调控EndMT过程中起到至关重要的作用[6]。在本研究中我们发现,LPS激活NF-κB信号通路后可上调Snail表达,而NF-κB抑制剂(TAK-243)和Col均可明显降低Snail蛋白表达水平(P<0.05)。以上结果证实:Col通过调控NF-κB/Snail信号通路改善LPS诱导的EndMT,见Fig 6。
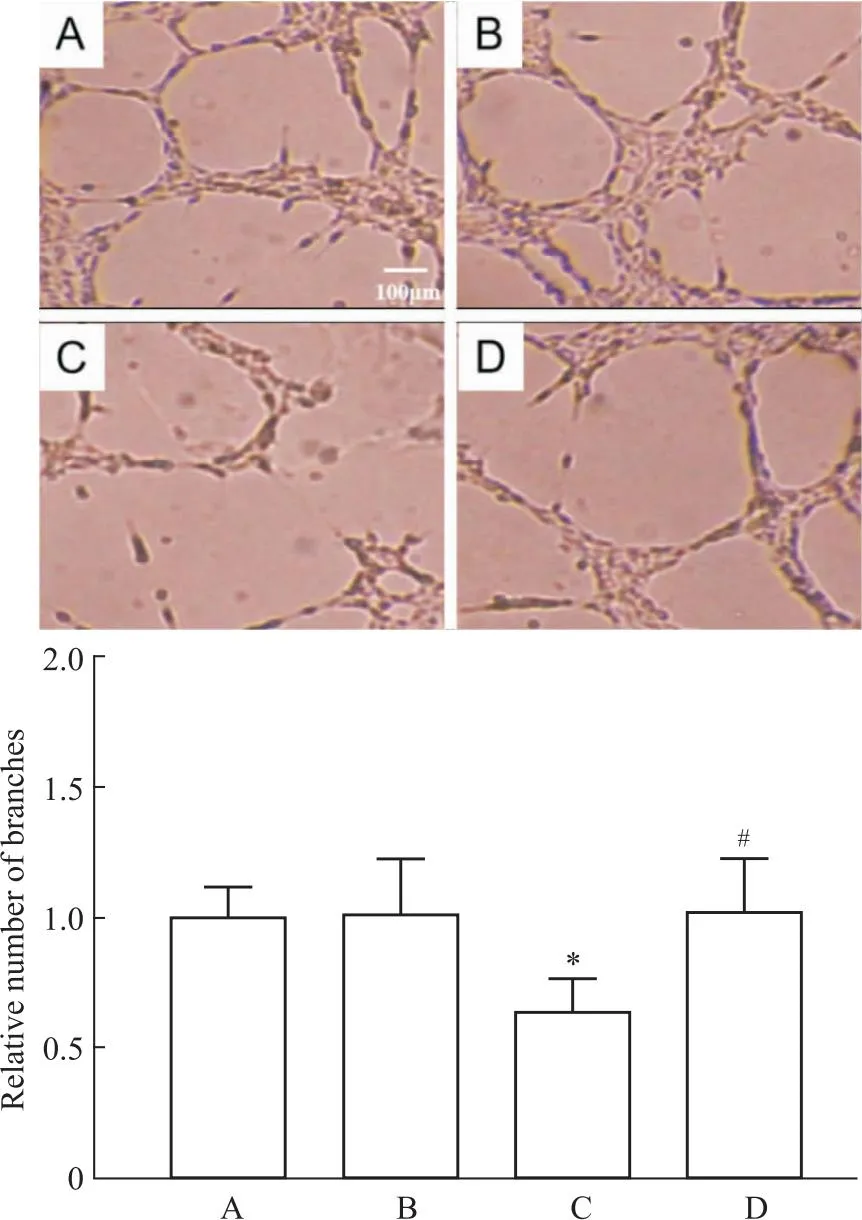
Fig 4 Representative photographs and quantification analysis of
3 讨论
内皮细胞的完整性对维持正常血管结构具有重要意义。机械损伤、缺氧、炎症以及氧化应激等异常因素可导致血管内皮结构损伤,从而促使多种心脑血管疾病的发生[1,7]。因此,维持内皮细胞的完整性对心脑血管疾病的防治具有重要意义。
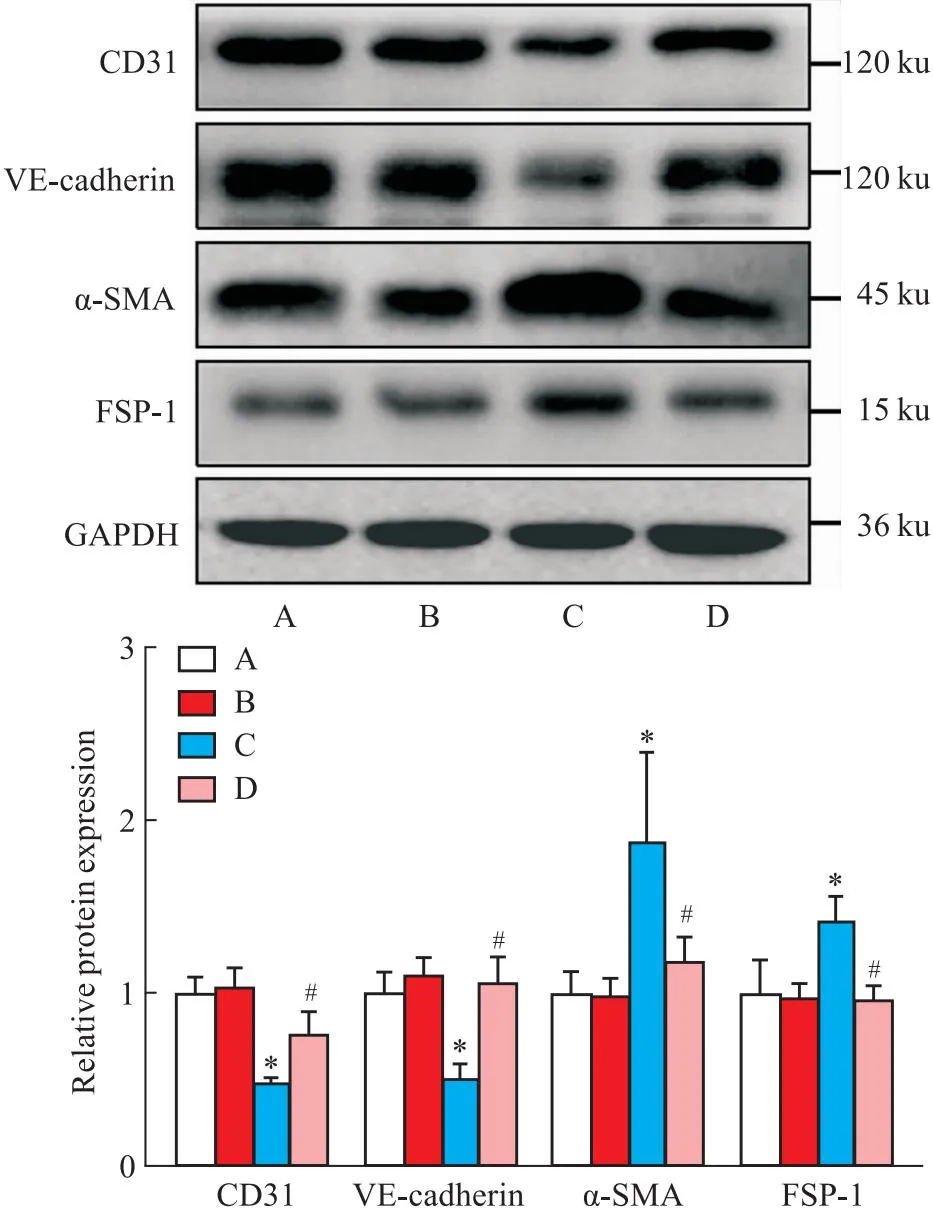
Fig 5 The expression of EndMT markers in HUVECs among different groups after colchicine n=3)
EndMT是内皮细胞逐渐失去内皮表型并获得间充质或成纤维细胞特征的一个生物学过程。EndMT过程的典型特征包括内皮特异性细胞-细胞连接蛋白的丢失:血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule, PECAM-1/CD31)、血管内皮细胞钙黏连蛋白(vascular endothelial cadherin, VE-cadherin)以及获得成纤维细胞肌动蛋白:α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)和成纤维细胞特异性蛋白-1(fibroblast specific protein-1, FSP-1),使细胞获得更大的迁移能力[2-3,8]。现有研究表明:EndMT是胚胎心脏发育的一个重要生理过程,它也作为一种病理过程发生在出生后,并导致各种疾病,包括纤维化[9],癌症进展[10],新生内膜增生[11]。在本实验中,我们采用10 mg·L-1LPS处理HUVECs 72 h以诱导EndMT。实验中观察到HUVECs在LPS处理后形态由铺路鹅卵石样逐渐变为狭长梭形,迁移能力增强,小管形成能力减弱,内皮细胞标志物CD31和VE-cadherin表达减少,间质细胞标志物α-SMA和FSP-1表达增多,说明LPS可以成功诱导EndMT的发生。
Col是治疗急性痛风发作的经典药物。近期研究表明,Col具有强大的抗炎作用,小剂量Col还可用于心血管疾病的二级预防[12]。最新发表在《新英格兰医学杂志》上的临床研究显示,在4 745例近期心肌梗死患者的评估中,与安慰剂组相比,每天服用低剂量Col(0.5 mg)可明显降低缺血性心血管事件的风险[13]。有研究证实,在无菌心包炎大鼠模型中,Col可以减少促纤维和促炎症因子的分泌和表达,如IL-6、TGF-β和TNF-α,从而抑制心房纤维化进展[14]。本研究通过CCK-8法以及LDH释放实验检测了不同浓度Col对HUVECs活力的影响,结果显示Col浓度为0.1、1和10 nmol·L-1时对细胞活力无明显影响,超过10 nmol·L-1时则会产生明显细胞毒性,故后续实验药物浓度选择10 nmol·L-1作为最佳处理浓度。随后我们发现,Col可抑制LPS诱导的EndMT,这可能是Col发挥心血管保护效应的作用机制之一。
既往报道显示,NF-κB信号通路激活在调控EndMT的发生发展中发挥重要作用[15-16],同时也是Col发挥抗炎作用的靶点之一[17]。据此,我们推测Col介导的NF-κB信号通路可能在调控EndMT进程中发挥重要作用。为进一步探讨调控机制,通过检测Col与NF-κB通路之间的关系,我们发现Col干预组HUVECs NF-κB信号明显抑制,同时下游Snail蛋白表达水平明显降低,NF-κB抑制剂(TAK-243)可发挥和Col同样的效应。以上这些结果表明,Col可通过调控NF-κB/Snail信号通路调控EndMT过程。
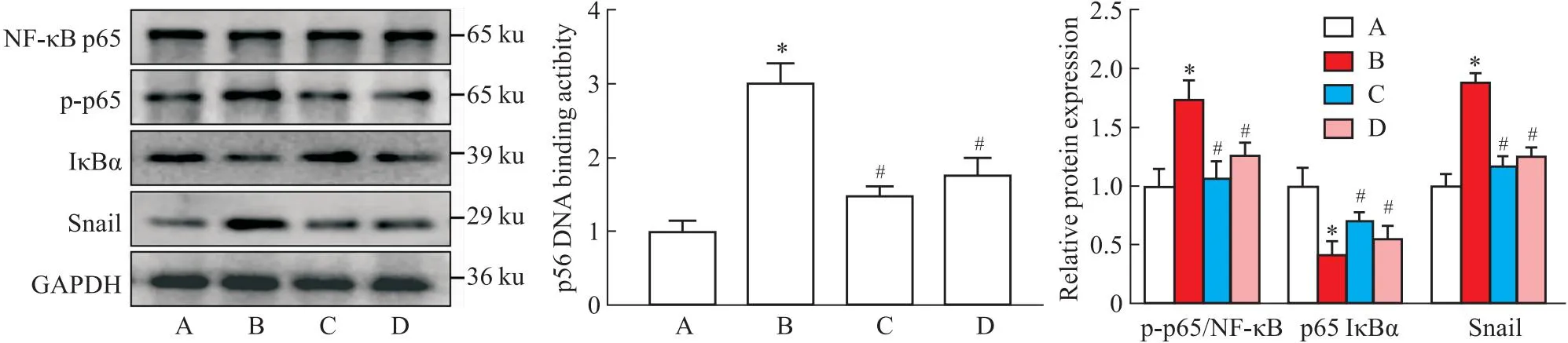
Fig 6 Colchicine inhibits LPS induced EndMT by regulating NF-κB/Snail signaling n=3)
本研究尚存在一定的局限性,首先我们仅在体外细胞实验观察了Col对LPS诱导的HUVECs内皮间质转化的影响,后续还需进一步通过动物实验及临床实验探讨Col对EndMT的影响。其次,对于Col调控EndMT的机制,仅检测了NF-κB/Snail信号通路的变化情况,但具体调控机制还有待进一步深入研究。