组胺H1受体激动剂通过Akt/NF-κB通路抑制脂多糖诱导的星形胶质细胞炎症反应
徐佳雯,沈佳红,温雨欣,孙建良
(杭州市第一人民医院麻醉科,浙江 杭州 310000)
组胺是一种生物源单胺,主要通过激活细胞上不同组胺受体亚型发挥作用,通常被认为参与调控外周过敏及免疫反应,但组胺也可调节大脑的炎症反应[1]。研究表明,中枢炎症是许多神经系统疾病发生发展的主要原因。已有大量文献证实,组胺能信号通路异常在帕金森病(Parkinson’s disease,PD)、阿尔茨海默病(Alzheimer’s disease,AD)等神经退行性疾病中扮演重要角色[2]。
星形胶质细胞是神经系统中数量最多,且分布最广泛的胶质细胞,近年来,其在中枢炎症中的作用逐渐被学者关注[3]。当受到伤害、应激及中枢神经系统感染等情况下,星形胶质细胞可通过反应性胶质化进行应答。适度活化的星形胶质细胞可上调多种抗炎因子和神经营养因子,抑制炎症并促进组织修复;而星形胶质细胞过度激活后则会合成和释放大量趋化因子和促炎介质,使炎症进一步恶化。因此,探讨星形胶质细胞活化的调控因子及其相关机制对防治神经系统疾病具有重要的潜在意义。课题组前期研究发现,星形胶质细胞表达组胺H1、H2和H3受体,且组胺H1受体(histamine H1receptor,H1R)在组胺对星形胶质细胞炎症反应的调控中发挥重要作用[4]。然而,H1R在炎性激活的星形胶质细胞中的作用和调节机制还不明确。脂多糖(lipopolysaccharide,LPS)作为一种内毒素和炎症介质,广泛用于细胞和动物炎症模型的建立[5]。本实验拟建立体外LPS诱导星形胶质细胞活化模型,探究H1R在星形胶质细胞炎症反应中的作用及机制,揭示星形胶质细胞的H1R在调控中枢炎症中的作用,并为治疗中枢炎症相关疾病寻找潜在的靶点。
1 材料与方法
1.1 材料
1.1.1实验动物 选用1~2日龄新生的SPF级大鼠乳鼠提取原代细胞。乳鼠购自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2003-0003。所有动物实验经浙江大学实验动物伦理委员会审核批准。
1.1.2药物与试剂 LPS(0111:B4),购自美国Sigma公司;胎牛血清、DMEM培养液,均购自美国Gibco公司;大鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素6(interleukin 6,IL-6)ELISA检测试剂盒、GAPDH抗体,均购自武汉博士德生物工程有限公司;H1R抗体,购自美国Santa Cruz公司;H1R激动剂Pyri、H1R拮抗剂cetirizine,均购自英国Tocris Bioscience公司;CCK-8试剂盒、蛋白BCA定量试剂盒,均购自上海碧云天生物技术有限公司;胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、p-Akt、Akt、p-NF-κB p65、NF-κB p65抗体,均购自美国CST公司。
1.1.3仪器 超净工作台、细胞孵箱(美国Thermo公司);电泳仪、转膜装置、化学发光成像系统(美国Bio-Rad公司);光学显微镜、激光共聚焦显微镜(德国Carl Zeiss公司)。
1.2 方法
1.2.1细胞培养和处理 取出生1~2 d的SD大鼠乳鼠的大脑皮质,剥离脑膜及血管,剪碎后加入0.25%胰酶,在37 ℃孵箱中消化10 min,随后用含10%胎牛血清的DMEM完全培养基中和。以1 500 r·min-1常温离心5 min,重悬细胞后接种于25 cm2培养瓶,置37 ℃、5% CO2的细胞培养箱中培养。10~12 d后,用手轻拍培养瓶约10 min,弃去上清中的小胶质细胞,加入新的培养基,重复3次。剩余的贴壁细胞即为星形胶质细胞,用胰酶消化铺板进行后续实验。
1.2.2实验细胞分组 将原代星形胶质细胞分为4组:对照组、LPS组、LPS+H1R激动剂(Pyri)组和H1R激动剂组。对照组仅加入培养液,LPS+H1R激动剂组提前在培养液中加入Pyri(100 μmol·L-1),1 h后再加入终浓度为100 μg·L-1的LPS。
1.2.3CCK-8法检测细胞存活率 按预定实验分组处理细胞24 h后,每孔加入10 μL CCK-8溶液,37 ℃恒温培养箱内孵育2 h,酶标仪检测490 nm处各孔的吸光度(absorbance,A),以反映细胞活力。使用以下公式计算细胞存活率:细胞存活率=(A处理组-A空白组)/(A对照组-A空白组)×100。
1.2.4免疫荧光检测 不同药物处理的细胞用4%多聚甲醛固定细胞形态,随后用破膜液破膜15 min,洗涤后用5% BSA封闭30 min。封闭后的细胞与GFAP抗体(1 ∶300)和H1R抗体(1 ∶200)4 ℃共同孵育过夜。将一抗孵育的细胞洗涤后,与荧光二抗在37 ℃避光孵育1 h,然后再用DAPI染细胞核10 min,荧光封片液封片,在激光共聚焦显微镜下采集图片,使用ImageJ软件对数据进行分析。
1.2.5ELISA法检测炎性因子分泌 将星形胶质细胞在相应实验条件下处理24 h后,收集细胞上清液,并离心除去细胞碎屑,保存于-80 ℃。使用相应的大鼠ELISA试剂盒,按说明书检测TNF-α和IL-6的水平。
1.2.6Western blot检测 相应组别细胞处理后用PBS洗涤,加入裂解液提取细胞总蛋白,BCA法测定蛋白浓度。金属浴煮沸样品10 min,取20 μg蛋白上样进行SDS-PAGE电泳,转移蛋白至PVDF膜,封闭缓冲液封闭1 h后,分别用抗p-Akt、Akt、p-NF-κB p65、NF-κB p65、GAPDH抗体4 ℃孵育过夜。次日,二抗室温孵育2 h后,用化学发光系统ECL显影,ImageJ进行分析。

2 结果
2.1 LPS对星形胶质细胞活力的影响原代星形胶质细胞在100 μg·L-1的LPS或100 μmol·L-1Pyri处理24 h后,CCK-8法测定细胞活力。Fig 1结果显示,与对照组比较,LPS组、LPS+Pyri组和Pyri组的星形胶质细胞存活率均无明显变化,说明此炎症模型中细胞存活率不受影响。

Fig 1 Effect of LPS and 2-pyridylethlamine on cell viability
2.2 LPS下调星形胶质细胞H1R的表达LPS处理细胞24 h后,采用免疫荧光双染H1R和星形胶质细胞标记物GFAP的方法,对星形胶质细胞进行检测。如Fig 2所示,LPS上调GFAP的表达,而H1R的表达减少,与对照组比较差异有统计学意义(P<0.01)。
2.3 H1R激动剂降低LPS对星形胶质细胞形态的影响为了探究H1R对LPS诱导星形胶质细胞形态的影响,使用H1R激动剂Pyri(100 μmol·L-1)预处理细胞1 h,随后采用LPS建立炎症模型,观察细胞的形态和生长情况。Fig 3结果显示,对照组细胞贴壁生长,细胞呈椭圆形或不规则形,表面有较多突起和分支,形成网络;LPS组细胞分支减少,并有断裂现象;Pyri预处理能够增加细胞突起,减少激活形态的星形胶质细胞。

Fig 2 Effect of LPS on H1R and GFAP content in primary

Fig 3 Effect of H1R agonist on LPS-induced glial morphological changes(scale bar=25 μm)
2.4 H1R激动剂抑制LPS诱导的星形胶质细胞的过度活化星形胶质细胞的活化程度可通过其GFAP的表达水平进行检测。如Fig 4所示,与对照组比较,LPS组GFAP的表达明显增加(P<0.01);与LPS组相比,LPS+Pyri组GFAP的表达明显较少(P<0.05)。以上结果说明H1R激动剂Pyri预处理能够减轻LPS诱导的星形胶质细胞的活化程度。
2.5 H1R激动剂下调LPS诱导的星形胶质细胞炎症因子的表达星形胶质细胞活化后可释放细胞因子和炎症介质,参与中枢神经系统的免疫应答,因此本实验检测了其活化后炎症因子的表达情况。如Fig 5所示,LPS刺激后细胞中炎症因子TNF-α和IL-6的产生明显增加,而LPS+Pyri组星形胶质细胞分泌的TNF-α和IL-6含量较单独LPS组明显降低。说明H1R激动剂可下调LPS诱导的星形胶质细胞TNF-α和IL-6的产生。
2.6 H1R激动剂对LPS诱导的星形胶质细胞中Akt和NF-κB p65磷酸化的影响Akt/NF-κB信号通路可以调控LPS诱导的炎症因子的表达,为进一步探究H1R对LPS激活星形胶质细胞中信号通路的影响,将原代星形胶质细胞用LPS和Pyri处理1 h后,采用Western blot检测Akt和NF-κB p65的磷酸化表达。Fig 6结果显示,LPS可以上调Akt的磷酸化水平,同时增加NF-κB p65的磷酸化;H1R激动剂Pyri预处理可以使Akt的磷酸化水平减少,并抑制NF-κB p65的磷酸化表达。提示H1R在LPS诱导的星形胶质细胞炎症反应中可能发挥重要作用。
2.7 H1R拮抗剂Ceti对Pyri调控星形胶质细胞炎性激活的影响为进一步验证H1R在LPS诱导星形胶质细胞炎症反应中的重要调节作用,将星形胶质细胞用LPS、Pyri和Ceti处理后,通过免疫荧光评估GFAP的表达,并检测细胞上清液中炎症因子的分泌。Fig 7结果显示,Pyri抑制LPS诱导的星形胶质细胞GFAP及炎症因子TNF-α、IL-6增加的作用可以被Ceti消除。
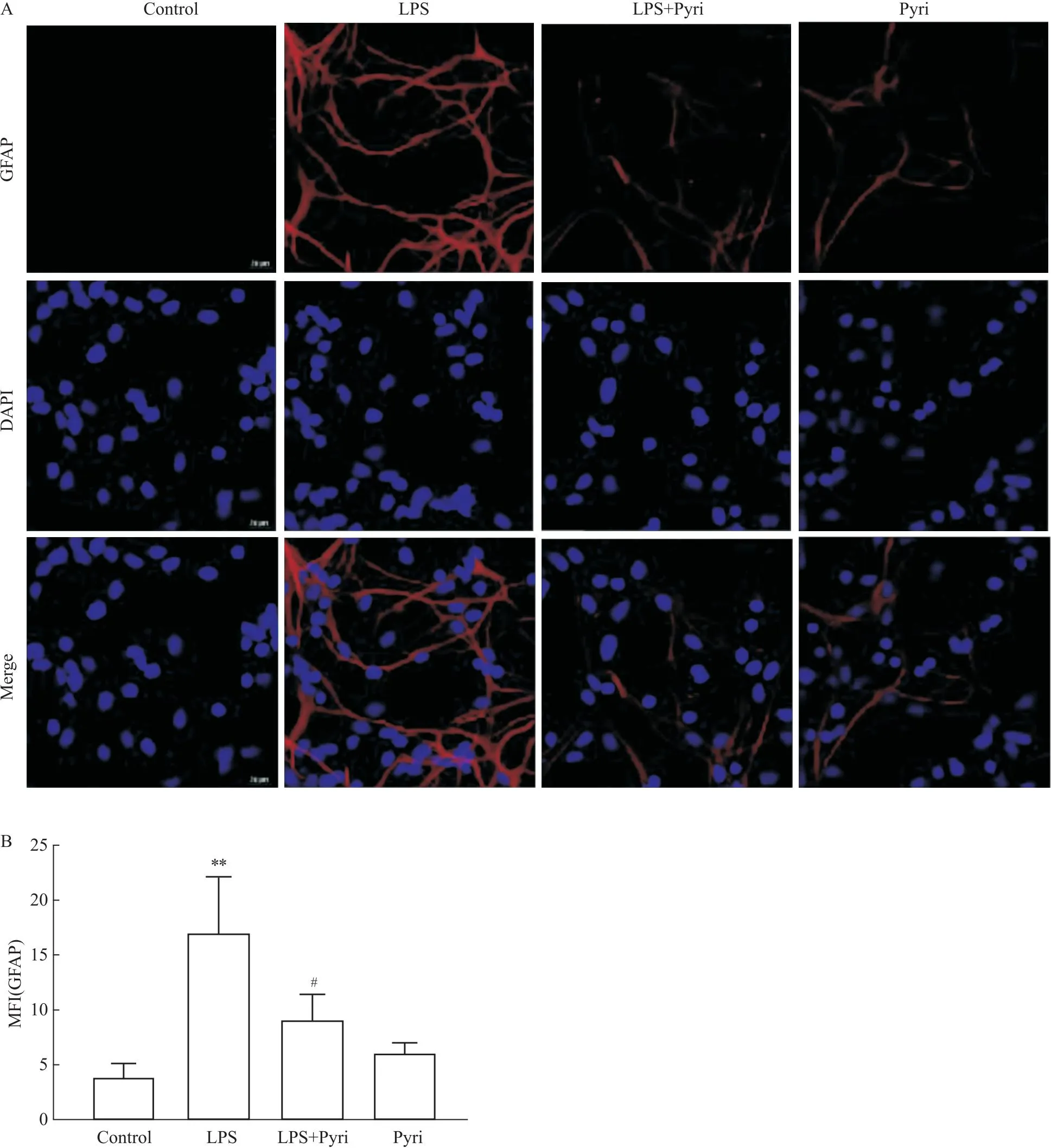
Fig 4 Effect of H1R agonist on LPS-induced
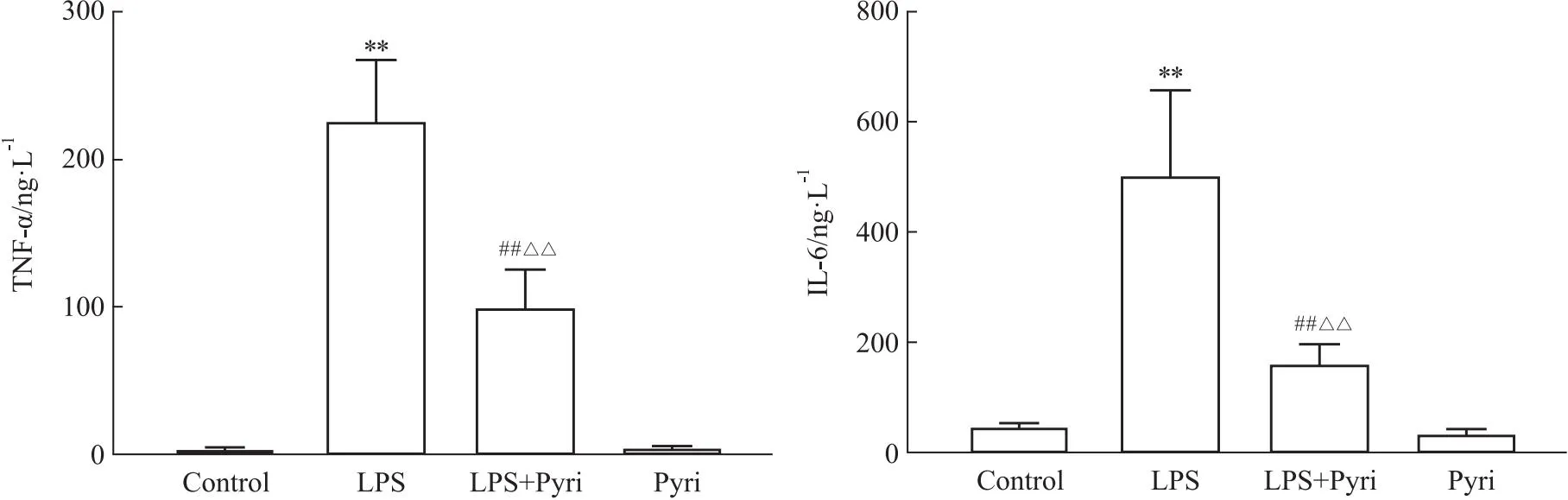
Fig 5 Effect of H1R agonist on LPS-induced inflammatory factors in primary
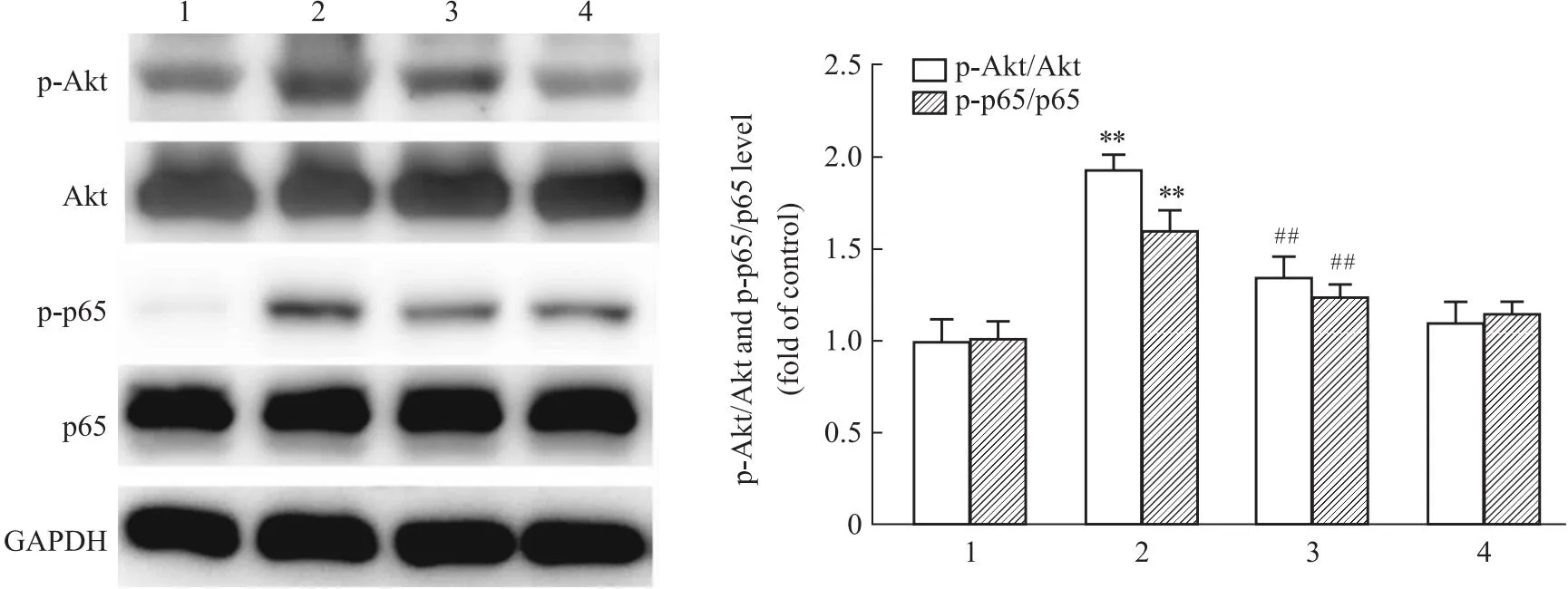
Fig 6 Effects of H1R agonist on LPS-induced phosphorylation of Akt and NF-κB

Fig 7 Effect of H1R antagonist cetirizine on Pyri and LPS induced astrocyte
3 讨论
组胺是一种活性胺化合物,参与调控多种生理功能,包括气道、肠道平滑肌的收缩、胃酸的分泌、血管的舒张等。研究表明,脑内组胺作为神经递质,主要来源于组胺能神经元,通过与不同组胺受体结合,调节各种脑功能,包括疼痛、睡眠与觉醒及认知功能。随着组胺能信号通路异常在PD、AD等多种神经退行性疾病中被报道,组胺对中枢炎症及神经发育的调节作用被广泛关注[6-7]。然而,越来越多的研究发现,在不同的刺激及环境条件下,组胺既可以发挥强效的促炎作用,又能产生重要的保护性抗炎作用[8-9]。有学者认为这可能与组胺作用于不同的组胺受体亚型及细胞类型有关[2]。因此,为了阐明组胺调控中枢炎症的具体机制及信号通路,有必要针对脑内不同细胞上的组胺受体亚型分别进行探究。
组胺对神经元的调控作用已有大量文献报道,但组胺如何作用于脑内的非神经元细胞,还知之甚少[10-11]。星形胶质细胞是神经系统中数量最多,且分布最广泛的胶质细胞,作为中枢炎症的重要调节者,随着脑内微环境的改变,既能发挥神经保护作用,又能加剧炎症的发展转而成为多种疾病的幕后推手。研究发现,组胺H1、H2和H3受体均在星形胶质细胞表达,而H1R与星形胶质细胞的大多数功能有关,如离子稳态、能量代谢、神经递质清除等。我们前期研究也发现,H1R在组胺对星形胶质细胞活化反应的调控中发挥重要作用[4, 12]。有文献报道,在中枢神经系统的固有免疫细胞——小胶质细胞上也有H1R表达,且H1R似乎扮演着促炎的角色[13-14]。为进一步探究H1R在星形胶质细胞炎性激活时的调控作用及机制,本实验采用大鼠原代星形胶质细胞建立体外炎症模型,并通过H1R激动剂和拮抗剂进行深入研究。
LPS是革兰阴性细菌细胞外壁的组成成分,利用LPS建立体外炎症模型可用于探索和阐明神经退行性疾病的病理生理机制[5]。本研究采用100 μg·L-1的LPS处理星形胶质细胞,CCK-8法测定细胞活力,发现该浓度下细胞存活率不受影响。星形胶质细胞在炎性刺激下,可通过反应性胶质化进行应答,最初表现为形态学的改变(分支和突起的重塑)以及过表达特异性标志物GFAP[15]。本实验发现,LPS刺激星形胶质细胞后,细胞分支减少,并有断裂现象,且GFAP表达明显增加,同时H1R表达明显减少。H1R激动剂Pyri预处理能够增加细胞突起,减少激活形态的星形胶质细胞,并下调GFAP的表达,以上结果说明Pyri预处理能够减轻LPS诱导的星形胶质细胞的活化程度。由于星形胶质细胞过度激活后可释放大量促炎介质加剧炎症反应,进一步检测了LPS处理后细胞上清液中的炎症因子TNF-α和IL-6的含量。结果显示,Pyri可明显下调LPS诱导的星形胶质细胞TNF-α和IL-6的水平。此外,Pyri的这一抑制作用可以被H1R拮抗剂Ceti消除。这一结果表明,H1R在LPS诱导星形胶质细胞炎症反应中具有重要调节作用。最近研究阐述了H1R与星形胶质细胞焦亡的关系,H1R被激活后,可以抑制抗精神病药物诱导的星形胶质细胞的焦亡与炎症[16],这与我们的研究结果一致。
已有研究表明,在炎症过程中,NF-κB异二聚体的核转运是星形胶质细胞异常激活的关键步骤,促进多种中枢神经系统疾病的发展[17]。在生理状况下,NF-κB与IκB结合,处于被抑制状态,一旦发生磷酸化被激活,可释放NF-κB p65进入胞核与靶序列结合,促进下游TNF-α等炎性细胞因子的表达。NF-κB的核转运受多种途径调节,已知PI3K/Akt信号转导通路通过IκB降解后,激活NF-κB,参与星形胶质细胞中炎症介质的表达[18]。本研究中,H1R激动剂Pyri可抑制LPS诱导的Akt磷酸化水平增加,并降低NF-κB p65的磷酸化表达,提示Akt/NF-κB通路可能是H1R参与星形胶质细胞免疫调节的重要途径。
综上,本研究证明H1R激动剂可抑制LPS诱导的星形胶质细胞活化和炎症因子的表达,其作用机制可能与抑制下游Akt/NF-κB通路的激活有关。H1R在星形胶质细胞上表现出抗炎特性,而在小胶质细胞上表现出促炎特性,揭示了其对炎症调控的复杂性。为进一步探究H1R在中枢炎症中的调节作用,我们后续将采用腺相关病毒结合星形胶质细胞的特异性启动子GFAP,对脑内星形胶质细胞上的H1R进行过表达,再构建中枢炎症模型,在体探究星形胶质细胞H1R的抗炎作用及调控机制。对脑内不同细胞上组胺受体作用的探究,有助于对组胺能信号通路在中枢炎症相关疾病中的角色有更深入的了解,并寻找出针对性的治疗靶点。