通窍活血汤含药脑脊液抑制星形胶质细胞机械性损伤后炎症反应的机制研究
刘飞飞 申友奎 陶开亮 张言涛
创伤性脑损伤(traumatic brain injury,TBI)是指因各种原因引起的颅脑损伤性病变[1]。在TBI 后的病理级联反应中,炎症反应与继发性脑损伤的发生、发展密切相关;而星形胶质细胞在TBI 后炎症反应过程中扮演着重要角色,在这一过程中调节星形胶质细胞功能可以提高TBI 患者的生存率,改善患者的预后[2]。IL-33 属于IL 超家族成员之一,在中枢神经系统中主要表达于星形胶质细胞和少突胶质细胞。肿瘤发生抑制蛋白(suppressor of tumourigenicity,ST)2 是IL-33的特异性受体。IL-33 与ST2 结合后启动下游信号级联传导,从而促进炎症因子的释放[3]。既往研究发现,血清IL-33 水平与TBI 严重程度、炎症反应程度和预后转归密切相关,血清IL-33 可能是一种反映TBI 严重程度和临床预后的炎症标志物[4]。蛛网膜下腔出血后星形胶质细胞内IL-33 表达水平升高,进而增强下游炎症因子IL-1β、TNF-α 转录水平[5]。由此推测,IL-33 在TBI 后星形胶质细胞诱发的炎症反应过程中亦起着重要作用。药理实验结果证实,通窍活血汤可以抑制TBI 后的炎症反应,减轻脑水肿,提高TBI 患者的生存率[6]。但是,目前关于通窍活血汤对TBI 后星形胶质细胞内IL-33 表达和IL-33/ST2 信号通路影响的研究不多。考虑到与中药含药血清相比,中药含药脑脊液可以避免血清中复杂成分的干扰,排除不能通过血脑屏障的成分,增加效应成分作用的针对性,故本研究利用机械性损伤的星形胶质细胞模拟TBI 的基本病理过程,探讨通窍活血汤含药脑脊液(Tongqiao Huoxue Decoction-containing cerebrospinal fluid,TQHXD-CSF)对星形胶质细胞机械性损伤后炎症反应的影响以及其调控IL-33/ST2 信号通路的相关机制,为通窍活血汤的临床应用提供依据。
1 材料和方法
1.1 实验动物与细胞 无特定病原体的雄性SD 大鼠20 只,体重250~300 g,购自上海斯莱克实验动物有限公司[动物生产许可证号:SCXK(沪)2013-0018]。饲养条件:恒温,温度(22±2)℃,湿度50%~60%,每12 h明暗交替,通风15~20 次/h,大鼠自由摄食、饮水。星形胶质细胞株(批号:RAT-iCell-n009)由赛百慷(上海)生物技术股份有限公司提供。本研究经杭州鹰旸生物医药研发中心实验动物伦理委员会审查通过(批准文号:202107-2901)。
1.2 药物与试剂 通窍活血汤中的川芎、红花、赤芍、桃仁、生姜、葱、红枣由浙江中医药大学附属杭州市中医院药剂科提供,麝香购自杭州方回春堂集团有限公司;FBS(批号:11011-8615)购自浙江天杭生物科技有限公司;胰蛋白酶(批号:SH30042.01)、DMEM(批号:SH30243.01)均购自美国Hyclone 公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒(批号:E606334-0500)、10%APS(批号:A600072-0025)均购自上海BBI Life Sciences 公司;IL-33 ELISA 试剂盒(批号:MM-61461R1)、IL-1β ELISA 试剂盒(批号:MM-0047R1)、转化生长因子β1(transforming growth factorβ1,TGF-β1)ELISA 试剂盒(批号:MM-0181R1)、跨膜型ST2(transmembrane ST2,ST2L)ELISA 试剂盒(批号:MM-70539R1)均购自江苏酶免实业有限公司;RIPA裂解液(批号:P0013D)、PMSF(批号:ST506)均购自碧云天生物科技有限公司;蛋白酶抑制剂(批号60237)购自康为世纪生物科技股份有限公司;BCA 蛋白定量试剂盒(批号:pc0020)、预染蛋白分子量标准(批号:PR1910)均购自北京索莱宝公司;30%丙烯酰胺(批号:BL513B)、三羟甲基氨基甲烷(批号:BL516A、BL514A)购自安徽白鲨公司;牛血清白蛋白(批号:4240GR100)购自广州赛国生物科技有限公司;聚偏氟乙烯膜(批号:10600023)购自美国GE Healthcare Life公司;IL-33 抗体(批号:ab207737)购自美国Abcam 公司;ST2L 抗体(批号:60112-1-Ig)购自武汉proteintech公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号:AF7021)购自美国Affinity 公司;总RNA 抽提试剂盒(批号B511311)购自生工生物工程(上海)股份有限公司;qRT-PCR 检测试剂盒(批号:RR820A)购自日本Takara公司;miRcute 增强型miRNA cDNA 第一链合成试剂盒(批号:KR211)购自天根生化科技有限公司。
1.3 仪器 细胞培养箱(型号:BB150)、低温高速离心机(型号:Micro17R)均购自美国Thermo 公司;光学显微镜(型号AE2000)购自德国Motic 公司;倒置荧光显微镜(型号:Ts2-FC)购自日本尼康公司;酶标仪(型号:CMaxPlus)购自美国MD 公司;电泳仪(型号:EPS300)、电泳槽(型号:VE 180C)、转膜仪(型号:VE186)均购自天能公司;化学发光仪(型号:610020-9Q)购自勤翔公司;PCR 仪(型号:Mastercycler)购自德国Eppendorf 公司;mRNA 定量仪(型号:Nanodrop one)购自美国Thermo Scientific 公司;qRT-PCR 仪(型号:CFX Connect)购自美国Bio-Rad 公司。
1.4 方法
1.4.1 TQHXD-CSF 及正常脑脊液的制备 将20只SD大鼠按随机数字表法分为给药组和正常组,每组10只,分别制备TQHXD-CSF及正常脑脊液。TQHXD-CSF的制备方法参考文献[7]。给药组大鼠按3 mL/kg剂量灌胃通窍活血汤,早晚各1次,连续5 d;正常组大鼠按3 mL/kg剂量灌胃0.9%氯化钠溶液,早晚各1 次,连续5 d。两组大鼠末次给药后1.5 h,肌肉注射戊巴比妥钠(剂量50 mg/kg)麻醉,颈后剃毛并碘伏消毒,切开皮肤后钝性分离肌肉层,用1 mL无菌注射器由枕骨大孔刺入延髓池抽取脑脊液。4 ℃、3 000 r/min 离心10 min,取上清液,0.22 μm微孔滤膜过滤除菌,-20 ℃条件下冻存备用。
1.4.2 细胞分组与处理 将星形胶质细胞分为正常组和机械性损伤组(3、6、12、24、48 和72 h)。星形胶质细胞机械性损伤模型的构建参考文献[8-9]:待细胞贴壁后,用10 μL 微量移液器枪头作“#”字划伤,划伤道宽度1 mm,两相邻划伤道间隔4 mm。尽可能使划伤的速度、力度相同,以保证同一组内星形胶质细胞损伤程度和范围一致。划伤后用PBS 清洗孔板上分离的细胞,换新的完全培养基继续培养;正常组为无机械性损伤的星形胶质细胞。另取星形胶质细胞分为空白组(完全细胞培养基)、脑脊液对照组(含5%、10%、20%、40%正常脑脊液)和TQHXD-CSF组(含5%、10%、20%、40% TQHXD-CSF),确定TQHXD-CSF 最佳给药浓度为20%。再另取星形胶质细胞分为正常组(含20%正常脑脊液)、模型组(含20%正常脑脊液)、TQHXD-CSF 组(含20%TQHXD-CSF)和ST2L 中和抗体+TQHXD-CSF 组(含20%TQHXD-CSF+5、10、20 μg/mL ST2L 中和抗体);除正常组外,其余各组均按照星形胶质细胞机械性损伤模型构建方法处理细胞。
1.4.3 星形胶质细胞形态观察 收集各组处理后的细胞,置于倒置显微镜下观察各时点细胞形态学变化。
1.4.4 星形胶质细胞活性检测 采用MTT 法。收集各组处理后的细胞,每孔加入10 μL MTT 染液,在培养箱内孵育。使用酶标仪测定各时点450 nm 处的光密度值,即细胞活性。
1.4.5 星形胶质细胞上清液IL-33、IL-1β、TGF-β1 及ST2L 水平检测 采用ELISA 法。收集各组处理后的细胞,通过反复冻融破坏细胞并放出细胞内成分,2 500 r/min 离心20 min,留取上清液。使用ELISA 试剂盒检测星形胶质细胞上清液IL-33、IL-1β、TGF-β1和ST2L 水平。
1.4.6 星形胶质细胞IL-33、ST2L 蛋白表达水平检测 采用Western blot 法。收集各组处理后的细胞,经裂解、离心后,提取蛋白。采用BCA 法定量并调整各组蛋白浓度。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法分离蛋白,并电转移至聚偏氟乙烯膜上。用5%脱脂奶粉室温封闭2 h;加入对一抗(IL-33 为1∶1 000,ST2L 为1∶1 000,GAPDH 为1∶500)孵育12 h。经缓冲液漂洗后,加入HRP 标记的二抗(1∶5 000),37 ℃孵育2 h。再次缓冲液漂洗后用增强的化学发光试剂盒显影,使用凝胶成像仪进行灰度值分析,即IL-33、ST2L 蛋白表达水平。
1.4.7 星形胶质细胞IL-33、ST2L mRNA 表达水平检测 采用qRT-PCR 法。收集各组处理后的细胞,使用Trizol试剂提取总RNA,测定RNA含量和纯度。配制相应反应体系进行逆转录反应,反应条件:42 ℃15 min,85 ℃5 min。配制相应反应体系进行PCR扩增,引物序列见表1;反应条件:95 ℃10 min变性,95 ℃15 s;60 ℃60 s;共40个循环。反应结束后以GAPDH为内参,采用2-ΔΔCt法计算IL-33、ST2L mRNA 表达水平。

表1 引物序列
1.5 统计学处理 采用SPSS 16.0 统计软件和Graph-Pad Prism 8.0 绘图软件。计量资料多组间比较采用单因素方差分析,两两比较采用LSD-t检验;组内各时点比较采用重复测量数据的方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 正常组和机械性损伤组星形胶质细胞形态变化及活性比较 正常组星形胶质细胞生长状态良好,随着培养时间的延长,细胞密度逐渐增加,胞体形态多样,细胞突起之间相互连接形成网络。机械性损伤组星形胶质细胞损伤后3 h,损伤边缘区细胞反应性胶质化,细胞体积增大,突起结构消失;损伤后6 h,胞体向空白区域伸出纤长的突起;损伤后12 h,损伤边缘区细胞开始向损伤处生长;随着损伤后时间的延长,损伤区细胞数量逐渐增多,细胞胞体肥大,粗大的突起交织成网,见图1(插页)。机械性损伤组星形胶质细胞损伤后6、12、24、48、72 h 细胞活性均明显低于正常组(均P<0.05),且以损伤后6 h 细胞活性下降最明显(均P<0.05),见图2。以上结果提示造模成功,机械性损伤导致星形胶质细胞出现反应性改变。

图1 正常组和机械性损伤组星形胶质细胞形态变化

图2 正常组和机械性损伤组星形胶质细胞活性比较
2.2 正常组和机械性损伤组星形胶质细胞上清液IL-33、IL-1β、TGF-β1 及ST2L 水平比较 机械性损伤组星形胶质细胞损伤后3、6、12、24、48、72 h IL-33、ST2L、IL-1β 水平均明显高于正常组,差异均有统计学意义(均P<0.05),且以损伤后12 h 升高最明显;损伤后3 h TGF-β1 水平明显高于正常组,但损伤后6、12、24、48、72 h TGF-β1 水平均明显低于正常组,差异均有统计学意义(均P<0.05),见图3。

图3 正常组和机械性损伤组星形胶质细胞IL-33、IL-1β、TGF-β1 及ST2L 水平比较
2.3 正常组和机械性损伤组星形胶质细胞IL-33、ST2L 蛋白及mRNA 表达水平比较 机械性损伤组星形胶质细胞损伤后3、6、12、24、48、72 h IL-33、ST2L 蛋白及mRNA 表达水平均明显高于正常组,差异均有统计学意义(均P<0.05)。与损伤后3 h 比较,机械性损伤组星形胶质细胞损伤后12 h IL-33、ST2L 蛋白及mRNA 表达水平均明显升高(均P<0.05),损伤后72 h IL-33、ST2L 蛋白及mRNA 表达水平均明显降低(均P<0.05),见图4-5。

图4 正常组和机械性损伤组星形胶质细胞IL-33、ST2L 蛋白表达水平比较(A:电泳图;B:柱状图)

图5 正常组和机械性损伤组星形胶质细胞IL-33、ST2L mRNA 表达水平比较
2.4 TQHXD-CSF 对星形胶质细胞活性的影响 使用不同浓度TQHXD-CSF 处理星形胶质细胞24 h,检测TQHXD-CSF 在细胞中作用的安全浓度。与空白组比较,5%、10%浓度的正常脑脊液和TQHXD-CSF 对细胞增殖的影响比较差异均无统计学意义(均P>0.05);当浓度为20%时,脑脊液对照组和TQHXD-CSF 组细胞活性较空白组均明显升高,且TQHXD-CSF 组明显高于脑脊液对照组,差异均有统计学意义(均P<0.05);当浓度为40%时,脑脊液对照组细胞活性较空白组明显升高,TQHXD-CSF 组明显低于脑脊液对照组,差异均有统计学意义(均P<0.05),见图6。故后续实验以20%作为TQHXD-CSF 最佳给药浓度。

图6 TQHXD-CSF 对星形胶质细胞活性的影响
2.5 TQHXD-CSF 对星形胶质细胞机械性损伤后细胞形态及活性的影响 与正常组比较,模型组细胞密度稀疏、胞体增大且突起结构消失;与模型组比较,TQHXD-CSF 组细胞数量增多,形态由不规则形转变为三角形或圆形,细胞间连接相对紧凑,见图7(插页)。与正常组比较,模型组细胞活性明显降低(P<0.05);与模型组比较,TQHXD-CSF 组细胞活性明显升高(P<0.01),见图8。

图8 TQHXD-CSF 对星形胶质细胞机械性损伤后细胞活性的影响
2.6 TQHXD-CSF 对星形胶质细胞机械性损伤后炎症反应和IL-33/ST2 信号通路的影响 与模型组比较,TQHXD-CSF 组IL-33、IL-1β、ST2L 水平以及IL-33、ST2L mRNA及蛋白表达水平均明显降低,TGF-β1水平均明显升高,差异均有统计学意义(均P<0.05);与TQHXD-CSF 组比较,ST2L 中和抗体(5、10、20 μg/mL)+TQHXD-CSF 组IL-1β 水平均明显降低,ST2L 中和抗体(10、20 μg/mL)+TQHXD-CSF 组TGF-β1水平均明显升高,差异均有统计学意义(均P<0.05),见图9-10。
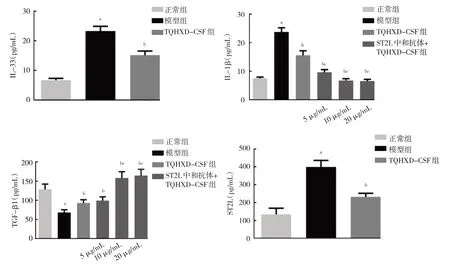
图9 TQHXD-CSF 对星形胶质细胞机械性损伤后IL-33、IL-1β、TGF-β1 及ST2L 水平的影响

图10 TQHXD-CSF 对星形胶质细胞机械性损伤后IL-33、ST2L 蛋白及mRNA 表达水平的影响(A:IL-33、ST2L 蛋白表达的电泳图;B、C:IL-33、ST2L 蛋白表达水平比较;D、E:IL-33、ST2L mRNA 表达水平比较)
3 讨论
在全球范围内,TBI 仍是目前造成创伤相关死亡和残疾的三大病因之一[10]。TBI 后的炎症反应不仅会在急性期加重继发性脑损伤,还会增加晚发的阿尔茨海默病、帕金森病和肌萎缩侧索硬化症等神经退行性疾病发生风险[11]。然而,临床上对于TBI 后的炎症反应仍缺乏有效的治疗策略。因此,积极探索调控TBI后炎症反应的有效措施,将有助于改善TBI 的疗效。
星形胶质细胞约占脑内细胞总数的90%,是中枢神经系统疾病和损伤的关键反应细胞。在生理条件下,星形胶质细胞通过糖异生为神经元提供代谢和神经营养支持,同时在突触功能的调节和维持血脑屏障稳定性等方面亦发挥重要作用。此外,星形胶质细胞还参与脑血流的调节[12]、生物钟的调节[13]以及神经递质的摄取、释放[14]等过程。TBI 后星形胶质细胞由静息状态向激活状态转变,成为反应性星形胶质细胞,表现出细胞肥大、纤维酸性蛋白表达上调、分泌炎性因子和趋化因子等特性[15]。根据TBI 的损伤程度、病理阶段和反应性星形胶质细胞的类型,星形胶质细胞在TBI 后继发性脑损伤和组织修复中发挥不同作用。一方面,活化的反应性星形胶质细胞可释放TNF、IL-1α、IL-1β 等促炎细胞因子,从而加重脑水肿,加速神经元死亡;另一方面,星形胶质细胞通过分泌抗炎因子IL-10、TGF-β1 和上调脑源性神经营养因子表达等,进而促进神经元存活和突触修复[16]。研究发现,体外培养的星形胶质细胞经脂多糖诱导活化后可表达IL-33 并激活下游相关信号传导通路[17]。在体内,IL-33 与膜受体ST2L 结合后触发细胞内的信号级联反应,促进TBI 后小胶质细胞和巨噬细胞的募集[18]。本研究发现,随着机械性损伤后培养时间的延长,星形胶质细胞出现典型的反应性增生改变,IL-33、ST2L 和促炎因子IL-1β 水平持续升高,而抗炎因子TGF-β1水平在短暂升高后持续降低,这说明星形胶质细胞机械性损伤模型能够模拟TBI 后星形胶质细胞的炎症反应变化。因此,调节星形胶质细胞的功能,使其发挥抗炎作用而减少促炎因子的释放,可能为治疗TBI 提供新的思路和靶点。
通窍活血汤具有活血化瘀、通窍活络的功效。该方剂中的麝香芳香开窍,为君药;桃仁破血行滞润燥,红花活血化瘀止痛,赤芍清热活血,川芎行血活血,均为臣药;佐以生姜、大枣调和营卫、通利血脉;葱为使药,载药上行,通阳入络。由于通窍活血汤在体内具有多成分、多途径、多靶点、多系统的治疗特点,且由于血脑屏障的存在,通窍活血汤的神经保护作用与其在脑内的有效成分关系较大,而目前关于通窍活血汤治疗TBI 的作用机制以及对TBI 后星形胶质细胞炎症反应的具体作用和机制等均尚不明确。本研究作了相关探讨,结果发现浓度为20%的TQHXD-CSF 提高星形胶质细胞机械性损伤后细胞活性的能力最强。因此本研究选择浓度为20%的TQHXD-CSF 作进一步实验,结果显示20%浓度的TQHXD-CSF 处理星形胶质细胞机械性损伤模型后,能改善细胞形态,增强细胞活性,降低IL-33、ST2L、IL-1β 水平,提高TGF-β1水平。由此可见,TQHXD-CSF 能在星形胶质细胞机械性损伤后发挥抗炎效应。研究表明,IL-33/ST2 信号通路参与心肌梗死、肿瘤、脑梗死等多种疾病的病理过程[19]。在TBI 小鼠模型中,IL-33/ST2 信号通路通过抑制自噬、内质网应激和细胞凋亡来发挥神经保护作用[20]。为了分析TQHXD-CSF 是否通过IL-33/ST2 信号通路来抑制星形胶质细胞机械性损伤后的炎症反应,本研究加入ST2L 中和抗体来抑制IL-33/ST2 信号通路,结果发现ST2L 中和抗体能明显增强TQHXD-CSF对IL-1β 的下调作用和对TGF-β1 的上调作用,这表明IL-33/ST2 信号通路可能参与星形胶质细胞机械性损伤后的炎症反应过程,提示TQHXD-CSF 的抗炎作用可能与抑制该信号通路有关,但具体机制仍需深入研究明确。
综上所述,星形胶质细胞机械性损伤后IL-33、ST2L 及IL-1β 水平均明显升高,TGF-β1 水平降低;而TQHXD-CSF 能改善星形胶质细胞机械性损伤后的细胞形态,降低IL-33、ST2L 及IL-1β 水平,提高TGF-β1水平,其作用机制可能与负向调节IL-33/ST2 信号通路有关。

