肾移植术后霉酚酸类药物个体化给药策略
李聪,李永俊,瞿丛新
霉酚酸类药物(MPA)为抗代谢免疫抑制药,临床常用的有吗替麦考酚酯(MMF)、麦考酚钠肠溶片(EC-MPS),与钙调神经磷酸酶抑制剂(CNIs)如他克莫司、环孢素A,和糖皮质激素如甲泼尼龙、泼尼松组成三联免疫抑制维持治疗方案,广泛用于预防实体器官移植术后排斥反应的发生。作为器官移植免疫维持治疗方案中的重要组成部分,在该药物使用初期认为无需监测血药浓度。但鉴于MPA代谢在不同受者体内差异明显,导致药物过量或不足,可能引发感染、排斥反应等并发症。MPA治疗药物监测(TDM)罗马共识开始推荐监测MPA暴露量,特别是二联免疫抑制剂方案、调整CNI类药物剂量、CNI类药物转化或撤除、移植肾延迟恢复、肝肾功能发生改变时、使用与MPA药物发生相互作用的移植受者[1]。目前国内指南推荐肾移植口服初始剂量为0.75~1.00 g,每天2次,维持治疗根据临床表现或MPA血药浓度曲线下面积(AUC)调整剂量,防止或减少药物的毒性及不良反应,延长移植物存活期[2]。但目前国内尚未广泛开展MPA-TDM,多为经验性用药,部分开展监测中心对采样时间、检测方法等存在差异,影响该药物的血药浓度结果,进而影响患者多中心随访时剂量调整。笔者通过查阅国内外文献,对MPA血药浓度监测的个体化给药策略进行分析,旨在掌握最新进展,为下一步本中心开展MPA个体化给药提供良好依据。临床研究发现,MPA浓度在给药后个体的差异性较大,可能受患者年龄、性别、药物代谢相关基因多态性、生化指标如血浆白蛋白、肝肾功能、合并用药等多重因素综合影响,其常见的不良反应包括血液系统毒性、胃肠道不适、感染、恶性肿瘤等,MPA-TDM获益的临床试验尚未得出一致结论[3]。
1 年 龄
李夏寅等[4]采用高效液相色谱法监测成年组和老年组共21名肾移植术受者术后口服MMF达稳态后血液中MPA浓度,采用非房室模型计算MPA药动学参数,并进行组间比较,成年组与老年组峰浓度差异无统计学意义(P>0.05),AUC0~12 h差异有统计学意义(P<0.05),提示MMF在体内的吸收有明显差异,服用时需适当增加剂量或缩短用药间隔。但Tang等[5]亦采用高效液相色谱法,比较联合使用他克莫司为维持免疫方案的成人、老年人(>65岁)肾移植患者MPA药物的药代/药效学特征,二者的AUC0~12 h无统计学差异(P=0.36),提示年龄不影响该药物的代谢。
2 性 别
昆明医科大学第一附属医院移植中心曾维胜团队以115例活体肾移植受体为研究对象,以性别分为2组,其中男61例,中位年龄32岁;女54例,中位年龄29岁,同时2组体质指数、术前透析时间、术中冷、热缺血时间比较差异均无统计学意义(P>0.05)[6]。术中采用静脉滴注巴利息单抗20 mg、甲泼尼龙500 mg诱导免疫,术后采用他克莫司、吗替麦考酚酯、泼尼松片三联方案进行维持免疫治疗。通过采用高效液相色谱法,分别检测2组服用第1、2、3周和第1、2、3月的MPA血药谷浓度(C0),分析2组血药浓度差异及不良反应发生情况。结果男性组MPA的C0多数<1.0 μg/ml,尤其在术后第1、2周。而女性组30%~78% MPA的C0>3.5 μg/ml,不良反应方面男性组发生急性排斥反应4例,女性组未发生排斥反应,发生胃肠道不适7例,3例发生肺部感染。
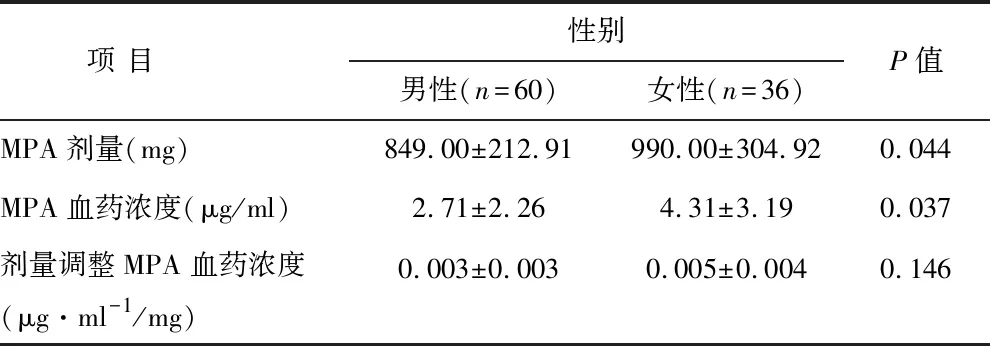
表1 MPA剂量、血药浓度与剂量调整MPA血药浓度一览表
3 基因多态性
除血药浓度监测外,基因多态性的研究在免疫抑制的合理用药方面亦提供了一种精准个体化给药依据。从MMF的药代动力学特点分析,口服MMF或EC-MPS制剂后在体内转化为MPA,MPA经小肠吸收后,通过肝脏代谢酶UGT大部分转化为无药理活性的7-O-葡萄糖苷酸霉酚(MPAG)和少部分的酰基葡萄糖苷酸(Ac-MPAG)。部分MPA和MPAG通过肝静脉进入血液循环,在有机阴离子转运多肽的作用下,重新吸收。MPA的代谢产物可通过多重耐药蛋白2(MRP 2)分泌入胆汁,再经肠道细菌作用,部分重生成为MPA进入循环,在这一循环中代谢产物主要经肾小管上皮细胞主动分泌排出体外,可能受ATP结合盒亚家族C2(ABCC2)及可溶性阴离子转运体(SLCO)家族的调控,故其中涉及MPAG编码的UGT1A9、UGT1A8,Ac-MPAG编码的UGT2B7,UGT1A8,MRP 2转运编码的ABCC2,对个体化用药具有一定意义[9-11]。上述MMF代谢涉及部分基因多态性见图1。虽UGT1A和IMP-DH基因多态性的检测已用于临床,但在关于该药物的基因多态研究中,表态分型与药动学、药效学、不良反应可能有关,由于纳入研究患者的样本量、基础疾病及合并用药等差异,研究结果存在差异,故基于患者临床资料,MMF的代谢转运相关酶多态性特点有待进一步研究[12]。
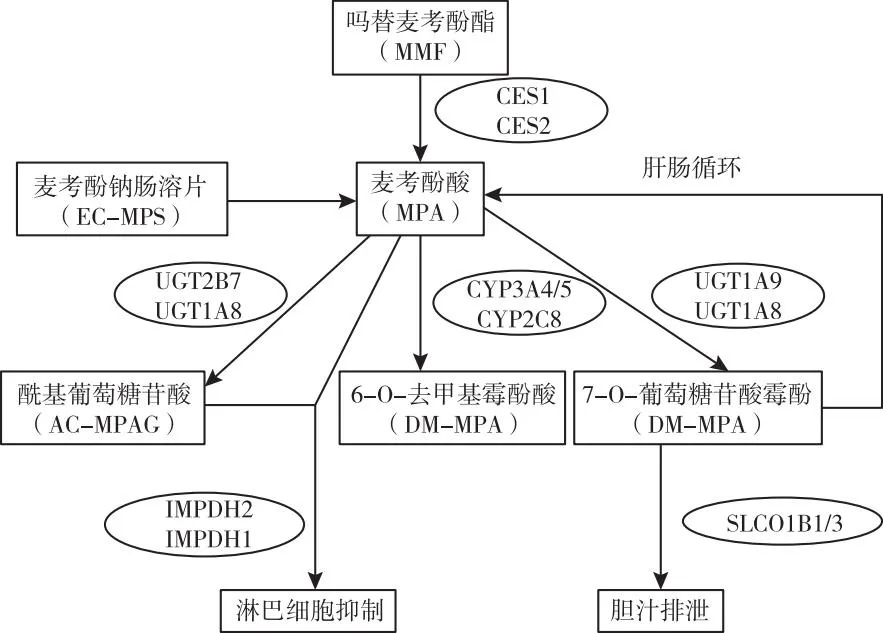
图1 MMF代谢途径中涉及部分基因多态性
4 血浆白蛋白
盛长城等[13]建立了MPA和代谢产物MPAG在中国成年肾移植患者中的群体药动学模型,定量描述游离霉酚酸(fMPA)和总霉酚酸(tMPA)浓度的关系及MPA和MPAG的竞争性蛋白结合过程,结果fMPA的蛋白结合速率常数与血浆白蛋白(Alb)浓度呈显著非线性正相关,当血浆Alb浓度由40 g/L减少至20 g/L时,fMPA的小AUC0~12 h未见明显变化,而tMPA AUC0~12 h降低约55%。若对于低蛋白血症患者(Alb≤30 g/L),仍以传统的tMPA AUC0~12 h30~60 mg·h/L为治疗目标,将使患者处于高fMPA暴露之下,易发生严重不良反应,如中性粒细胞减少、感染等,针对这一特殊群体,推荐监测fMPA浓度。
5 安全性
刘可欣等[14]回顾性分析了599例肾移植患者药品不良反应(ADR),结果在不同性别、年龄、移植时间存在显著性差异(P<0.05),移植时间超过1个月患者各类ADR发生与MPA-AUC呈线性相关(P=0.016 2),且带状疱疹的发生率分别在MPA-AUC值为30 mg·L-1·h-1,30~60 mg·L-1·h-1,>60 mg·L-1·h-1中有显著性差异(P=0.014),提示肾移植术后ADR的发生与可能与MPA-AUC相关,监测AUC具有一定意义。刘爽等[3]查询了最新的研究证据(截止时间2019年12月),系统评价了实体器官移植MPA浓度监测调整剂量与固定剂量的有效性及安全性差异,结果提示开展MPA-TDM可降低感染的发生风险。其中RR=0.52,95%CI=[0.33,0.81],I2=0%,敏感性不稳定,与移植类型有关。但在血液系统ADR方面发生骨髓抑制,表现为白细胞减少、贫血,故基于浓度调整剂量可能会引起不良事件发生。2组在细菌感染、病毒感染、真菌感染、血小板减少、腹泻及恶性肿瘤发生风险方面无显著差异(P>0.05)。
结合定性评价的结果,肾移植术后早期患者超出MPA的AUC0~12 h治疗窗范围(30~60 μg·h·ml-1)易出现不良反应,MPA TDM组在移植术后初期患者、调整免疫抑制剂方案如减少糖皮质激素剂量的患者中有较多获益[15]。
6 合并用药
Kagaya等[16]对日本71位肾移植术后联合使用他克莫司(FK506)与MMF的相互作用进行研究,结果二者无明显相互作用,可以安全使用。而环孢素(CsA)联用时,每天给予霉酚酸钠肠溶片720*2 mg,仅有25%患者MPA-AUC1~12 h>40 mg·L-1·h-1,建议增加剂量[15]。但根据《器官移植免疫抑制剂临床应用技术规范》(2019版),若MMF与干扰肠肝循环的药物如抗菌药物、阴离子交换树脂、利福平等同时服用,或合并胆道疾病,后者会降低MMF的药效,而与FK506合用,会使血药浓度升高,而不会影响CsA的药代动力学[2,17]。如抗菌药物青霉素类阿莫西林克拉维酸、氟喹诺酮类诺氟沙星、环丙沙星,硝基咪唑类甲硝唑,与MMF制剂同服时发现,MPA、MPAG在体内暴露量减少,MPA-AUC平均降低10%~33%,推测可能与抗菌药物影响肠道菌群有关,降低肝肠循环,进而影响MPA的暴露量[17]。
7 检测方法
目前MPA血药浓度监测的方法主要包括酶放大免疫(EMIT)法和液相色谱—串联质谱(LC-MS/MS)法,后者操作复杂、时间长,对检测人员技术要求高,临床应用较少。目前最常用的方法是EMIT法,采用商品化试剂盒检测,可批量操作,耗时短,快速准确[2]。Stracke等[18]研究发现EMIT、LC-MS/MS方法可靠。但33.5%经EMIT方法检测的浓度偏高,且与浓度范围在1~4 mg/L相关,可能过高计算MPA血药浓度,建议转化为LC-MS/MS法[19]。吕凤俊等[20]分别采用荧光免疫层析法、LC-MS/MS法、EMIT法分别检测61份口服MMF的儿童患者不同时相点血样中的霉酚酸血药浓度,结果3种方法均显示出较好的一致性和相关性,但荧光免疫层析法所测霉酚酸血药浓度结果高LC-MS/MS法结果、低于EMIT法结果。故建议临床医师在调整药物剂量时应考虑检测方法的差异性。
8 有限采样策略
MPA的临床疗效与体内暴露量相关,但由于使用后个体差异较大,临床需使用评估药物暴露水平、控制剂量的最佳指标服药后AUC0~12 h来进行剂量调整,以实现个体化治疗。但需密集采样如“十点法”在临床实践中实施难度大,有限采样策略(LSS)已逐渐被应用于MPA-TDM监测。目前由于缺乏相关监测标准的循证指南,部分开展的中心对剂型、采样时间、监测方法、是否考虑免疫抑制剂方案等亦存在差异。LSS应用于中国肾移植的研究共26项,其中13项研究的患者服用EC-MPS,15项研究中患者服用MMF,合用环孢素A,他克莫司,仅有1项研究进行了模型内部验证,6项研究进行了模型外部验证,模型验证样本量偏小。建模方面,1项研究采用贝叶斯法,其余均使用多元回归分析。MPA-AUC0~12 h简化公式分别建立了2,3,4个采样点,经分析比较4个采样点建立的MPA模型拟合度较好,相关系数较高,相对误差小,虽采用3个采样点拟合度稍差,相对误差在接受范围内,结合患者的依从性与建立的模型计算精度,推荐3个采样点的最佳MPA-AUC0~12 h简化公式。但由于样本差异性,LSS模型缺乏内部与外部验证,推广使用可能出现较大预测误差,影响临床疗效[21-22]。
综上所述,从药代动力学分析,MPA和EC-MPS由于药物吸收过程不同而具有差异性,前者血药浓度达峰时间为0.5~2 h,后者则为2~3 h,因此血药峰浓度(Cmax)、C0、达峰时间不同,同时MPA代谢有肝肠循环过程,某时间点的MPA血药浓度如C0,Cmax与临床疗效、不良反应的相关性不高,加之患者的年龄、性别、种族、个体遗传因素、病理生理特征及合并用药、饮食习惯等均可影响MPA的暴露量。因此为提高肾移植受者随访管理水平,延长移植物存活时间,减少并发症,基于肾移植术后患者不同免疫抑制维持方案,分别对吗替麦考酚酯、麦考酚钠肠溶片构建MPA-AUC个体化给药模型,并进行模拟认证,优化MPA监测模型需进一步研究,但长期治疗药物监测对肾移植受者的安全性、有效性仍需更多临床试验证实[23-24]。
利益冲突:所有作者声明无利益冲突。

