副猪嗜血杆菌4型灭活疫苗攻毒菌株的筛选
刘元杰,王秀丽,李 建,辛凌翔,朱良全,张一帜,姚文生,刘 燕
(中国兽医药品监察所,北京 100081)
副猪嗜血杆菌(Haemophilusparasuis,HPS),又称为格拉瑟氏菌(Grassella),可引起猪的副猪嗜血杆菌病,造成猪的发热、咳嗽、呼吸困难、消瘦、跛行、共济失调等症状[1]。按照琼脂扩散血清分型方法,HPS可以分为15个血清型[2]。在我国规模化猪场中,4、5、12型为主要流行血清型[3]。目前国内已批准上市的灭活疫苗涉及1、4、5、6、12、13共六个血清型,其中包含4型和5型产品最多。目前HPS疫苗产品主要依据农业农村部发布的产品质量标准进行评价,但由于不同企业产品的质控菌株不同,缺少统一标准,给评价工作造成一定难度,亟需筛选出一种统一的攻毒菌株并建立配套的评价方法。豚鼠是HPS疫苗效力评价的最经济有效的替代动物,我们通过用豚鼠进行毒力测定的方法,从现有菌种资源中筛选出毒力较强的菌株,为效力检验攻毒菌种的进一步研究奠定基础。
1 材 料
1.1 菌株 CVCC3953、CVCC3955、CVCC3962、CVCC4115、CVCC4121、CVCC4312、CVCC4355、CVCC4356,由国家兽医微生物菌(毒)种保藏中心提供。
1.2 培养基 TSA、TSB购自北京陆桥生物技术股份有限公司;NAD购自北京索莱宝科技有限公司;新生牛血清购自奥普赛生物科技有限公司。TSA与TSB均添加5%新生牛血清和0.002%NAD。
1.3 实验动物 SPF豚鼠购自北京维通利华实验动物技术有限公司。
2 方 法
2.1 血清型鉴定 取CVCC3953、CVCC3955、CVCC3962、CVCC4115、CVCC4121、CVCC4312、CVCC4355、CVCC4356菌种,接种于TSB,37 ℃ 180 r/min摇床培养12 h,将菌液高压灭活制备PCR模板。以F0、F4为上游引物,R0、R4为下游引物(表1)[4-5],分别进行PCR扩增。将扩增产物进行琼脂糖凝胶电泳,观察条带大小。

表1 PCR扩增引物Tab 1 PCR amplification primers
2.2 生长特性研究
2.2.1 菌种复壮 取CVCC3953、CVCC3955、CVCC3962、CVCC4115、CVCC4121、CVCC4312、CVCC4355、CVCC4356菌种,划线接种于TSA平板,37 ℃温箱培养。在24、48、72 h观察菌落生长情况,分别计算菌落平均直径。
2.2.2 扩大培养 经过平板复壮培养后,分别将挑取TSA平板上的单菌落,接种于100 mL TSB中, 37 ℃ 180 r/min摇床培养。在0、2、4、6、8、10、12、14 h分别取样,进行活菌计数。每个菌株各做2次重复,以活菌计数结果的平均值绘制细菌生长曲线。
2.2.3 离心对菌数影响研究 按2.2.1和2.2.2步骤将CVCC3953、CVCC3962、CVCC4115、CVCC4355、CVCC4356进行复壮和扩大培养,取新鲜菌液进行活菌计数。再各取新鲜菌液30 mL于离心管中,每株各取两管,分别以5000 和8000 r/min进行离心,弃上清液,各加30 mL TSB将菌体沉淀重悬,再次进行活菌计数。进行上述操作3次,以3次结果的平均值作为最终结果,比较离心前后的活菌数量。
2.3 豚鼠测毒试验
2.3.1 攻毒菌液的制备 选取CVCC3953、CVCC3962、CVCC4115、CVCC4355、CVCC4356菌种,划线接种于TSA,37 ℃温箱培养24~48 h。挑取单菌落,接种于100 mL TSA中,37 ℃ 180 r/min摇床培养8~10 h。细菌原液分别进行16倍和4倍浓缩以及1/4和1/16稀释,并取样进行活菌计数。
2.3.2 攻毒 将130只豚鼠分为26组,每组5只,分别进行攻毒(表2)。

表2 豚鼠攻毒分组Tab 2 Groups of guinea pig challenge
2.3.3 豚鼠观察和剖检 攻毒完成后,以豚鼠死亡或出现不良临床反应并持续2 d以上作为预设发病标准,逐日观察豚鼠状况。共观察10 d,以观察期内发病豚鼠总数作为最终的发病数。死亡豚鼠进行剖检,观察胸腔、腹腔是否有积液,各脏器是否出现病变。
3 结果与分析
3.1 血清型鉴定结果 CVCC3953、CVCC3955、CVCC3962、CVCC4115、CVCC4121、CVCC4312、CVCC4355、CVCC4356以F0、R0为引物均扩增出大小为275 bp的条带,以F4、R4为引物均扩增出大小为753 bp条带(图1),表明8株候选菌株均为HPS 4型。
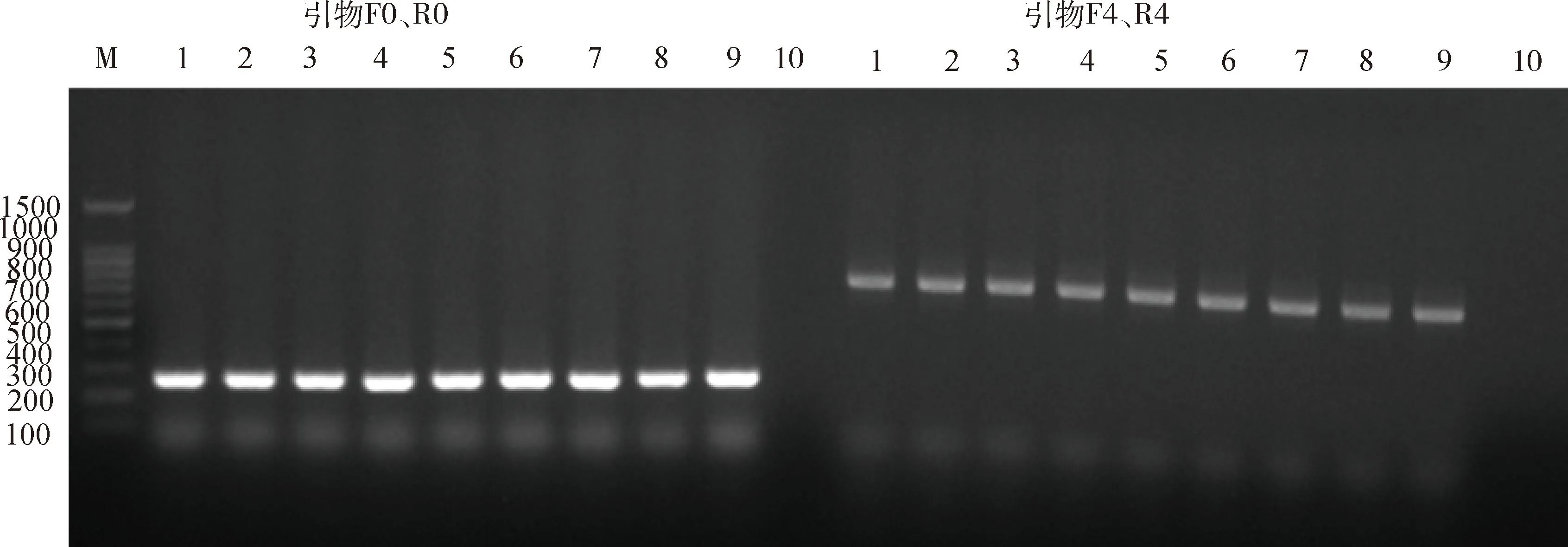
M: Marker; 1: CVCC4355; 2. CVCC4356; 3. CVCC3953; 4. CVCC3955; 5: CVCC3962; 6: CVCC4115; 7: CVCC4121; 8: CVCC4312; 9:阳性对照;10:阴性对照图1 血清型鉴定结果Fig 1 Results of serotype identification
3.2 TSA平板复壮结果 相同菌种在同一观察时间的菌落大小基本一致,其中CVCC3955、CVCC4121、CVCC4355经过24 h培养后菌落为针尖大小,48 h菌落平均直径达到1 mm,菌种复壮时间宜采取48 h;CVCC3953、CVCC3962、CVCC4115、CVCC4356经过24 h培养后菌落平均直径可以达到1 mm,菌种复壮时间宜采取24 h;CVCC4312经过72 h培养后菌落平均直径可以达到1 mm,选取72 h为复壮时间。具体结果见表3。

表3 8株候选菌平板复壮结果Tab 3 Plate rejuvenation results of 8 candidate strains
3.3 细菌生长曲线 8株菌生长曲线均基本符合细菌迟缓期、对数期、稳定期、衰亡期四个阶段。相同菌种在同一取样时间的活菌计数结果差异不大,其中CVCC3953、CVCC3962、CVCC4115、CVCC4355、CVCC4356活菌数平均值的峰值基本可达到2×109CFU/mL,选取作为毒力测定的候选菌株。但CVCC3955、CVCC4121、CVCC4312活菌数平均值的峰值均低于1×109CFU/mL,故不再进行后续研究。生长曲线见图2。

图2 8株候选菌生长曲线Fig 2 Growth curve of 8 candidate strains
3.4 离心对菌数影响结果 CVCC3953、CVCC3962、CVCC4115、CVCC4355、CVCC4356分别经5000和8000 r/min离心后,菌数与原菌液差别不明显。但5000 r/min离心后的活菌数略高于8000 r/min离心,故选取5000 r/min作为后续研究的离心方法。具体结果见表4。
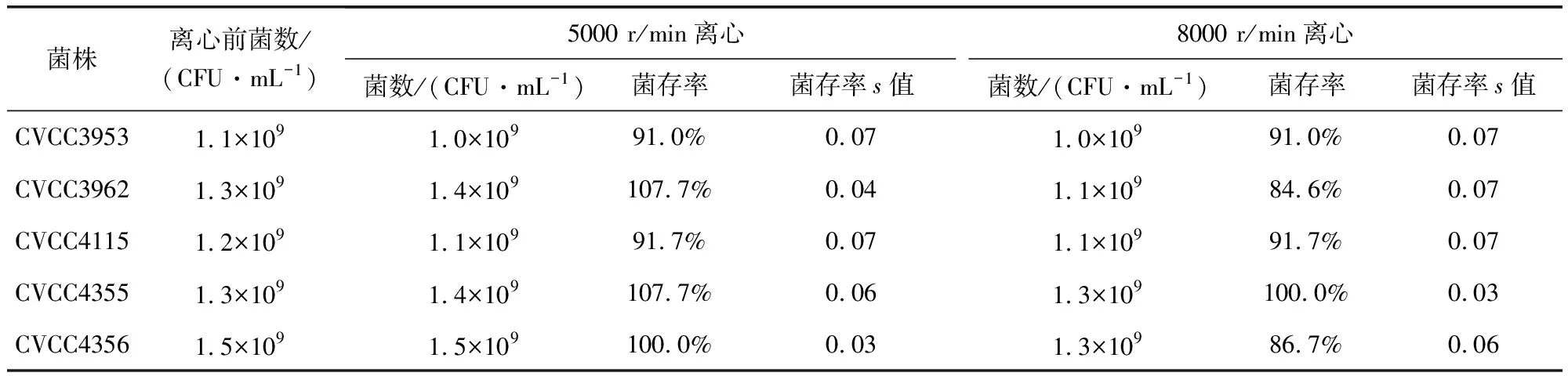
表4 离心对菌数影响结果Tab 4 Effect of centrifugation on viable count
3.5 豚鼠观察和剖检结果 豚鼠发病均在攻毒后2~3 d,死亡均在攻毒后1~3 d。发病豚鼠主要表现为精神沉郁、被毛粗乱,严重的出现便血等症状(图3),一般发病后3~5 d可恢复正常。

图3 发病豚鼠症状Fig 3 Symptoms of diseased guinea pigs
对死亡豚鼠进行剖检,其胸腹腔出现积液,脾脏和肠系膜淋巴结出血、肿大,肺脏和肝脏也有出血;发病豚鼠的各脏器也存在一定程度的上述病变;对照豚鼠各脏器正常。病变情况见图4。

图4 豚鼠剖检症状Fig 4 Autopsy symptoms of Guinea pigs
3.6 测毒结果 使100%豚鼠发病的最小剂量为最小发病剂量,CVCC3953最小发病剂量为1.1×1010CFU;CVCC4355最小发病剂量为8.3×109CFU。CVCC3962、CVCC4115、CVCC4356虽未测出最小发病剂量,但根据数据分析,CVCC3962的最小发病剂量应高于1.2×1010CFU;CVCC4115应高于1.0×1010CFU;CVCC4356应高于1.1×1010CFU。综合判断CVCC4355的最小发病剂量最低。豚鼠发病情况见表5。
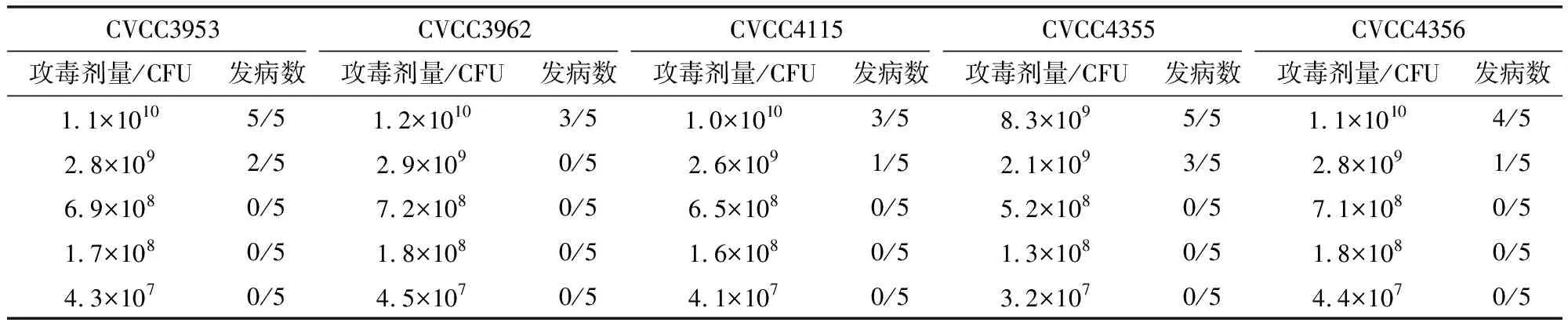
表5 攻毒豚鼠发病结果Tab 5 Disease outcomes of Challenge guinea pigs
4 讨论和结论
制备攻毒菌液一般要经过复壮和扩大培养两个步骤。本研究中采用平板划线的复壮培养方式,菌落大小是复壮培养时间确定的主要依据。菌落过小,肉眼难以观察,接种操作困难;菌落过大,细菌生长进入衰退期,活菌数量减少。经验表明,细菌复壮过程中,菌落直径1 mm左右时活菌数量较多且易接种操作,故宜将菌落直径达到1 mm的时间作为复壮培养时间。从8株菌种的扩大培养生长曲线可以看出,迟缓期不明显,这应与接种量有一定关系,单菌落接种TSB后,起始菌数可达106CFU/mL,培养8~10 h后即可达到活菌数峰值。但在测毒试验中,其中5株菌种的活菌数均未达到曲线中的最大菌数,这可能与采取的培养方式有关。在绘制生长曲线过程中,由于需要频繁地开塞取样,空气交换比较充分;液体培养时虽然采用了透气胶塞,但仍可能无法达到相应的空气交换效率。后续研究中拟采取用无菌硫酸纸替代胶塞以增加空气交换效率。
在常用的实验动物中,HPS只对小鼠和豚鼠有致死作用[6],对豚鼠的致病性强于小鼠[7],所以豚鼠是HPS测毒的最佳替代动物。不过HPS对豚鼠致病菌数仍然很高,根据本研究中的测毒数据,即便是毒力最强的CVCC4355,其最小发病剂量也达到了8.3×109CFU。这意味着液体扩大培养时获得的菌液活菌数可能无法满足攻毒的要求,需对菌液进行适当浓缩。本研究通过5000和8000 r/min离心前后活菌数的比较,证实离心对活菌数的影响可以忽略不计。后续研究中如果扩大培养时菌液活菌数达不到攻毒要求,可通过浓缩方式加以解决。
通过吸光度值估算活菌数也是确定活菌计数的常用方法之一。计芬芬等曾通过测量菌液OD600 nm的方法建立了金黄色葡萄球菌活菌数与OD值的线性回归方程[8];部分副猪嗜血杆菌类疫苗,如副猪嗜血杆菌病三价灭活疫苗(4型BJ02株+5型GS04株+13型HN02株),在效力检验操作中也通过测定OD值的方法估算攻毒菌液活菌含量[9]。但吸光度测定法无法区分死菌和活菌,估算出的菌数结果可能高于实际的活菌数。本研究旨在筛选攻毒菌株,需要准确把握候选菌株的实际最小发病剂量,故采取了直接确定活菌数的预实验和复数的方法。
目前HPS类疫苗产品效力检验多采用猪免疫攻毒法,尚未有可应用于产品效力检验的替代动物免疫攻毒法。HPS对猪的致死性较差,对猪的致病性一般通过临床症状和剖检病变综合判断。故在豚鼠测毒试验中,对测毒豚鼠也进行了剖检。其中脾脏、淋巴结肿大、出血是最明显的剖检症状,但未出现猪脏器纤维素性渗出等典型剖检症状[10]。从不良反应来看,虽然发病豚鼠出现了精神沉郁、被毛粗乱,严重的出现便血等症状,但一般发病后3 d左右可自行恢复。在建立豚鼠发病标准时应参照这一事实依据,宜将豚鼠临床症状持续时间2 d以上作为发病指标。
本研究通过豚鼠测毒试验筛选出毒力最强的HPS 4型CVCC4355菌株;通过对其生长特性的研究明确了CVCC4355的攻毒菌液制备方法;同时归纳了HPS 4型感染豚鼠的临床症状和剖检病变,为建立豚鼠免疫攻毒效力检验方法奠定基础。

