去氢骆驼蓬碱诱发PC12细胞凋亡时对线粒体融合分裂的影响*
巩月红,赵美玲,马瑞佳,林玉霞,赵军,王建华
(1.新疆医科大学第一附属医院药学部,乌鲁木齐 830054;2.新疆医科大学药学院,乌鲁木齐 830054;3.新疆医科大学第七附属医院药学部,乌鲁木齐 830028)
去氢骆驼蓬碱(harmine,HM)是从我国西北干旱地区广泛分布的蒺藜科骆驼蓬属骆驼蓬种籽中提取获得的一种三环β-咔啉类生物碱[1]。该化合物在抗肿瘤和抗包虫病方面具有一定的应用开发潜力,但因神经系统毒性作用使其未能进一步开发应用到临床[2]。因此,突破HM神经毒性的研究,阐明其神经毒性损伤机制在目前的研究中至关重要。
目前,有研究发现HM可抑制多种肿瘤细胞的增殖、迁移和侵袭,并诱导细胞凋亡[3]。本课题组研究人员前期在研究中发现HM作用PC12细胞可能导致细胞DNA损伤,进而激活细胞线粒体途径的凋亡[4]。而线粒体是由一个不断重组的动态网络构成,裂变和融合动态平衡在调节细胞能量、活性氧的产生以及程序性细胞死亡等基本功能中起重要作用[5]。正常生理状态下,线粒体融合和分裂处于某种动态平衡。一旦平衡打破,线粒体融合和分裂受阻,将会导致线粒体功能障碍、能量降低,进而引发各种疾病产生[6]。其中,神经系统疾病的研究已成为热点。研究发现外源化学物对神经细胞的毒性作用常呈现一定的线粒体毒性作用,所引起的变应性症状发展也常与线粒体功能障碍密切关联,因此,探讨外源物质的神经毒性损伤作用也引起广泛关注[7]。另有研究发现,细胞凋亡也受到线粒体分裂融合的严格调控,线粒体裂变依赖线粒体分裂蛋白Drp1影响线粒体能量合成的速度[8-10]。袁将等[11]研究表明,HM的神经毒性与能量代谢异常相关,变化的趋势与给药时间呈正相关。因此,笔者在本文拟观察HM对PC12细胞线粒体膜电位、线粒体形态、活性氧(ROS)等影响,从细胞水平上探讨HM是否引起PC12细胞线粒体融合分裂异常,为进一步深入研究HM毒理机制提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞 PC12人源神经母瘤细胞株由新疆医科大学协同中心提供。
1.1.2药物与试药 HM(新疆华世丹药业有限公司,批号:20210909,纯度:97.69%),以二甲亚砜(dimethyl sulfoxide,DMSO)配制成5 mmol·L-1的母液备用。Mdivi-1(美国MCE公司);WY14643(中国Selleck公司);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司);胰酶、青霉素-链霉素混合液、达尔伯克改良伊格尔培养基(Dulbecco'smodified Eagle's medium,DMEM)均由美国Hyclone公司提供;兔抗小鼠Bax单克隆抗体(美国Abcam公司);兔抗小鼠Drp1单克隆抗体(美国Proteintech公司);兔抗小鼠Mfn2、兔抗小鼠β肌动蛋白单克隆抗体均由美国CellSignaling Technology公司提供;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG二抗、Alex Flour®488标记的山羊抗兔IgG二抗(美国Abcam公司);噻唑蓝(MTT试剂)(货号:298-93-1)、JC-1试剂盒(批号:061319190830)、三磷酸腺苷(ATP)试剂盒(批号:061319190830)、乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(批号:20181122),上海碧云天生物技术有限公司。
1.1.3主要仪器 Western blotting凝胶成像仪(美国Bio-Rad公司);SW-CJ-IFD型超净操作台(苏州净化设备有限公司);倒置荧光显微镜(日本Nikon公司);Varioskan Flash型酶标仪、二氧化碳(CO2)恒温培养箱(美国Thermo公司)。
1.2细胞培养 取冻存PC12细胞置37 ℃水浴5 min,使用DMEM完全培养基(10% FBS,1%青链霉素混合液)悬浮细胞,112×g离心5 min,接种于培养瓶中,置37 ℃、5%CO2恒温培养箱中复苏培养,待细胞密度增加到约80%时,胰蛋白酶-EDTA消化、离心、重悬细胞,以适宜密度接种于培养瓶中,置于恒温培养箱(37 ℃、5%CO2)培养,取对数生长期细胞用于后续实验。
1.3MTT法检测PC12细胞存活率 将PC12细胞以每孔1×104接种在96孔细胞培养板中,设置空白对照组、HM组、线粒体分裂抑制剂Mdivi-1组、HM联合Mdivi-1组(1:1),WY14643组和HM+WY14643组(1:1)。根据MTT试剂说明书,每孔加入MTT(5 g·L-1)20 μL,置37 ℃、5%CO2培养箱内继续孵育4 h,弃去上清液,磷酸盐缓冲液(PBS)润洗3次,每孔加入DMSO 100 μL,37 ℃振荡10 min,用酶标仪在490 nm处检测吸光度值(A490),计算细胞存活率及各化合物半数有效浓度(EC50)。细胞存活率(%)=(药物处理组A490-空白孔A490)/(细胞对照组A490-空白孔A490)×100%。
1.4细胞分组 将PC12细胞以每孔1×104的密度接种在96孔板中,随机分为细胞对照组、HM组、Mdivi-1组和HM+Mdivi-1组(1:1),按照MTT预实验24 h的EC50,取各组药物浓度均为20 μmol·L-1,作用24 h。
1.5显微镜下观察细胞形态 取“1.4节”分组处理的细胞,MTT法检测细胞存活率,显微镜下观察细胞形态。
1.6JC-1荧光法检测PC12细胞线粒体膜电位 取“1.4节”分组处理的细胞,根据JC-1试剂盒说明书,每孔加入JC-1工作液500 μL,混匀,置于37 ℃培养箱避光染色20 min。JC-1染色缓冲液润洗3次,每次3 min,于倒置荧光显微镜下观察。
1.7Mito Tracker探针染色观察PC12线粒体形态和纵横轴长度比值 取“1.4节”分组处理的细胞,弃上清,无血清培养基润洗1次,4%多聚甲醛于37 ℃固定15 min,无血清培养基润洗3次,每孔加入不含胎牛血清的培养基稀释的MitoTracker Red探针,对线粒体进行标记,浓度为180 μmol·L-1,置于37 ℃培养箱内染色30 min。激光共聚焦显微镜(激发和发射波长分别为579 nm/599 nm)下观察各组细胞线粒体形态,摄像并保存。每组重复实验3个,每组重复实验中随机选取细胞45~60个,Image软件分析每个细胞中线粒体的纵横轴长度比值。纵横轴长度比值=线粒体纵轴长度/线粒体横轴长度;线粒体纵轴长度/线粒体横轴长度比值越接近1,代表线粒体越趋向圆形;二者的值越大表示线粒体的形态越伸展,呈现网络状[12]。
1.8PC12细胞ROS水平的检测 取“1.4节”分组处理的细胞,用基础培养液将DCFH-DA液稀释,比例为1:1 000;每组加入0.5 mL,培养箱内孵育20 min。无血清细胞培养液将细胞洗涤3次,去除未进入细胞内的DCFH-DA,荧光显微镜下观察并摄像。
1.9PC12细胞ATP水平的检测 取“1.4节”分组处理的细胞,收集细胞上清液,于细胞板孔中加入ATP裂解液100 μL,充分裂解并转移至EP管,4 ℃、12 700×g离心10 min,吸取上清液。BCA法进行蛋白定量检测,将各组蛋白终浓度调整至相同。按照ATP检测试剂盒说明书,检测ATP标准溶液和样品的发光值,根据ATP浓度标准曲线获得样品的ATP浓度。
1.10PC12细胞LDH释放的检测 取“1.4节”分组处理的细胞,弃上清液,加入LDH释放试剂(体积比PBS:LDH=10:1)150 μL,混匀,置37 ℃培养箱孵育1 h。随后将细胞培养板用多孔板离心,1 560×g、5 min。分别吸取各孔上清液120 μL,加入另一新96孔板相对应板孔中,随即进行样品测定。按照LDH检测试剂盒说明书,检测LDH标准溶液和样品的A值,根据LDH浓度标准曲线获得样品的LDH浓度。
1.11Western blotting法检测PC12细胞促凋亡蛋白Bax、cyt-c、Drp-1、Mfn2蛋白的表达 收集“1.4节”分组处理的细胞,采用RIPA裂解、超声5 min、离心、取上清液,BCA法进行蛋白定量检测,将各组细胞蛋白终浓度调整至相同,100 ℃沸水浴变性后备用。制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(100 g·L-1)凝胶板,待凝固后将变性蛋白依序加至凝胶孔中,电泳分离,转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,0.5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭2 h,加入一抗:Drp1(1:2 000)、Mfn2(1:1 500)、Bax(1:1 000)、cyt-c(1:2 000)和β肌动蛋白(β-actin,1:1 000),4 ℃孵育过夜;次日,TBST洗膜3次,加入稀释度为1:1000二抗(HRP标记的山羊抗兔IgG),放置暗处孵育2 h,TBST洗涤3次后,滴加电致化学发光(electrochemiluminescence,ECL)曝光液显影。采用Image J 软件对图片进行分析获取蛋白条带的积分吸光度值,以目标蛋白/内参蛋白积分吸光度值比值反映目标蛋白相对表达水平。
1.12免疫荧光染色法检测PC12细胞胱天蛋白酶3、Drp-1、Mfn2蛋白表达 收集“1.4节”分组处理的细胞,弃上清,PBS洗涤,加入40 g·L-1多聚甲醛作用30 min(固定细胞),PBS洗涤后用0.3%TritonX-100溶液通透10 min,0.5%BSA室温下封闭1 h,加入以下抗体:胱天蛋白酶3(1:1 000)、Drp1(1:1 000)、Mfn2(1:1 000),4 ℃孵育过夜,弃上清,PBS洗涤3次,加入二抗:Alex Fluor488(绿色)标记山羊抗兔IgG(H+L)室温避光孵育1 h,PBS洗涤3次,用DAPI封固,置于激光共聚焦显微镜下观察。
1.13SiRNA干扰及电转染效率检测 SiRNA-NC和Drp1-siRNA-1203、-1523和-2154干扰组(绿色荧光修饰标记)由上海吉玛基因公司设计设计和提供。siRNA的序列如表1所示。采用电穿孔法转染PC12细胞。PC12细胞正常培养1 d,将细胞密度为1×105加入到电穿孔缓冲液(200 μL)中。然后,加入siRNA-NC和Drp1-siRNA-1203、-1523和-2154干扰组,最终浓度为5 mmol·L-1。在125 V电击10 ms后,将冲击杯快速置于37 ℃培养箱中,放置10 min。收集PC12细胞,从不同组PC12细胞中分离出总RNA。采用RT-qPCR检测Drp1、Mfn2的表达水平,评价转染效率。

表1 引物序列
选择从上述方法中获得的最佳siRNA序列用于PC12细胞转染。分为4组:空白对照组、siRNA-NC、HM组、HM+siRNA-1523组。转染1 h后,每组收集PC12细胞1×105个,磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤,置于载玻片上。采用倒置荧光显微镜获取荧光图像,观察各组的绿色荧光强度。采用MTT实验观察细胞存活率,Western blotting检测Drp1、Mfn2的表达水平。见表1。
1.14统计学方法 采用SPSS 20.0版统计软件,实验数据结果用均数±标准差表示。多组间均数比较采用单因素方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1HM对PC12细胞存活率的影响 MTT法检测结果显示,与细胞对照组比较,HM组、Mdivi-1组、HM+Mdivi-1组、WY14643组、HM+WY14643组细胞存活率均显著降低(F=39.446~23 214.593,607.221~7 571.304,48.091~4 445.214,33.459~12 225.810,4.416~12 012.643,均P<0.01);与HM组比较,HM+Mdivi-1组、HM+WY14643组细胞存活率显著降低(F=363.717,P<0.01),见图1。各组药物对PC12细胞24 h的EC50分别为(27.08±1.06)、(31.73±1.09)、(31.95±1.76)、(21.69±3.07)、(25.96±1.88)μmol·L-1。因此,参考各组药物细胞存活率变化趋势、EC50值及药物作用性质,后续实验选择20 μmol·L-1浓度的HM、Mdivi-1和HM+Mdivi-1作为构建PC12细胞模型的工作浓度,该浓度对PC12细胞存活率结果见表2。
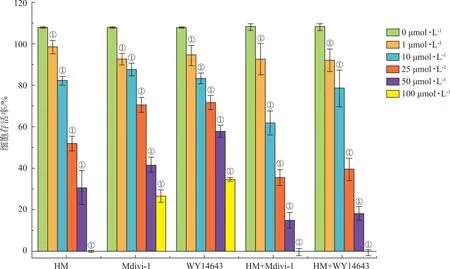
①与0 μmol·L-1比较,P<0.01。

表2 去氢骆驼蓬碱对PC12细胞存活率的影响
2.2HM对PC12细胞形态的影响 结果见图2。细胞对照组PC12细胞在静息状态下生长良好,呈长梭形或多角型,且有圆形或椭圆形增殖细胞,细胞透亮折光性较强,树枝状突起延伸将细胞连接形成网络状;HM组、Mdivi-1组PC12细胞贴壁功能呈不同程度下降,部分细胞开始脱落、形成聚集,细胞密度下降、折光性下降,细胞突起减少或消失;HM+Mdivi-1细胞形态学发生明显变化,表现为细胞明显圆缩、突起消失,大部分细胞脱落。
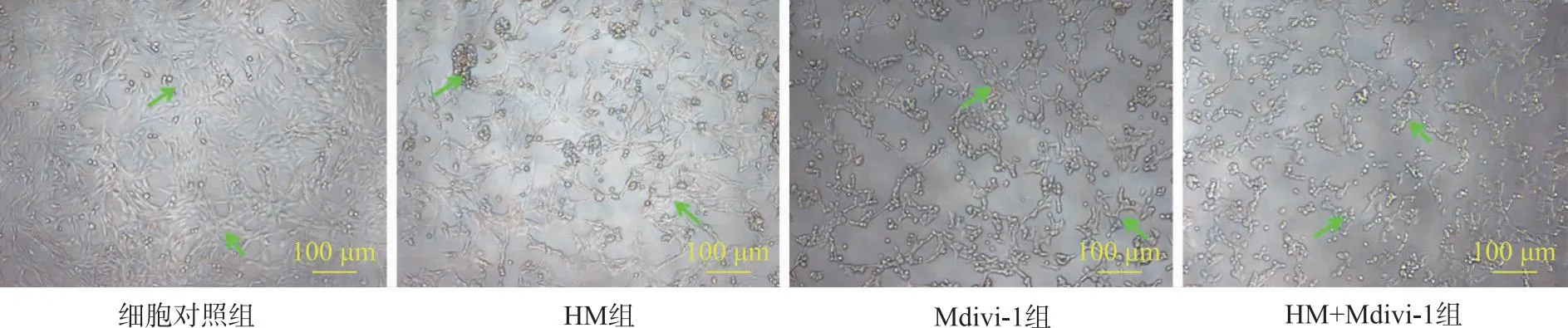
箭头表示细胞突起减少或消失。
2.3HM对PC12线粒体形态和纵横轴长度比值的影响 图3结果显示,激光共聚焦显微镜观察,细胞对照组细胞内线粒体形态正常,线粒体主要呈长杆状结构,散布于胞质。HM组、Mdivi-1干预后线粒体出现碎片化结构,呈现细小点状、短杆状。给予HM+Mdivi-1处理的PC12细胞内片段化线粒体减少。与细胞对照组比较,HM、Mdivi-1组干预后线粒体纵横轴比值降低(F=58.539,25.907,均P<0.01)。与细胞对照组比较,HM+Mdivi-1处理的PC12细胞内片段化线粒体的纵横轴比值趋向1(F=190.388,P<0.01),提示线粒体断裂的程度严重,形态趋向圆形。

①与细胞对照组比较,P<0.01。
2.4HM对PC12细胞线粒体膜电位的影响 JC-1检测结果见图4。与细胞对照组比较,HM组、Mdivi-1组、HM+Mdivi-1组给药后PC12细胞的红色荧光强度呈现不同程度降低,而绿色荧光强度增均显著增强。图4是对上述荧光结果中红色与绿色荧光强度比值进行数字化,绘制得到柱状图。从定量图中可更清晰直观地看出ΔΨm的变化趋势,表现为HM组、Mdivi-1组、HM+Mdivi-1组红/绿荧光强度比值与细胞对照组相比均显著降低(F=364.357,98.143,538.163,P<0.01),HM+Mdivi-1组细胞相对荧光强度比值(红色/绿色荧光)较HM组显著降低(F=1 169.711,P<0.01)。说明HM、Mdivi-1、HM+Mdivi-1对PC12细胞的ΔΨm有一定的损伤作用。
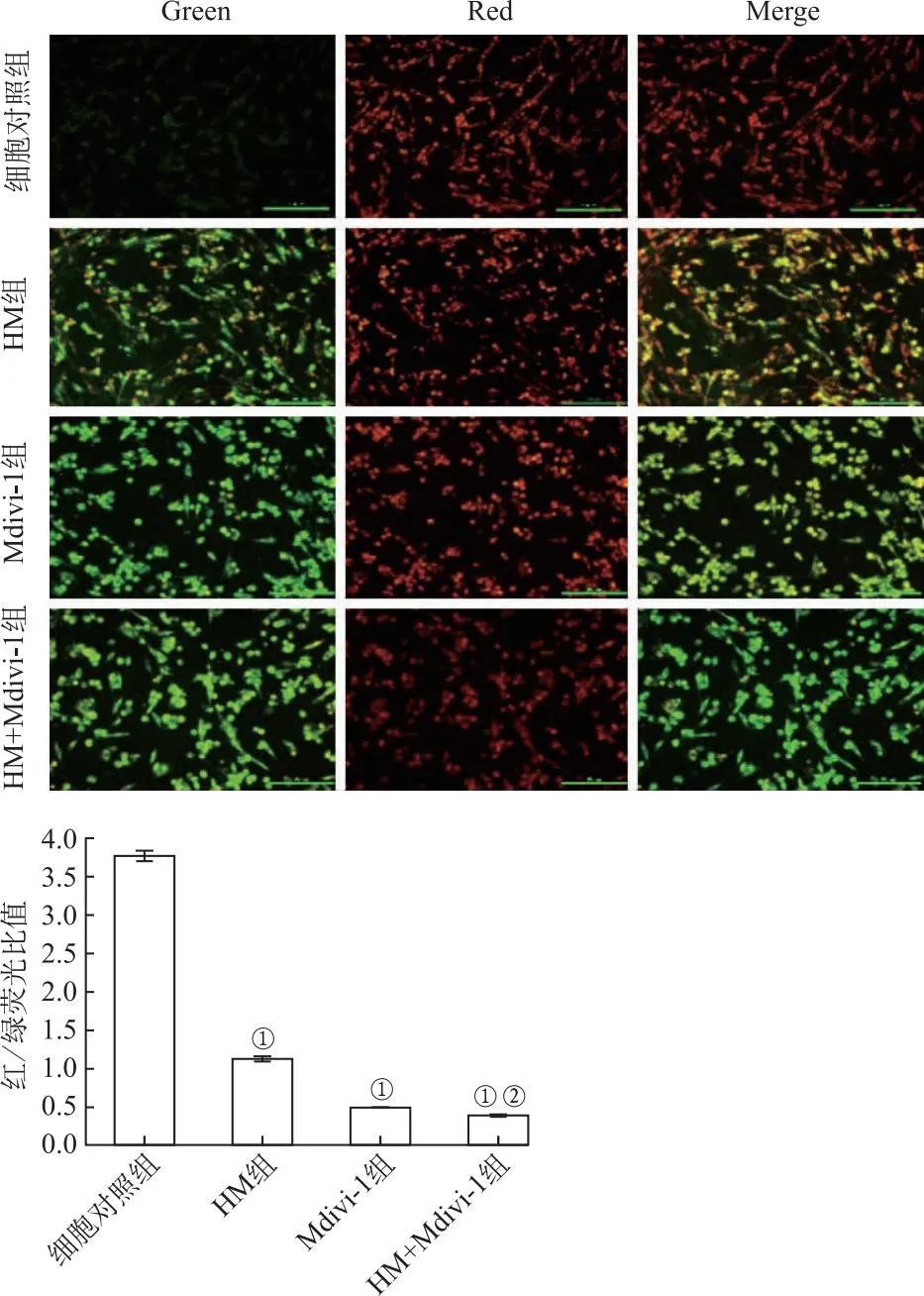
①与细胞对照组比较,P<0.01;②与HM组比较,P<0.01。
2.5HM及其衍生物对PC12细胞中ROS活性氧水平的影响 如图5所示,DCF标记线粒体ROS(呈绿色荧光),HM组、HM+Mdivi-1组均可见不同程度的绿色荧光,Mdivi-1荧光不明显。与细胞对照组比较,HM组、HM+Mdivi-1组荧光强度显著(F=149.793,356.348,P<0.01),Mdivi-1组结果不显著(P>0.05)(图5)。
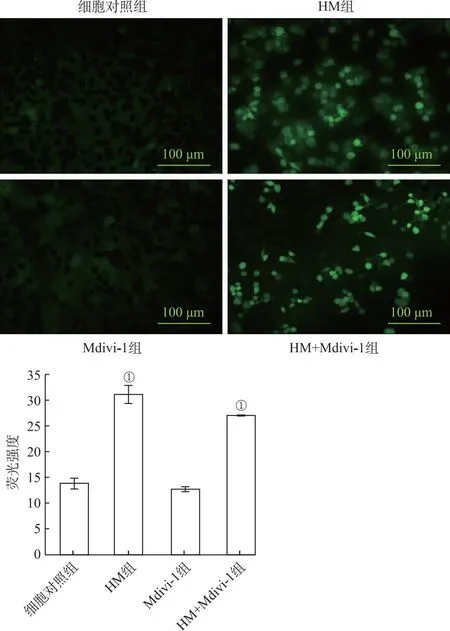
①与细胞对照组比较,P<0.01。
2.6HM对PC12细胞ATP合成和LDH释放的影响 结果见表3。与细胞对照组比较,HM组、Mdivi-1组、HM+Mdivi-1组细胞线粒体ATP水平均显著降低(F=24.055,27.938,51.422,均P<0.01);与HM组比较,HM+Mdivi-1组ATP水平显著降低(F=12.486,P<0.05)。与细胞对照组比较,HM、HM+Mdivi-1组LDH释放均显著升高(F=372.815,1 050.327,均P<0.01),Mdivi-1组LDH释放量显著低于HM组(F=65 995.895,P<0.01)。

表3 去氢骆驼蓬碱对PC12细胞ATP和LDH水平的影响
2.7HM对PC12细胞凋亡相关蛋白表达的影响 免疫荧光结果见图6。与细胞对照组比较,HM组、Mdivi-1组、HM+Mdivi-1组胱天蛋白酶3表达水平均显著上升(F=262.236,23.739,316.501,均P<0.01),Mdivi-1组胱天蛋白酶3表达水平相较HM组、HM+Mdivi-1组低,但结果差异无统计学意义(P>0.05)。

①与细胞对照组比较,P<0.01。
Western blotting实验结果见图7。与细胞对照组比较,HM组细胞促凋亡蛋白Bax表达水平及细胞素色C(cyt-c)表达水平均显著上升(F=27.233,50.298,P<0.01)。与HM组比较,Mdivi-1组Bax表达上调、cyt-c表达下调(F=229.392,24.160,P<0.05)。与细胞对照组、HM组和Mdivi-1组比较,HM+Mdivi-1组Bax、cyt-c表达显著上升(F=1316.781,831.014,P<0.01)。

①与细胞对照组比较,P<0.01;②与细胞对照组比较,P<0.05;③与HM组比较,P<0.05。
2.8HM对PC12细胞线粒体融合分裂蛋白表达的影响 免疫荧光结果见图8。与细胞对照组比较,HM组、HM+Mdivi-1组线粒体分裂蛋白Drp1的表达显著上升(F=804.213,126.566,P<0.01),Mdivi-1组表达显著下降(F=42.185,P<0.01);而线粒体融合蛋白Mfn2的表达,与细胞对照组比较,HM组、HM+Mdivi-1组表达显著下降(F=37.599,8.811,P<0.01),Mdivi-1组表达显著上升(F=19.041,P<0.01)。Western blotting结果显示,与细胞对照组比较,HM组、HM+Mdivi-1组线粒体分裂蛋白Drp1的表达水平显著上升(F=203.007,179.179,P<0.01),Mdivi-1组表达下降(F=27.899,P<0.05),而HM组、HM+Mdivi-1组线粒体融合蛋白Mfn2的表达水平显著降低(F=75 942.840,1 927.072,P<0.01),Mdivi-1组表达显著上升(F=233.647,P<0.05)。结果可说明HM、可以影响线粒体融合、分裂蛋白表达。

①与细胞对照组比较,P<0.01;②与细胞对照组比较,P<0.05。
2.9电转染率分析 对照组和siRNA-NC组Drp1表达水平分别为(1.22±0.72)和(1.27±0.51),差异无统计学意义,见图9。经HM处理后,Drp1的表达较对照组显著增加,为(6.26±0.62)(F=1023.969,P<0.01)。与HM组比较,Drp1-siRNA-1203、-1523和-2154的Drp1表达均下调,而Drp1-siRNA-1523组Drp1表达(3.29±0.39)显著低于HM组(F=175.660,P<0.01),见图9。将Drp1-siRNA-1523导入PC12细胞,观察其荧光强度。对照组PC12细胞中没有绿色荧光点,而Drp1-siRNA-1523和siRNA-NC组的PC12细胞显示明亮的绿色荧光点,见图9B。根据这些结果,在随后的实验中选择Drp1-siRNA-1523作为Drp1干扰。
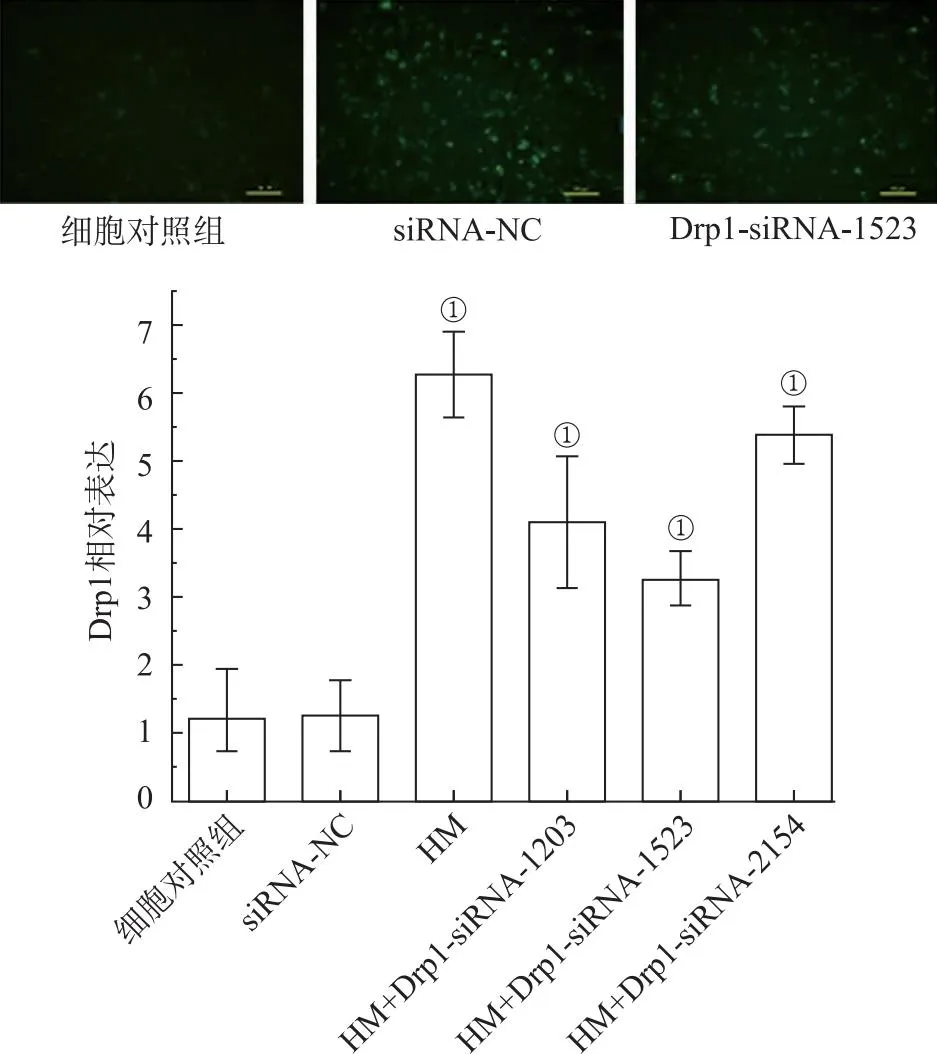
①与细胞对照组比较,P<0.01;②与HM组比较,P<0.01。
2.10筛选的干扰序列转染PC12细胞后活性检测 细胞对照组PC12细胞存活率(100.98±0.75)与siRNA-NC组(97.52±0.60)差异无统计学意义(P>0.05)。与细胞对照组比较,HM组存活率(54.63±1.33)显著降低(F=9 581.333,P<0.01)。HM+Drp1-siRNA-1523组存活率为(36.45±1.11)。表明当HM+Drp1-siRNA-1523组干扰与HM处理联合使用时PC12细胞的存活率比单独使用HM处理的低(F=878.960,P<0.01)。此外,这些数据表明Drp1基因敲除降低了PC12细胞对HM的耐受。
2.11免疫印迹法检测筛选的干扰序列转染PC12细胞后Drp1、Mfn2的表达水平 细胞对照组和siRNA-NC组各基因的表达水平均无显著差异,见图10。与细胞对照组比较,HM组Drp1蛋白表达水平显著上调(F=2 777.623,P<0.01)、Mfn2的表达下调(F=4 038.317,P<0.01);而Drp1基因敲除后,与仅接受HM的干预组比较,Drp1和Mfn2的表达明显下调(F=73.396,377.354,P<0.01)。
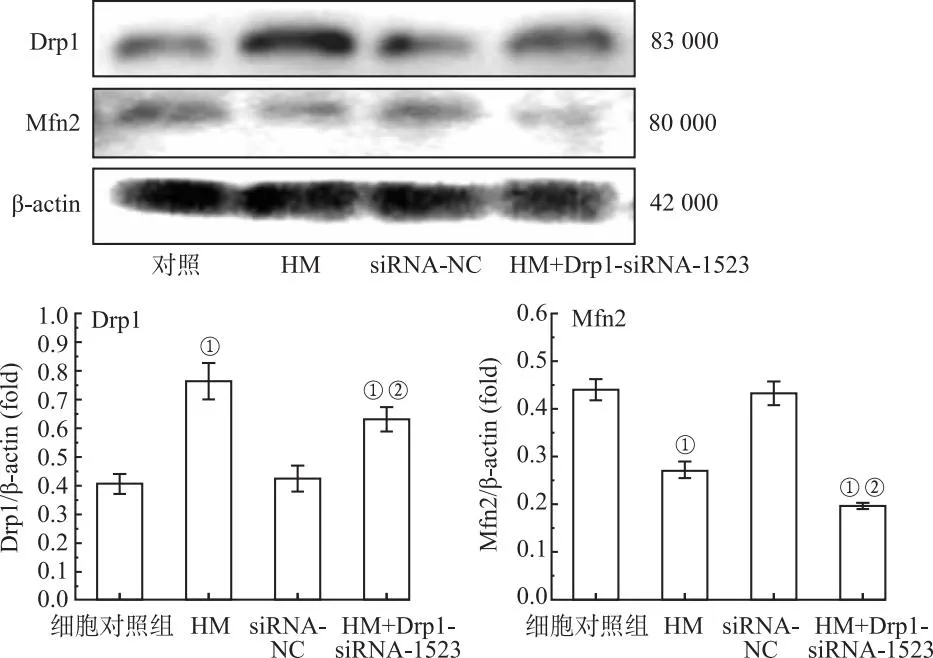
①与细胞对照组比较,P<0.01;②与HM组比较,P<0.01。
3 讨论
目前研究表明HM具有良好的抗包虫作用,与包虫病临床应用药物阿苯达唑相比肝毒性小、抗虫活性高,但因其中枢神经毒性作用,临床应用受限。因此,明确HM神经毒性作用机制对该药对包虫病的治疗至关重要。本课题组前期研究发现HM可激活细胞线粒体途径的凋亡[4]。且有研究报道HM的神经毒性与能量代谢异常相关[11]。现有研究数据表明,HM可能通过线粒体途径凋亡抑制细胞生长,并诱导产生神经毒性。为了进一步确证HM的毒性作用是否与线粒体途径的凋亡有关,课题组首先通过考察HM作用细胞后对细胞线粒体表型、功能影响的研究,发现HM通过ROS的累积,诱导增加了线粒体膜的通透性,降低线粒体的膜电位、增强了线粒体的片段化及使ATP生成量减少,激活了caspase-3凋亡途径使PC12细胞凋亡,可见HM作用PC12细胞可能启动了线粒体途径的细胞凋亡,凋亡的过程中伴随着能量代谢功能障碍。
当线粒体融合分裂平衡异常发生时也将导致线粒体功能障碍,表现为ATP生成量减少、ROS产生增多[13]。由此,推测HM促细胞凋亡过程中可能引起线粒体融合分裂失衡,研究结果表明HM作用PC12细胞可使细胞分裂、融合蛋白表达水平均出现显著变化,明显上调细胞Drp1蛋白表达水平,下调了细胞Mfn2蛋白表达水平,该结果在细胞免疫荧光实验中结果得到映证,且已有报道称Drp1相关的线粒体分裂过度可以诱导神经元凋亡[14]。故推测HM可能通过促进线粒体分裂增加,加速了PC12细胞凋亡。因此,选用Mdivi-1(一种选择性的线粒体裂变抑制剂)测试抑制线粒体裂变是否会对细胞凋亡产生影响,结果表明Mdivi-1却加剧HM引起的线粒体分裂促进,表现为Drp1水平升高。推测Mdivi-1与HM联合可进一步增强了线粒体功能障碍,导致细胞活力明显下降。siRNA干扰在抑制内源性Drp1后,能够显著抑制线粒体分裂,加强线粒体动态网络平衡[15]。为此,又在PC12细胞中成功敲除Drp1后,使用MTT和蛋白免疫印迹的方法研究了细胞存活率以及Drp1、Mfn2的蛋白表达。发现与单独HM组相比,siRNA-Drp1联合HM进一步下调Drp1、Mfn2的表达,表明下调Drp1联合HM作用可能通过线粒体融合分裂失衡增强了细胞凋亡。这些结果说明仅调节线粒体裂变(刺激或抑制)不能逆转细胞活性,而会促进HM诱导的线粒体动态、形态和功能损伤,从而降低神经元存活率,导致细胞过度凋亡。
最终研究表明在HM作用PC12细胞过程中通过干扰线粒体融合分裂实现削弱代偿性能量合成过程,促进细胞的凋亡。遗憾的是研究对于干扰线粒体融合分裂的具体作用模式没有涉及,仍需通过功能增益和功能丧失等研究进一步深入研究。但本次研究所发现的HM诱导线粒体分裂的机制对探明HM的药理作用具有非常重要的参考价值,也为进一步利用HM的神经毒性作用可上调线粒体分裂机制治疗包虫病提供新的理论依据。

