四川宜宾地区不同孕期妇女血浆可溶性纤维蛋白单体复合物水平参考范围的建立
龙 琴,石安惠,黄佳蓉(宜宾市妇幼保健院,四川宜宾 644000)
可溶性纤维蛋白单体复合物(soluble fibrin monomer complex,SFMC)是纤维蛋白原转变为纤维蛋白的中间体,是凝血酶水解纤维蛋白原使后者失去纤维肽A 和纤维肽B 而产生的[1]。有研究认为SFMC 作为凝血酶活性的标志物,血浆中高水平的SFMC 被认为是正在进行血管内凝血的指标[2],并有可能比其他凝血标志物(PT,APTT,FDP,D-D等)更早的预测血栓形成事件[3]。但是对于血浆SFMC 水平在不同人群中的分布检出情况目前报道较少。不同孕期妇女血浆SFMC 水平的参考范围目前未检索到。本研究旨在建立不同孕期血浆SFMC参考范围,探索血浆SFMC 水平与D-D 水平的相关性,为本地区临床诊疗提供依据。
1 材料和方法
1.1 研究对象 选取2021年05月~2022年01月宜宾市妇幼保健院就诊的397 例健康孕妇及120 例健康体检者为研究对象,年龄17~44 岁。将受试者分为健康对照组、孕早期组(≤13+6周)、孕中期组(14~27+6周)和孕晚期组(≥28 周)共四组。确保每组纳入不少于120 例受试者,以保证参考范围的90%置信区间。受试者排除有以下任何可能影响检测结果的因素:静脉血栓栓塞病史或家族史的患者;有高血压、恶性肿瘤、肝肾疾病、心血管疾病患者;服用影响凝血及纤溶系统药物的患者。本研究经医院伦理委员会认可,实验过程中所用的样本均已获得受试者知情同意。
1.2 仪器与试剂 所有检测均在日本SEKISUI 公司的CP3000 全自动凝血分析仪完成,试剂均为日本SEKISUI 公司配套试剂,试剂批号分别为:SFMC 检测试剂盒(121RJR),SFMC 校准品(201RBS),SFMC 质控品(202RCS);D-二聚体检测试剂盒(845RCS),D-二聚体校准品(824RDR),D-二聚体质控品(901RCS)。
1.3 方法
1.3.1 标本采集:采集受试者3.2g/dl 枸橼酸钠抗凝血液样本1.8ml,混匀后1 500g 离心15min,取血浆样本保存于-80℃备用。
1.3.2 检测前:将样本37℃水浴5min,溶解后10min 内上机检测。实验操作严格按仪器及试剂说明书进行,每次检测标本前使用低值、高值两个水平的质控品进行检测,确保检测精密度和可靠性。
1.3.3 参考范围建立:在临床应用中,低于参考范围下限的SFMC 结果无意义,故仅计算SFMC 单侧参考范围,以第95 百分位数来表示参考范围的单侧上限值,用Excel 软件中的PERCENTILE 函数计算P95。离群值按照Dixon(即D/R 比值)判断,即当D/R ≥1/3 时,该值应当作为离群值被剔除。D 是指极大(或极小)值和相邻值之间的绝对差值,而R 是指包括极值在内的所有值中最大值和最小值间的差值。
1.4 统计学分析 应用SPSS,Medcalc,Excel软件进行数据统计分析。 采用Kolmogorov-Smirnov(K-S)检验,判断资料分布情况。经正态性检验SFMC 呈偏态分布,以中位数(四分位数)[M(P25~P75)]表示。组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 四组血浆SFMC 水平比较及参考范围的建立本研究初步选择了517 例受试者,在回顾所有受试者临床资料后,排除1 例宫外孕史的受试者,2 例存在分析前误差(脂血)的受试者,4 例检测结果为离群值的受试者及13 例重复入组的受试者,最终纳入497 例符合标准的受试者,年龄27.6±4.9 岁。组间比较,受试者年龄差异无统计学意义(F=1.801,P>0.05)。
见表1。各实验组血浆SFMC 的参考范围分别为:<7.3μg/ml(对照组),<18.4μg/ml(孕早期),<20.4μg/ml(孕中期)和<58.5μg/ml(孕晚期),组间比较差异具有统计学意义(F=55.989,P<0.001);同时不同孕期组间比较差异也具有统计学意义(F=38.120,P<0.001)。
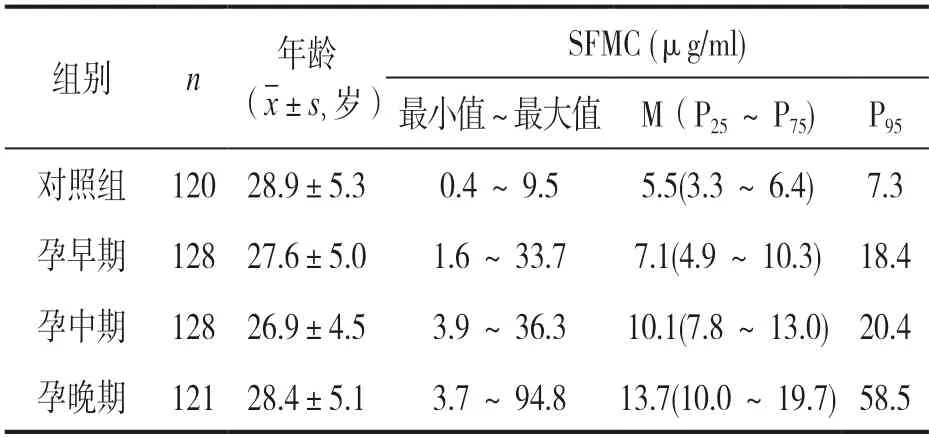
表1 不同实验组年龄及血浆SFMC 水平比较
2.2 血浆SFMC 水平与孕周的相关性分析 见图1。随着孕周的增加,孕妇血浆SFMC 水平逐渐上升。在孕早期至孕中期检测值整体的增长趋势较缓,但进入孕晚期后开始明显提升,特别是在孕34 周后显著升高。

图1 孕妇血浆SFMC 水平与孕周的相关性分析
2.3 孕妇血浆SFMC 水平与其D-D 相关性分析见图2。本研究中受试者血浆D-D 水平与SFMC 水平呈正相关,计算线性回归方程,显示出两个项目具有一定的相关性(r2=0.468 8)。

图2 受试者血浆D-二聚体水平与SFMC 水平相关性分析
3 讨论
妊娠期为女性特殊时期,表现为生理性高凝状态,抗凝系统功能和纤溶活性降低,血小板功能活化,血液瘀滞,血管损伤,子宫增大压迫下腔静脉和盆腔静脉,妊娠期和产后活动能力下降等,这些复杂的生理变化导致其处于血栓前状态,容易发生静脉血栓栓塞症(VTE)[4],发生风险与非孕妇女相比大约增加了5 倍[5],而同时VTE 也是女性妊娠和产后死亡的主要原因[6]。因此,在妊娠期间进行早期评估、筛查和识别VTE 具有重要的意义[7-8]。
可溶性纤维蛋白单体复合物(SFMC)在凝血早期即可形成,国外相关研究表明SFMC 在预测发病风险上优于D-D 检测,已被建议作为VTE 的新检测标志物[9],用于VTE 的预防监测。由于SFMC 检测试剂在国内目前暂无厂家上市,国内有关SFMC的研究报道较少,有研究显示,SFMC 在部分冠心病、子痫前期、恶性肿瘤患者中表达增加[1,10-12],而孕妇群体血浆SFMC 水平暂无相关的报道。本次研究SFMC 检测试剂盒(免疫比浊法)所建立的妊娠期妇女各阶段SFMC 参考范围,为临床预测妊娠期VTE 提供了较为可靠的实验室参考指标。
本次研究所建立的各孕期参考范围与正常对照组参考范围差别较大。在孕晚期受试者中,有95%的受试者超过正常对照组参考范围,最高者可达正常对照组参考范围上限的10 倍以上,说明临床十分有必要建立孕妇人群的血浆SFMC 参考范围。本次研究的受试者中有4 例多胎妊娠,其中孕早期1例,孕晚期3 例,由于多胎妊娠受试者转院等原因,虽未能完整收集到该人群孕早期、孕中期、孕晚期相关临床资料,但多胎妊娠例数少,占总受试例数比例很小(0.8%),初步认为不会对本次孕妇人群血浆SFMC 参考范围的建立造成显著影响。在参考区间验证中,每组随机抽取20 例进行验证,均落在各组参考范围之内。新建立的参考范围显示血浆中SFMC 水平随孕期的增长而增高,由于当前没有SFMC 妊娠期参考范围建立的相关研究,本研究为孕妇SFMC 检测提供了一个全新的临床参考,这也是本次研究价值所在。
本研究中,孕早期、孕中期、孕晚期各阶段的SFMC 水平逐渐升高,在孕晚期达到最高,与对照组比较,差异有显著统计学意义(P<0.001),因此,对孕妇进行SFMC 检测并观察其变化具有一定的诊断及研究价值,而这些变化可能与孕妇VTE 及其他妊娠疾病的发生有一定关联性。同时,受试者血浆D-D 水平与SFMC 水平呈正相关(r2=0.468 8)。研究发现,在SFMC 呈低值D-D 呈高值的区域(SFMC ≤20.0μg/ml,D-D ≥3.0μg/ml)内,10例完全来自于孕晚期组;而在D-D 呈低值SFMC呈高值的区域(SFMC ≥20.0μg/ml,D-D ≤3.0μg/ml)内,28 例样本中,5 例属于孕早期组,8 例属于孕中期组,15 例属于孕晚期组。相较仅D-D 高值的数据,SFMC 高值的数据在各组中均有一定分布,可以推测在妊娠期中D-D 与SFMC 水平拥有不同的发展趋势。因此,二者联合检测更能为临床提供可靠信息,提高母婴安全。
综上所述,本研究初步建立了宜宾地区健康孕妇血浆SFMC 的参考范围,且与正常对照组有明显差异。因此,采用正常人群的血浆SFMC 参考范围用于妊娠期妇女的静脉血栓风险评价可能存在较大的误差。本研究妊娠期各阶段血浆SFMC 参考范围的建立在孕妇VTE 预防监测上具有重要的临床意义。本研究的局限性在于:由于研究经费限制本研究未能另选人群进行参考范围验证,后续本课题组将继续深入研究,以完善验证。

