脑血管病患者血清PTGS2,CHI3L1表达水平及与认知功能障碍的相关研究
曹 娜,辜 蕊,赵晓玲,刘 艳(西南交通大学附属医院/成都市第三人民医院神经内科,成都 610031)
血管性认知障碍是指脑血管疾病导致智力下降的情况,可引起认知功能障碍。在血管性认知障碍涉及的多种机制中,脑小血管疾病可以说是导致认知功能障碍的最常见机制,且与中风无关[1]。脑小血管疾病的特征是影响大脑小血管结构和功能异常,可造成认知能力下降[2]。认知功能的下降会严重影响患者日常生活。因此寻找与认知功能障碍有关的指标十分重要。前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase2,PTGS2),也称为环氧化酶2(cyclooxygenase 2,COX-2),是前列腺素(prostaglandins,PGs)产生的限速酶[3]。COX-2 基因主要位于细胞的核膜中,因此PGs 产物可以进入细胞核,调节靶基因的转录[4]。与多种脑血管疾病,如阿尔兹海默症相关[5]。大鼠甲壳质酶蛋白40(YKL-40),也称为几丁质酶-3 样蛋白1(chitinase 3-like protein1,CHI3L1),是一种分泌型糖蛋白,与多种神经系统疾病有关,如阿尔茨海默病(Alzheimer's disease,AD)、多发性硬化及额颞叶痴呆等[6]。目前尚无血清PTGS2,CHI3L1水平与脑血管病所致认知功能障碍关系的相关研究,本研究通过检测脑血管病患者血清PTGS2 和CHI3L1 水平,并分析二者与认知功能障碍的关系,旨在预防认知功能障碍的发生。总结如下:
1 材料与方法
1.1 研究对象 选取2020年10月~2022年10月成都市第三人民医院收治的96例脑血管病住院患者为研究对象,其中男性50 例,女性46 例,平均年龄63.72±12.66 岁,平均BMI 22.69±2.87kg/m2。纳入标准:①符合《中国脑小血管病诊治专家共识2021》[7]标准,并结合头颅磁共振确诊;②发病前无认知功能障碍;③患者及家属知情同意。排除标准:①其他原因致认知功能障碍;②急性脑血管病(病程≤4周);③有直径>1.5cm的非腔隙性脑梗死;④其他脑部病变;⑤恶性肿瘤;⑥严重精神疾病或视听障碍;⑦无法配合研究或临床资料缺失。本研究获医院伦理委员会批准。
1.2 仪器与试剂 离心机(赛默飞世尔科技有限公司),西门子全自动生化分析仪ADVIA2400,PTGS2 和CHI3L1 酶联免疫吸附法试剂盒(上海酶联生物)。
1.3 方法
1.3.1 脑血管病诊断:腔隙性脑梗死(lacunar infarction,LIs)、脑白质高信号(white matter hyperintensities,WMHs)、脑微出血(cerebral microbleeds,CMBs)、血管周围间隙扩大(virchow-robin spaces,VRS)诊断标准参照《中国脑小血管病诊治专家共识2021》,影像结果由2 名5年以上工作经验的专业医师盲法分析,意见分歧时讨论共同决定。
1.3.2 临床资料收集:记录患者基本临床资料,包括年龄、性别、体质指数(body mass index,BMI)、既往史[糖尿病、高血压、腔隙性梗死或短暂性脑缺血发作(transient ischemic attack,TIA)及房颤等],检测患者血压(收缩压、舒张压),全自动生化分析仪检测三酰甘油(triacylglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白-胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)、空腹血糖(fasting blood glucose,FBG)、血肌酐(serum creatinine,Scr)、 尿酸和同型半胱氨酸(homocysteine,Hcy)。
1.3.3 血清PTGS2,CHI3L1 水平检测:患者入组翌日清晨抽取空腹静脉血6ml,4℃,3 000r/min 的速度离心10min 去除杂质,取上层血清,置于-80℃保存。取2ml 以酶联免疫吸附(ELISA)法检测血清PTGS2 和CHI3L1 水平,操作步骤遵守试剂盒说明书。
1.3.4 认知功能障碍评估:脑血管病所致认知功能障碍判断标准:符合《脑小血管病相关认知功能障碍中国诊疗指南2019》[8],并结合简易神经状态量表(mini-mental state examination,MMSE),MMSE评分<27 分为正常组(n=60),MMSE 评分≥27分为障碍组(n=36)。
1.3.5 Logistic 回归分析:将PTGS2,CHI3L1 作为变量进行多因素Logistic 回归分析,判断二者是否可作为预测认知功能障碍的独立危险因素。
1.3.6 绘制ROC 曲线:根据测量所得PTGS2,CHI3L1 表达水平绘制受试者工作特征(receiver operator characteristic curves,ROC)曲线,并计算曲线下面积(area under the curve,AUC)、诊断阈值、敏感度和特异度,进而来判断PTGS2,CHI3L1 表达水平对认知功能障碍的预测价值。
1.4 统计学分析 采用SPSS 25.0 软件包进行数据处理,计数资料以n(%)表示,采用χ2检验。服从正态分布的计量资料以均数±标准差(±s)表示,两两比较采用独立样本t检验。相关性分析用Pearson 法。P<0.05 为差异有统计学意义。
2 结果
2.1 正常组与障碍组一般资料对比 见表1。正常组与障碍组糖尿病、高血压、腔隙性梗死或TIA史、房颤、收缩压、舒张压、TC,TG,LDL-C,HDL-C,Scr 及尿酸之间差异均无统计学意义(均P>0.05);障碍组FBG,Hcy,PTGS2 和CHI3L1水平均显著高于正常组,差异有统计学意义(均P<0.05)。
表1 正常组与障碍组一般资料对比[(±s),n(%)]

表1 正常组与障碍组一般资料对比[(±s),n(%)]
项目正常组(n=60)障碍组(n=36)t/χ2P糖尿病(有/无)7/539/272.8800.090高血压(有/无)9/5111/253.3010.069腔隙性梗死或TIA 史(有/无)17/4315/211.8000.180房颤(有/无)5/557/292.5400.111收缩压(mmHg)137.25±47.86138.56±53.690.1240.902舒张压(mmHg)80.17±15.3481.72±16.540.4650.643 TC(mmol/L)5.11±0.345.08±0.420.3830.703 TG(mmol/L)1.97±0.251.95±0.230.3910.697 LDL-C(mmol/L)2.03±0.312.06±0.410.4060.686 HDL-C(mmol/L)1.61±0.631.54±0.530.5580.578 FBG(mmol/L)5.86±0.347.86±0.5621.803<0.001 Scr(μmol/L)71.34±13.6473.26±18.150.5890.558尿酸(μmol/L)308.24±72.51309.62±85.670.0840.933 Hcy(μmol/L)17.28±3.7525.16±5.678.196<0.001 PTGS2(pg/ml)17.86±5.4029.30±9.467.553<0.001 CHI3L1(pg/ml)7.51±2.6613.04±4.068.065<0.001
2.2 多因素Logistic 回归分析脑血管病患者认知功能障碍的影响因素 见表2。以脑血管病患者是否有认知功能障碍为因变量(正常=0,障碍=1),以FBG,Hcy,PTGS2,CHI3L1 为自变量(连续变量)进行多因素Logistic 回归分析,结果显示,FBG,Hcy,PTGS2 和CHI3L1 是认知功能障碍的独立危险因素(均P<0.05)。

表2 多因素Logistic 回归分析脑血管病患者认知功能障碍的影响因素
2.3 脑血管病患者血清PTGS2,CHI3L1 与FBG,Hcy 相关性分析 PTGS2 与FBG,Hcy 呈正相关(r=0.368,0.551,均P<0.05),CHI3L1 与FBG,Hcy 呈正相关(r=0.510,0.376,均P<0.05)。
2.4 血清PTGS2,CHI3L1 及二者联合预测脑血管病患者认知功能障碍的价值 见表3,图1。ROC曲线显示,PTGS2 预测认知功能障碍的AUC 为0.819,截断值为23.27 pg/ml,其敏感度、特异度分别为77.78%,80.00%;CHI3L1 预测认知功能障碍的AUC 为0.829,截断值为10.88 pg/ml,其敏感度、特异度分别为72.22%,85.00%;二者联合预测认知功能障碍的AUC 为0.902,高于二者单独预测(Z=2.089,2.293;P=0.037,0.021),其敏感度、特异度分别为77.78%,98.33%。

图1 血清PTGS2,CHI3L1 及二者联合预测脑血管病患者认知功能障碍的ROC 曲线
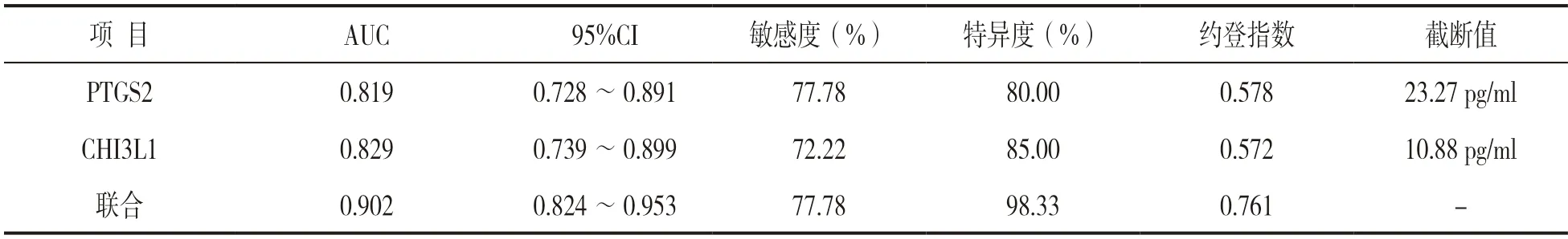
表3 血清PTGS2,CHI3L1 及二者联合对脑血管病患者认知功能障碍的预测价值
3 讨论
脑小血管疾病是造成认知功能障碍的常见原因,认知功能障碍早期症状隐匿、易被忽视,通常以逐步渐进的模式出现,进展缓慢,并影响大脑处理速度、复杂注意力和额叶执行功能[9],一旦确诊通常已发展为不可逆转的痴呆,常对患者的日常生活造成负面影响。随着医学技术的发展,血清因子生物标志物在临床上的研究及应用越来越普遍,血清因子常因其高特异度用于疾病的诊断。与脑小血管病有关的血清因子近年来研究也越来越多,如黄刚等[10]发现血清皮质醇与老年脑小血管负担呈正相关,可能是认知功能损害的潜在因素,赵振华等[11]表明机体维生素D 的减少与脑小血管严重程度有关,但关于评估认知功能障碍发生方面的血清因子的研究较少,因此寻找可能用于评估脑小血管疾病认知功能障碍发生情况的生物标志物对于病情的早期发现十分重要。
环氧化酶(COX)是一种氧化还原酶,是多种脑血管病相关炎症因子,是具有氧化酶和过氧化氢酶活性的双功能酶[12]。也是前列腺素(PGs)、血栓烷A2(thromboxane A2,TXA2)和花生四烯酸代谢的关键酶。前列腺素E2(prostaglandin E2,PGE2)参与炎症,TXA2 参与血小板聚集和血管收缩[13]。目前在人体中有两种形式的COX:COX-1和COX-2,COX-2 是诱导型,可被细胞因子、生长因子和激素高度诱导,如癌基因、细胞因子、生长因子、内毒素、致癌物、催化PGE2,它仅在细胞参与炎症或肿瘤的生理和病理过程时高表达,介导炎症反应[14]。认知能力下降常由相互作用的神经退行性和血管通路驱动,其中脑小血管疾病起了重要作用。COX-2 的激活被认为是大脑中神经炎症的促发因素,已知大脑中的神经炎症过程会导致神经元损伤,可能因此导致认知能力下降[15],ZHU 等[16]发现,癫痫小鼠模型表现出COX-2 及其主要产物PGE2 水平的增加,以及海马中的神经炎症和神经元损伤,对COX-2 的药理学抑制显著减少了海马神经炎症和神经元损伤,并减轻小鼠的认知功能障碍。本研究首先分析前列腺素内过氧化物合酶2(PTGS2)在脑血管病患者中的表达情况,发现血清PTGS2 在障碍组血清中表达水平高于正常组,提示PTGS2 可能与脑血管病患者认知功能障碍的发生有关,继而进行了多因素分析,结果发现PTGS2 是脑血管病患者出现认知功能障碍的影响因素,进一步说明了PTGS2 可能参与了脑血管病患者认知功能障碍的发生过程,推测与COX-2/PGE2信号通路介导神经炎症和神经元损伤认知功能障碍有关[16]。为探究PTGS2 应用于脑血管病患者的实际临床价值,采用了ROC 曲线分析,结果显示,PTGS2 预测认知功能障碍的AUC 为0.819,具有一定价值,但敏感度特异度均不高,因此需结合其他指标共同预测。
数据表明,较高水平的神经炎症和脑血管生物标志物与认知能力下降有关[17]。大鼠甲壳质酶蛋白40(YKL-40)又称几丁质酶-3 样蛋白1(CHI3L1),是一种分泌型糖蛋白,在中枢神经系统中由小胶质细胞和星形胶质细胞表达,并且被认为是阿尔茨海默病(AD)中最有希望的神经炎症生物标志物之一,较高的CHI3L1 参与神经炎症和神经变性之间的联系[18],研究表明,CHI3L1 在多种以神经炎症为特征的神经退行性疾病中上升,是诊断神经退行性疾病、基于血液的临床可靠生物标志物[19]。在本研究中,障碍组血清CHI3L1 水平显著高于正常组,且多因素分析结果表明,CHI3L1 亦是认知功能障碍的影响因素,提示CHI3L1 可能也参与了脑血管病患者认知功能障碍的发生过程,分析原因,在脑血管疾病患者中,反应性星形胶质细胞亚群在血液中释放脑源性CHI3L1,增加神经炎症,加剧神经病变,导致认知功能障碍的发生[20]。
田婧等[21]研究表明,Hcy 水平升高是脑血管疾病患者出现认知功能障碍的危险因素,与本研究结果相似,可能是高水平的Hcy 抑制一氧化碳的合成、释放,造成血管内皮细胞损伤及功能障碍,使血脑屏障和脑部血流异常,本研究中,障碍组血清PTGS2,CHI3L1 与Hcy 正相关,提示PTGS2,CHI3L1 均可能与Hcy 共同调节脑血管病患者的脑部血流异常状况,并与认知功能障碍的发生密切相关。ROC 曲线显示,血清PTGS2,CHI3L1 联合对认知功能障碍预测的AUC 为0.902,提示血清PTGS2,CHI3L1 联合预测脑血管病患者认知功能障碍的价值较高,具有一定的临床应用价值。
综上所述,PTGS2,CHI3L1 在脑血管病认知功能障碍患者血清中高表达,二者均与脑血管病患者认知功能障碍有关,且二者联合对脑血管病发生认知功能障碍具有一定的预测价值。

