缺氧缺血性脑病新生儿血清miR-139-5p,HDAC4和GFAP表达水平及其临床价值研究
张丽蓉,林 艾,杨 丽(广元市中心医院新生儿科,四川广元 628000)
缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是围生期窒息导致的新生儿脑部缺氧缺血性脑损伤疾病。HIE 临床主要表现为意识障碍、昏迷等[1]。脑损伤严重患儿可能发生新生儿智力障碍、多器官功能损伤等永久性神经系统后遗症[2],严重影响神经系统发育,因此脑损伤严重程度的早期判定是临床研究热点。微小核糖核酸(microRNA,miR)是非编码RNA,可作为神经系统疾病诊断指标[3]。据报道,miRNA 与神经元损伤和神经炎症有关,可能在HIE 的发病机制中起关键作用[4]。miR-139-5p 与神经系统疾病发展密切相关[5]。YAO 等[6]发现miR-13p-5p 可能与缺血性脑卒中患者脑缺血/再灌注损伤的减轻机制有关。SAHA 等[7]研究显示,海马组织组蛋白去乙酰化酶(histonedeacetylase-4,HDAC4)的异常表达与脑损伤后的焦虑、抑郁行为和记忆功能有关。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)与新生儿窒息后脑损伤严重程度有关[8]。目前关于miR-139-5p,HDAC4 和GFAP 在HIE 患儿血清中的表达情况及其在之间关系的研究较少,基于此,本研究通过检测miR-139-5p,HDAC4 和GFAP 在HIE 患儿血清中表达情况,并分析其与脑损伤严重程度的关系,以期为临床预防HIE 脑损伤进展提供参考。
1 材料与方法
1.1 研究对象 收集2017年1月~2022年3月广元市中心医院分娩的HIE 新生儿72 例为研究对象(研究组),其中男性32 例,女性40 例。纳入标准:①符合HIE 诊断标准,参考2005年《新生儿缺氧缺血性脑病诊断标准》[9];②患儿出生时存在神经系统症状;③胎龄≥37 周。排除标准:①先天性脑畸形患儿;②出生时伴随有严重的心、肝、肾功能异常;③电解质紊乱、颅内出血和产伤等原因引起的抽搐;④血液系统疾病患儿;先天性遗传代谢性疾病、宫内感染及其他先天性疾病所引起的脑损伤患儿;⑤中枢神经系统感染、胆红素脑病。以同期健康的足月新生儿75 例为对照组,其中男性36例,女性39 例。二组基线资料比较见表1。家属均知情同意,研究经广元市中心医院伦理委员会批准同意(伦理批号:2016-11-098)。
表1 研究组和对照组基线资料比较[n(%),±s]
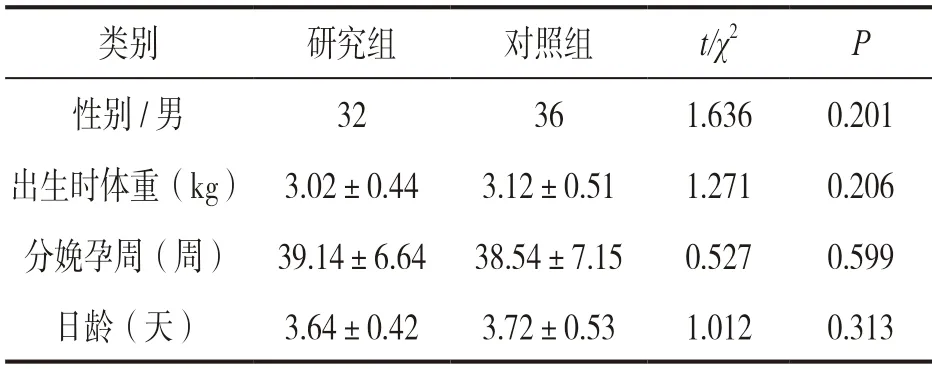
表1 研究组和对照组基线资料比较[n(%),±s]
类别研究组对照组t/χ2P性别/男时体重(k32361.6360.201出生g) 3.02±0.443.12±0.511.2710.206分娩孕周(周) 39.14±6.64 38.54±7.150.5270.599日龄(天)3.64±0.423.72±0.531.0120.313
1.2 仪器与试剂 实时荧光定量PCR 仪(美国BIO-RAD 公司),总RNA 提取试剂盒[货号:DP419,天根生化科技(北京)有限公司],cDNA合成试剂盒[货号:FP314,天根生化科技(北京)有限公司],血清GFAP 水平用GFAP ELISA 试剂盒(上海西唐生物科技有限公司)。
1.3 方法
1.3.1 临床资料收集:收集新生儿性别、胎龄、平均日龄、出生时体重、出生后1 min 内阿氏评分(Apgar 评分)、出生后5 min 内Apgar 评分、产妇基本情况(妊娠期高血压、母体贫血、产程异常、胎盘异常、胎膜早破、羊水污染、母体高龄、产前发热、分娩方式等)等。
1.3.2 血清样本采集:在新生儿出生后24h 内采集股静脉血2 ml,离心(3 500 r/min,15 min),留上清,置于-80℃冰箱保存。
1.3.3 实时荧光定量PCR 检测血清中miR-139-5p,HDAC4 表达水平:血清总RNA 用总RNA 提取试剂盒提取,然后用cDNA 合成试剂盒逆转录合成cDNA。用实时荧光定量PCR 仪对miR-139-5p,HDAC4 进行扩增。反应条件:95℃ 90s;95℃30s,63℃30s,72℃15s,40 个循环。反应引物由上海生工生物工程股份有限公司合成,miR-139-5p,F:5’-i:TCTACAGTGCACGTGTCTCCAG-3’,R:5’-ACCTGCGTAGGTAGTTTCATGT-3’;U6,F:5’-GCTTCGGCAGCACATATACTAAAAT-3’,R:5’-CGCTTCACGAATTTGCGTGTCAT-3’;HDAC4,F:5’-GTGATGGGATTTCCATTGAT-3’,R:5’-CAGTGGTTCAGATTCCGGTGG-3’;β-actin,F:5’-CATCCGTAAAGACCTCTATGCCAAC-3’,R:5’-ATGGAGCCACCGATCCACA-3’。miR-139-5p以U6为内参,HDAC4以β-actin为内参。采用2-ΔΔCt算法计算miR-139-5p,HDAC4 的相对表达量。
1.3.4 血清GFAP 水平检测:血清GFAP 水平用GFAP ELISA 试剂盒检测,具体操作严格按照试剂说明进行。
1.3.5 HIE 分级标准[10]:轻度:瞳孔轻微放大,拥抱反射活跃,兴奋与抑制交替发生,肌张力升高或正常,脑电图正常,但未发生中枢性呼吸衰竭;中度:嗜睡,肌张力减退,患儿的吮吸和拥抱反射能力减弱,脑电图低电压,发生中枢性呼吸衰竭。重度:瞳孔放大,昏迷,存在意识障碍,肌肉松软,无吮吸及拥抱反射,脑电图抑制,发生惊厥和中枢呼吸衰竭。将HIE 患儿分为轻、中度(轻中度组,n=49)和重度(重度组,n=23)。
1.3.6 新生儿行为神经测定(neonatal behavioral neurological assessment,NBNA)评分:新生儿出生后在安静温暖房间内10 min 内完成NBNA 评分[11],包括5 个部分,总分40 分,NBNA 评分<35 分为异常。
1.4 统计学分析 采用软件SPSS 21.0 对数据进行分析,计数资料用n(%)表示,采用χ2检验。计量资料符合正态分布的以平均值±标准差(±s)表示,两组间比较行独立样本t检验。计量资料不符合正态分布的以中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验。应用二元Logistic 回归分析影响HIE 患儿重度脑损伤发生的因素。采用Pearson 法分析血清miR-139-5p 与HDAC4 及二者与GFAP 的相关性,Spearman分析miR-139-5p,HDAC4 与NBNA 评分、出生后1 min 内Apgar 评分相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 研究组和对照组血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较 见表2。与对照组相比,研究组血清GFAP 水平、HDAC4 相对表达水平较高,miR-139-5p 相对表达水平、NBNA 评分较低,差异有统计学意义(均P<0.05)。
表2 研究组和对照组血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较(±s)
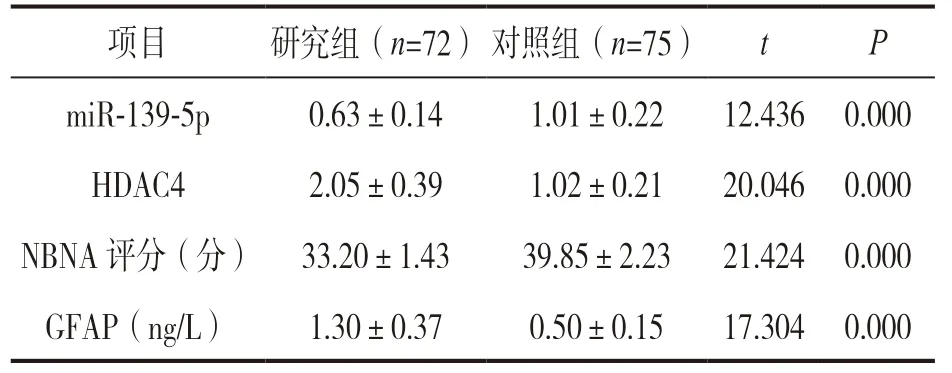
表2 研究组和对照组血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较(±s)
项目研究组(n=72)对照组(n=75)tP miR-139-5p0.63±DAC42.05±评分(分) 33.20±0.141.01±0.2212.436 0.000 H0.391.02±0.2120.046 0.000 NBNA 1.4339.85±2.2321.424 0.000 GFAP(ng/L)1.30±0.370.50±0.1517.304 0.000
2.2 不同脑损伤程度HIE 患儿血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较 见表3。与轻中度组相比,重度组血清GFAP 水平、HDAC4相对表达水平较高,miR-139-5p 相对表达水平、NBNA 评分较低,差异有统计学意义(均P<0.05)。
表3 不同脑损伤程度患儿血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较(±s)

表3 不同脑损伤程度患儿血清miR-139-5p,HDAC4,NBNA 评分、GFAP 水平比较(±s)
项 目轻中度组(n=49)重度组(n=23)tP miR-139-5p0.74±0.160.38±0.109.900 0.000 HDAC 41.87±(分) 34.460.402.43±0.375.669 0.000 NBNA 评分±1.3830.52±1.5410.884 0.000 GFAP(ng/L)1.16±0.331.61±0.474.690 0.000
2.3 轻中度组和重度组HIE 患儿临床特征比较见表4。重度组产程异常比例、羊水污染比例高于轻中度组,重度组出生后1 min 内Apgar 评分、出生后5 min 内Apgar 评分低于轻中度组,差异有统计学意义(均P<0.05)。
表4 轻中度组和重度组HIE 患儿临床特征比较[n(%),±s,M(P25,P75)]
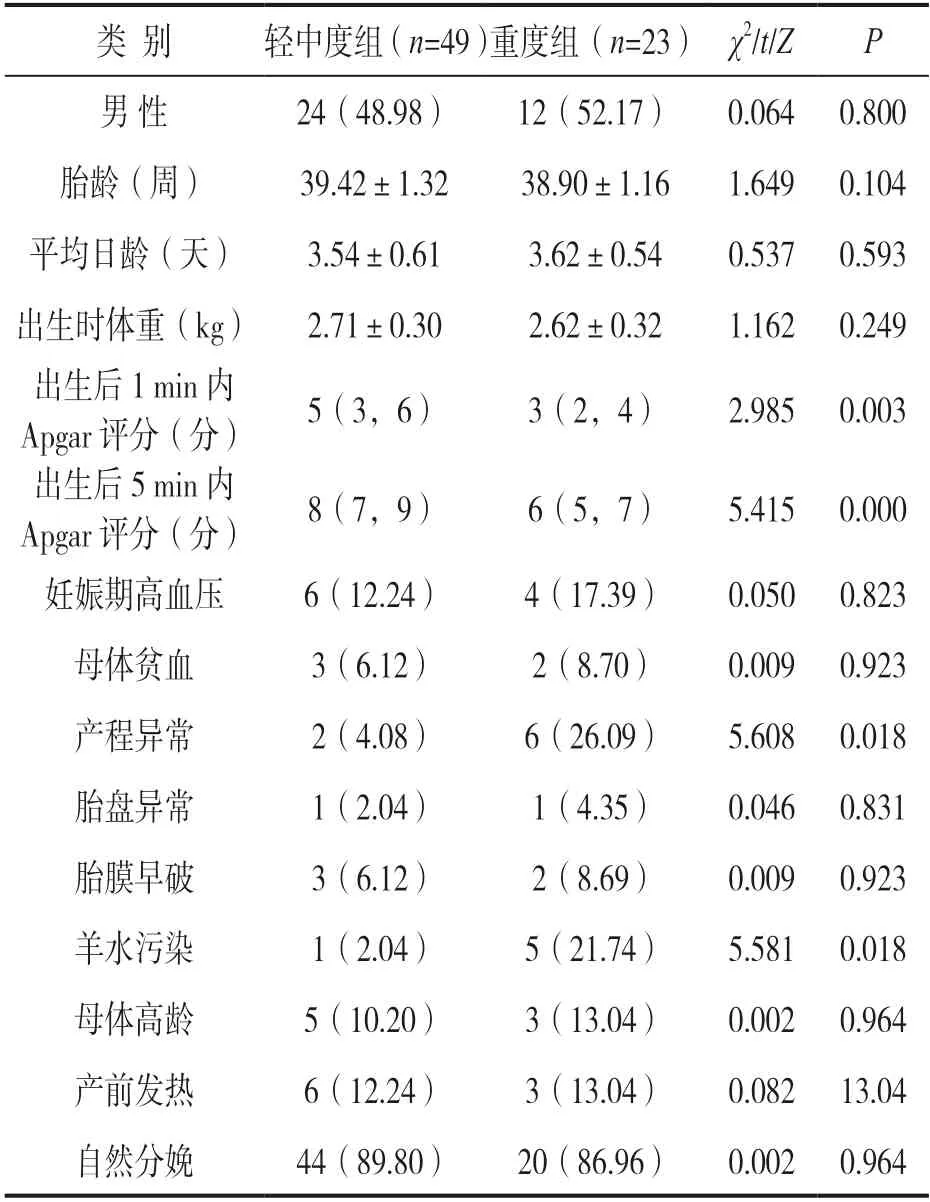
表4 轻中度组和重度组HIE 患儿临床特征比较[n(%),±s,M(P25,P75)]
类 别轻中度组(n=49)重度组(n=23) χ2/t/ZP男 性24(48.98)12(52.17)0.064 0.800胎龄(周)39.42±1.3238.90±1.161.649 0.104平均日龄(天)3.54±0.613.62±0.540.537 0.593出生时体重(kg)2.71±0.302.62±0.321.162 0.249出生后1 min 内Apgar 评分(分)5(3,6)3(2,4)2.985 0.003出生后5 min pgar 评分(分内A)8(7,9)6(5,7)5.415 0.000妊娠期高血压6(12.24)4(17.39)0.050 0.823母体贫血3(6.12)2(8.70)0.009 0.923产程异常2(4.08)6(26.09)5.608 0.018胎盘异常1(2.04)1(4.35)0.046 0.831胎膜早破3(6.12)2(8.69)0.009 0.923羊水污染1(2.04)5(21.74)5.581 0.018母体高龄5(10.20)3(13.04)0.002 0.964产前发热6(12.24)3(13.04)0.082 13.04自然分娩44(89.80)20(86.96)0.002 0.964
2.4 影响HIE 患儿重度脑损伤发生的多因素Logistic 回归分析 见表5。以HIE 患儿是否发生重度脑损伤为因变量(是=1,否=0),以miR-139-5p,HDAC4,NBNA 评分、GFAP,出生后1 min 内Apgar 评分、出生后5 min 内Apgar 评分(均原值代入)、产程异常(是=1,否=0)、羊水污染(是=1,否=0)为自变量进行Logistic 回归分析,结果显示,miR-139-5p 低表达、HDAC4 高表达、低NBNA 评分、低出生后1 min 内Apgar 评分是影响HIE 患儿重度脑损伤发生的危险因素(均P<0.05)。

表5 影响HIE 患儿重度脑损伤发生的多因素Logistic 回归分析
2.5 HIE 患儿血清miR-139-5p 与HDAC4 相关性分析 生物信息学网站(targetscan)显示,miR-139-5p 与HDAC4 存在结合位点,见图1。Pearson分析显示,血清miR-139-5p 表达水平与HDAC4 呈负相关(r=-0.579,P<0.05)。
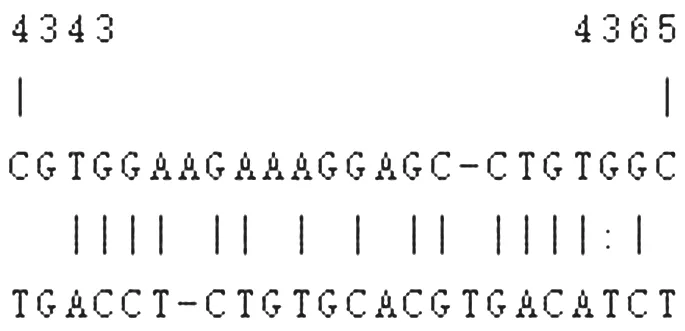
图1 miR-139-5p 与HDAC4 结合位点
2.6 HIE 患儿miR-139-5p,HDAC4 与GFAP,NBNA评分、出生后Apgar 评分相关性分析 Pearson 分析显示,血清miR-139-5p 表达水平与GFAP 呈负相关(r=-0.416,P<0.05),血清HDAC4 表达水平与GFAP 呈正相关(r=0.437,P<0.05)。Spearman 分析显示,血清miR-139-5p 表达水平与NBNA 评分、出生后1 min 内Apgar 评分、出生后5 min 内Apgar 评分呈正相关(r= 0.398,0.367,0.348,均P<0.05);血清HDAC4 表达水平与NBNA 评分、出生后1 min 内Apgar 评分、出生后5 min 内Apgar 评分呈负相关(r=-0.364,-0.345,-0.332,均P<0.05)。
3 讨论
缺氧缺血性脑病(HIE)是围生期窒息引起的中枢神经系统疾病,治疗不及时易导致新生儿神经系统后遗症[12]。新生儿HIE 是新生儿残疾或死亡的原因之一,根据病情的严重程度,一般可分为轻度、中度和重度,轻度一般对新生儿的神经发育不会产生影响或产生轻微影响,而中度和重度则会导致新生儿神经功能发生永久性缺损甚至死亡[13]。新生儿HIE 发展为永久性脑损伤前存在一段黄金治疗时间,此时间段内有效进行神经功能保护可阻止神经元的凋亡和坏死,避免神经系统永久性损伤[14]。因此探究新生儿HIE 脑损伤严重程度的相关因素,对改善HIE 预后有重要意义。
miRNAs 可通过调控mRNA 翻译和稳定性来介导各种蛋白质的表达[15]。大量研究为miRNA在新生儿HIE 中的作用提供了越来越多的证据。ZHANG 等[16]研究显示,脊髓损伤大鼠神经细胞中miR-139-5p 表达下调,过表达的miR-139-5p 可改善脊髓损伤大鼠的运动功能、减轻痛觉及神经细胞凋亡。组蛋白去乙酰化酶4(HDAC4)的失调与神经发育和神经退行性疾病相关[17],HDAC4 在神经元细胞中可差异表达,其在缺血再灌注大鼠海马CA1 区表达升高[18]。LUO 等[19]在培养细胞中通过氧-葡萄糖剥夺/再给氧(OGD/R)模拟脑缺血再灌注损伤,发现HDAC4 抑制剂丙戊酸(VPA)可以保护神经元免受OGD/R 损伤,本研究发现,研究组血清miR-139-5p 相对表达水平低于对照组,重度组血清miR-139-5p 相对表达水平低于轻中度组,研究组血清HDAC4 相对表达水平高于对照组,重度组血清HDAC4 相对表达水平高于轻中度组,提示miR-139-5p,HDAC4 均与新生儿HIE 的发生及病情严重程度有关,二者均可能参与了新生儿HIE 发生及病情进展。
胶质纤维酸性蛋白(GFAP)在脑组织中主要维持星形胶质细胞的结构和功能,当中枢神经受损后,星形胶质细胞迅速活化并促进GFAP 迅速合成,且新生儿窒息后脑损伤重度组血清GFAP 水平明显高于轻、中度组[8]。MA 等[20]研究证实,抑制HDAC4 可通过降低肌生成素MYOG 表达来缓解去神经诱导的肌肉萎缩,HDAC4 抑制剂可能是治疗神经源性肌肉萎缩的潜在药物,表明低表达HDAC4 可能缓解神经诱导的肌肉萎缩。本研究发现,研究组NBNA 评分低于对照组,重度组NBNA 评分低于轻、中度组,研究组血清GFAP 水平高于对照组,重度组血清GFAP 水平高于轻中度组,提示HIE 患儿随着脑损伤程度加重,神经功能缺损严重。经查证发现,有文献认为HDAC4 在脑组织损伤的修复中起到了积极作用,也有文献认为HDAC4 促进了神经元的凋亡进程,相关研究值得进一步探讨。本研究进一步分析显示,HIE 患儿血清miR-139-5p,HDAC4 均与GFAP 水平具有相关性,提示miR-139-5p,HDAC4 可能影响HIE 患儿脑神经功能。且Logistic 回归分析显示,miR-139-5p,HDAC4,NBNA 评分、出生后1 min 内Apgar评分是HIE 患儿重度脑损伤发生的影响因素,说明以上因素均可能影响HIE 患儿重度脑损伤发生,此外,NBNA 评分可以反映早产儿脑发育状况、规律及脑损伤后的发展趋势,Apgar 评分可用于新生儿窒息状况评估,与新生儿脑损伤有关[21],而本研究中血清miR-139-5p,HDAC4 表达水平与NBNA评分、出生后1 min 内Apgar 评分、出生后5 min内Apgar 评分具有紧密相关性,提示miR-139-5p,HDAC4 均可能与HIE 患儿重度脑损伤有关。
miRNA 可以识别靶基因序列,调控靶基因表达,从而控制多种疾病的发生发展,如:ZHAO 等[22]研究显示,miR-139-5p 在复发性癫痫样放电大鼠神经细胞中表达下调,miR-139-5p 高表达可靶向负调控Notch 通路减轻复发性癫痫样放电诱导的神经细胞的氧化应激和神经细胞凋亡;DUAN 等[23]模拟阿尔茨海默病发病机理中的神经损伤,发现miR-223-3p/HDAC4 轴与神经损伤有关,上调miR-223-3p,抑制HDAC4,可以改善神经损伤,抑制凋亡,诱导增殖,提高生存率。Target Scan Human 网站预测miR-139-5p 与HDAC4 存在靶向结合位点,以上均表明miR-139-5p 可通过调控靶基因表达参与疾病的发生,而本研究相关性结果同样提示miR-139-5p 与HDAC4 间存在负相关关系,与网站预测结果相符,提示二者可能相互作用,共同影响HIE 患儿脑损伤的发生过程,关于其具体机制后续还需进一步研究。
综上所述,HIE 患儿血清中miR-139-5p 表达降低,HDAC4 表达升高,miR-139-5p,HDAC4 与HIE 患儿脑损伤严重程度有关,推测miR-139-5p,HDAC4 共同参与HIE 的发生发展,有望作为诊断HIE 重度脑损伤重要指标。本研究局限性在于:首先,样本量较小,可能导致部分结果有所偏倚,缺乏普适性;其次,有关miR-139-5p,HDAC4 参与HIE 发生发展的作用机制尚未明确。因而后期将扩大样本量进一步验证,同时结合基础实验、细化分组,进一步明确miR-139-5p,HDAC4 的具体调控机制,为后期HIE 病情诊断、治疗提供有力的参考依据。

