基于两次发酵法遵义特色泡辣椒游离氨基酸组成的主成分分析及综合评价
许九红,王修俊,3, ,聂黔丽,李佳敏,胡荣念,张 露
(1.贵州大学酿酒与食品工程学院,贵州贵阳 550025;2.贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;3.贵州大学辣椒产业技术研究院,贵州贵阳 550025)
辣椒(Capsium annumL.)是一种全球种植和消费的辛香蔬菜作物[1],富含辣椒素、维生素C、多酚等营养成分[2-4],具有抗菌、除湿、祛寒等功效[5],鉴于全球对辣椒的高商业需求,辣椒的加工方式也越来越多样化,可发酵、炒制、干燥等[6],其中泡辣椒作为西南地区特有的调味佳品[7],以其独特的风味、鲜嫩的味道和增食欲、助消化的功效深受广大消费者的喜爱。
游离氨基酸(free amino acids,FAAs)作为主要的味觉活性化合物之一,不仅是一种重要的营养物质,同时也是重要的呈香物质,表现出鲜、甜、酸、苦及涩等味感,这些味感形成了食物丰富的味觉层次[8-11]。因此,明确泡辣椒中游离氨基酸种类、含量以及呈味特性,对提高泡辣椒加工制品的营养与品质具有重要意义。近年来,已有学者对泡辣椒中的风味成分变化[12-14]、发酵菌剂制备[15]、发酵技术进行了大量研究[16-17],但由于泡辣椒是地方特色食品,作坊式生产居多,目前大多以传统自然一次发酵法为主,发酵周期长,发酵过程不稳定,导致产品品质差异大[18],从而制约了泡辣椒的工业化生产。而遵义特色泡辣椒是首先通过传统自然一次发酵的高盐环境解决泡辣椒半成品的脆度、色泽等问题,使首次发酵工艺可控化且能达到更好的保鲜效果,进一步通过接菌二次强化发酵明显缩短发酵周期,提升泡辣椒半成品的品质和风味,从而有效解决了遵义泡辣椒传统自然一次发酵加工技术中泡辣椒品质不稳定,风味不足以及潜在的食品安全问题。但是目前对于两次发酵遵义特色泡辣椒风味品质的文献报道甚少,对于进一步推动两次发酵技术广泛应用于辣椒加工行业缺乏足够的数据和理论支撑。
为此本研究以遵义新鲜红辣椒为原料,以本团队前期研究得到的特色泡辣椒最佳两次发酵工艺为基础,比较分析遵义特色泡辣椒发酵过程中脆度、色泽、氨基酸态氮及游离氨基酸的综合变化,并运用主成分分析两次发酵泡辣椒中游离氨基酸的品质,以期为两次发酵技术实际应用提供更全面的理论依据。
1 材料与方法
1.1 材料与仪器
遵义新鲜红辣椒 花溪区农贸市场;食盐、蔗糖食品级,花溪区沃尔玛超市;氯化钙、D-异抗坏血酸钠、氢氧化钠、酚酞、邻苯二甲酸氢钾 食品级,连云港景悦食品配料有限公司;氨基酸混合标准品日本和光药业株式会社;浓盐酸、氢氧化钠、酚酞、邻苯二甲酸氢钾、磺基水杨酸(均为分析纯)、钙标准溶液、甲醛(36%~38%)天津科密欧化学试剂有限公司;戊糖乳杆菌Lps5106、植物乳杆菌Lpm5122、发酵乳杆菌LF-8002[19]发酵菌种均选自本研究团队前期分离保存的优势菌株。
FA2002B 型电子精密天平 上海越平科学仪器有限公司;S-433D 氨基酸自动分析仪 日本日立公司;Allegra X Centrifuge 冷冻离心机 Beckman Coulter;CT310K 物性测定仪 北京盈盛恒泰科技责任有限公司;全自动HP-2136 便携式色差仪 上海临嘉科教仪器有限公司。
1.2 实验方法
1.2.1 泡辣椒的制备 操作要点:将遵义新鲜红辣椒(CG)清洗晾干后进行传统自然一次发酵(料液比1:1.5,17%食盐、0.5%氯化钙、0.01% D-异抗坏血酸钠)得到传统自然一次发酵30 d 泡辣椒半成品(SF-1);在此基础上分别进行处理,沿用上述工艺发酵得到传统自然一次发酵150 d 泡辣椒(SF-2);另进行脱盐处理,使泡辣椒半成品品质在较好可接受度的基础上,控制其盐含量在7%~8%后进行二次强化发酵,控制戊糖乳杆菌Lps 5106、植物乳杆菌Lpm 5122、发酵乳杆菌LF-8002 配比为2:1:1,接种量6%,发酵温度为30 ℃,强化发酵64 h 得到遵义特色发酵泡辣椒(EF)。工艺流程如图1 所示。

图1 遵义特色泡辣椒的制备工艺流程Fig.1 Preparation process of Zunyi characteristic bubble pepper
1.2.2 脆度测定 参照张甫生等[20]的方法,并稍作改动,采用物性测定仪测定,用硬度表征样品脆度,将辣椒切分成2 cm×2 cm 左右大小,选用TA41 探头,操作模式选择压缩返回模式,预测试速度1 mm/s,测试速度1 mm/s,测试后速度1 mm/s,压缩比25%,压缩力5 g。平行测定8 次,取其平均值作为样品脆度。
1.2.3 色泽测定 使用基于CIEL*、a*、b*均匀色系统的全自动便携式色差仪对泡辣椒进行色泽的测定,平行测定10 次,取其平均值。△E为色差,表示所测样品与新鲜红辣椒样品之间的色泽的差值,△E值越小则泡辣椒色泽损失越小。
式中:L、a、b:分别为新鲜红辣椒样品的亮度值、红绿度值、黄蓝度值;L*、a*、b*:分别为样品亮度值、红绿度值、黄蓝度值。
1.2.4 氨基酸态氮测定 参考GB 5009.235-2016《食品中氨基酸态氮的测定》测定。
1.2.5 游离氨基酸的测定 参考何春霞等[21]的方法,取一定量的辣椒样品匀浆,然后准确称取1.00 g左右样品,用50 mL 0.01 mol/L 盐酸超声浸提30 min;然后将其摇匀后过滤,准确吸取滤清液2 mL 于离心管中,加入2 mL 8%磺基水杨酸将其混匀静置15 min后离心(10000 r/min,10 min),将离心后的上清液过0.45 μm 滤膜后上机氨基酸自动分析仪检测,每组实验做3 个平行,计算平均值和标准偏差。
1.3 数据处理
利用Excel 2010、SPSS 26.0 软件对数据分析,Origin 2018 对图形进行绘制,在相同条件下对每个指标的测定次数不少于3 次,数据记录方式为平均数±标准差(mean±SD),用不同小写字母表示P<0.05 的差异显著性。
2 结果与分析
2.1 泡辣椒中的基本理化指标含量测定分析
脆度、色泽及氨基酸态氮含量与氨基酸虽无直接关系,但是可以衡量泡辣椒发酵情况,是反映发酵产品品质的重要特征指标之一,结果如表1 所示。

表1 泡辣椒中的基本理化指标Table 1 Physicochemical indicators of pickled pepper
由表1 可知,泡辣椒在发酵过程中脆度逐渐降低,首次发酵150 d 后泡辣椒脆度降至2509.00±0.13 g,较新鲜辣椒降低6.09%,而两次发酵泡辣椒脆度为2578.00±0.04 g,降低3.51%,减少了泡辣椒组织在发酵过程中由于食盐高渗作用易发生过度软化的现象,从而保证了泡辣椒的脆性口感。∆E值在发酵过程中逐渐增加,首次发酵30 d 后泡辣椒半成品∆E值为1.67±0.061,150 d 后∆E值增加至1.84±0.043,较30 d 色泽损失9.24%,两次发酵特色泡辣椒∆E值为1.76±0.251,较30 d 色泽损失5.39%,表明两次发酵泡辣椒的颜色变化不如其他样品明显,色泽能较好地保持鲜红。氨基酸态氮在一定程度上可以反映辣椒原料中蛋白质分解程度,能反映泡辣椒中氨基酸和小分子肽的总体水平,是体现泡辣椒中鲜味物质的重要指标[22]。其中传统自然一次发酵150 d 泡辣椒中的氨基酸态氮含量在传统自然发酵一次发酵30 d 的基础上仅增加0.01 g/100 g,主要原因是处于高盐环境会抑制微生物的生长,同时也会抑制水解酶的水解反应[23]。而遵义特色泡辣椒中氨基酸态氮含量达到0.24 g/100 g,较新鲜辣椒和传统自然一次发酵30 d分别增加0.19、0.07 g/100 g,主要是因为脱盐处理解除了高盐环境的抑制作用,在乳酸菌的作用下乳酸菌分泌的蛋白水解酶会促进水解蛋白的生成,而发酵环境的酸化会导致水解蛋白水解成多肽和氨基酸,进而提高氨基酸态氮含量的增加[24],说明二次强化发酵可显著提高泡辣椒中鲜味物质含量。
2.2 泡辣椒中的游离氨基酸组成及含量变化分析
游离氨基酸的组成、含量及呈味特性对泡辣椒色、香、味的形成具有重要作用。对4 种样品中游离氨基酸的种类及含量进行检测分析,结果如表2 所示。
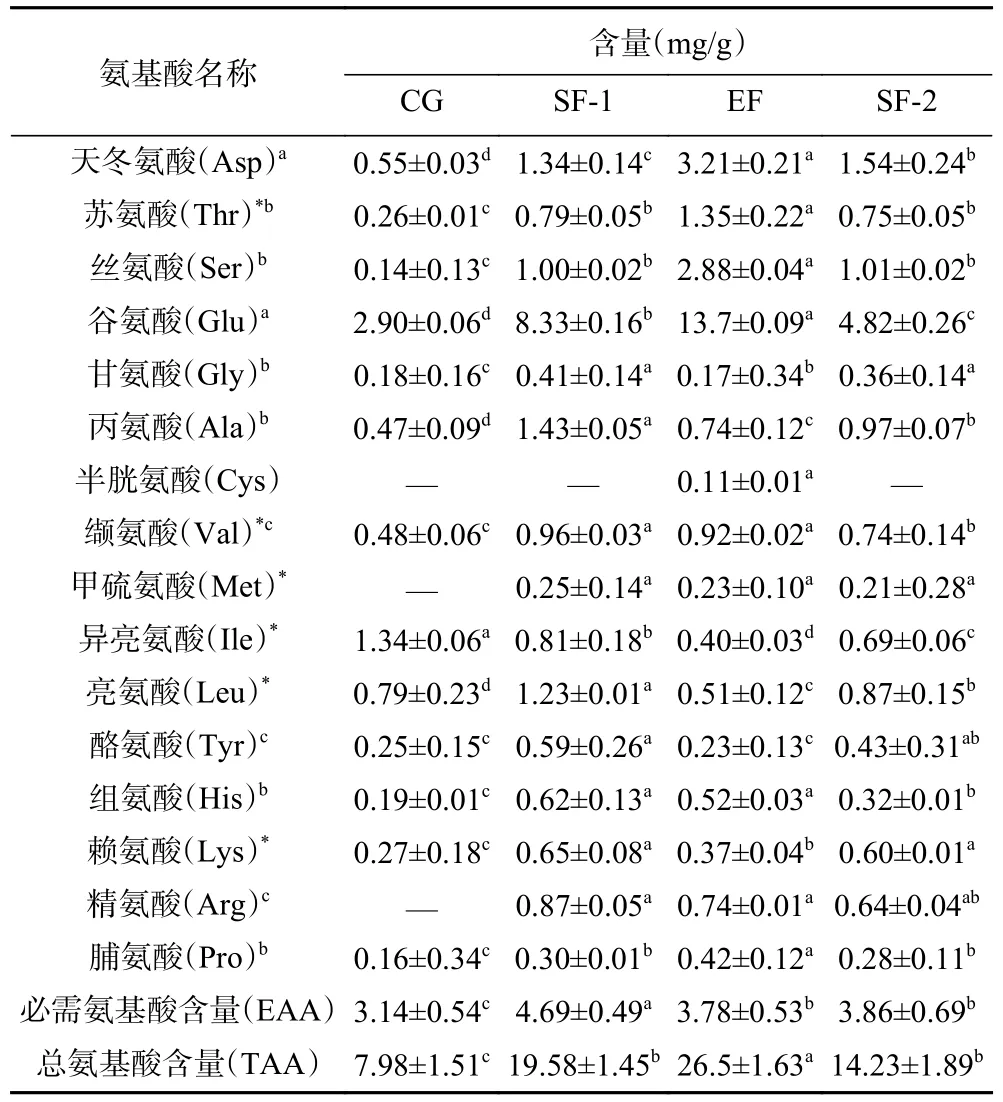
表2 自然与两次发酵特色泡辣椒中游离氨基酸组成Table 2 Free amino acid composition of characteristic pickled pepper with natural and two-fermentation
由表2 可知,传统自然一次及两次发酵遵义特色泡辣椒中共检测出天冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、谷氨酸(Glu)、甘氨酸(Gly)、丙氨酸(Ala)、半胱氨酸(Cys)、缬氨酸(Val)、甲硫氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、组氨酸(His)、赖氨酸(Lys)、精氨酸(Arg)、脯氨酸(Pro)等16 种游离氨基酸,与尹小庆等[25]报道结果一致。在4 种辣椒中分别检测到13、15、16、15 种氨基酸,其中包括Thr、Val、Met、Ile、Leu、Lys 6 种必需氨基酸,与Chen 等[11]的检测结果相类似。从表2 可以看出,不同泡辣椒中游离氨基酸的种类及含量存在较明显差异,在发酵过程中TAA 变化范围为7.98~26.50 mg/g,其中两次发酵特色泡辣椒中游离氨基酸的种类为16 种,TAA 含量达到最高为26.5 mg/g,且Cys 仅在两次发酵特色泡辣椒中检测出;传统自然一次发酵30、150 d 泡辣椒的TAA含量次之,分别为19.58、14.23 mg/g;新鲜辣椒中游离氨基酸的含量最低为7.98 mg/g。相对于新鲜辣椒,自然及两次强化发酵特色泡辣椒中游离氨基酸的种类及含量均显著增加(P<0.05),与之前对发酵糖菜的研究相似[26],本研究中His 含量在发酵前期增加,在自然发酵30 d 后逐渐下降,鉴于游离氨基酸是乳酸菌生长的必要组成部分,发酵后期His 含量的降低可能是由于乳酸菌的作用[11]。
2.3 呈味氨基酸分析
泡辣椒口感清脆鲜爽,与其所含丰富的呈味游离氨基酸有关。由图2 可知,各泡辣椒的呈味氨基酸组成轮廓相似,其中贡献最大的是鲜味氨基酸(flavor amino acid,FLA),其次为甜味氨基酸(sweet amino acid,SAA),苦味氨基酸(bitter amino acid,BAA)最低,与张婷等[27]的研究报道一致。两次发酵特色泡辣椒的模式图面积最大,说明所含呈味氨基酸普遍高于其他样品。FLA 相对含量为3.45~16.91 mg/g,两次发酵特色泡辣椒含量最高,可达16.91 mg/g,占TAA 总量的63.81%,其中Asp 及Glu 两类鲜味氨基酸阈值较低,Glu 的含量明显高于其他氨基酸,其在泡辣椒中的主要呈味特点是鲜爽带甜[28],能在一定程度上缓解苦涩味,对两次发酵特色泡辣椒良好滋味的形成具有明显的提升作用。SAA 相对含量为1.21~5.56 mg/g,其中两次发酵特色泡辣椒最高,可达5.56 mg/g,占总量的20.98%,Thr、Ser 主要表现为鲜爽甘甜的滋味特征。传统自然一次发酵30 d 泡辣椒中BAA 含量最高,可达3.04 mg/g,占总量的15.53%。由表2 及图2 可知,两次发酵特色泡辣椒中的TAA、EAA、FLA 及SAA 含量均最高,这是由于在二次强化发酵过程中除了蛋白质分解作用产生氨基酸外,还可通过乳酸菌将泡辣椒中的可溶性物质转化为氨基酸,从而使泡辣椒氨基酸总量升高[26]。

图2 自然与两次发酵特色泡辣椒的呈味氨基酸组成模式图(mg/g)Fig.2 Pattern diagram of flavored amino acid composition of natural and two-fermented characteristic pickled pepper (mg/g)
2.4 滋味活性值(taste activity value,TAV)分析
由图2 可知,各呈味氨基酸在不同泡辣椒中的含量存在差异,但是各种游离氨基酸所具有不同的呈味特征与其味觉感知阈值有直接关系,高含量的氨基酸对食品风味贡献不一定大,因此根据各游离氨基酸阈值计算TAV 对泡辣椒呈味氨基酸进行评价[29-30],TAV 越大,表示其对呈味贡献越大,当TAV<1 时,该呈味氨基酸对呈味贡献不大,呈味作用不显著[31]。传统自然一次发酵及两次发酵特色泡辣椒中氨基酸的TAV 见表3。

表3 自然及两次发酵特色泡辣椒中游离氨基酸TAV Table 3 Free amino acid TAV of natural and two-fermented characteristic pickled pepper
由表3 可知,在4 个样品中TAV>1 的氨基酸组成成分基本相同,在发酵泡辣椒中Asp、Glu、Ala、Val、His、Arg 的TAV 均大于1,对滋味的贡献最大,其中Glu 对泡辣椒风味的影响最大,TAV 值在9.67~45.67 之间,是最主要的呈鲜物质,具有增加泡辣椒的鲜美口味、缓解酸与苦涩等味道的特殊功效[32-33]。呈味氨基酸中Ser、Ala 等表现出令人愉悦的甜味,其中Ser 仅在两次强化发酵特色泡辣椒中TAV 大于1,Ala 和His 的TAV 在发酵泡辣椒中均大于1,对滋味贡献很大,能有效降低苦味,去除食物中令人不快的口味[34]。在呈味氨基酸中苦味氨基酸的种类最多,但因仅Val、Arg 的TAV 值在泡辣椒中大于1,可在一定程度上增加呈味的复杂性和辅助提升鲜度,同时当苦味氨基酸含量低于阈值时,可有效增强其他呈味氨基酸的呈味效果[35]。总体来看,不同泡辣椒中氨基酸的组成对其风味影响存在差异,表现为Thr、Gly、Met、Leu、Tyr 和Pro 对泡辣椒的整体风味贡献程度较小,其余各氨基酸Glu、His、Asp、Val、Arg、Ala、Ser、Cys、Ile、Lys 对泡辣椒风味均有不同程度的影响。
2.5 泡辣椒中游离氨基酸主成分分析
2.5.1 主成分分析 通过主成分分析对泡辣椒样品中游离氨基酸进行综合评价。利用降维原理,以16 种游离氨基酸指标作为初始自变量,然后将Asp、Thr、Ser、Glu、Gly、Ala、Cys、Val、Met、Ile、Leu、Tyr、His、Lys、Arg、Pro 数据标准化后依次编号为X1、X2、X3……X15、X16进行主成分分析,结果如表4~表5 所示。

表4 成分特征值、方差贡献率及累计贡献率Table 4 Component eigenvalues,variance contribution rate and cumulative contribution rate

表5 主成分特征向量与载荷矩阵Table 5 Eigenvectors and loading matrix of principal components
由表4 可知,经主成分分析共提取了3 个主成分,其中第1 主成分的方差贡献率最大为54.328%,表明第1 主成分对泡辣椒游离氨基酸品质的影响最大;第2 主成分的方差贡献率次之为37.660%;第3 主成分的方差贡献率为6.596%。前3 个主成分的成分特征值均大于1,且累积贡献率高达98.584%,结合图3 说明前3 个主成分可解释绝大部分变量信息,因此选用前3 个主成分已经足够描述游离氨基酸总体水平。

图3 主成分分析碎石图Fig.3 Principal component analysis gravel diagram
主成分载荷系数可以反映出泡辣椒中各氨基酸指标对相应主成分的影响程度和方向,载荷系数绝对值越大则表示该物质对主成分的贡献越大,当主成分越大时,所包含的这些氨基酸含量就越高,正负代表各变量对相应主成分的影响方向[36]。由表4 及图4可知,Thr、Glu、Val、Met、Ile、His、Arg 对主成分1 的贡献最大,其中Glu、Thr、Val、Met、His、Arg 的载荷值均大于0.9 且有正向影响,Ile 有负向影响;Gly、Cys、Leu、Tyr 对主成分2 的贡献最大,其中Gly、Leu 以及Tyr 的载荷值均大于0.9 且正向影响,Cys 有负向影响;Pro 对主成分3 的贡献最大,但是其载荷值小于0.8。因此,可认为以上11 种游离氨基酸是各样品的主要游离氨基酸,对泡辣椒的风味有主要的贡献作用。

图4 泡辣椒样品游离氨基酸的PCA 载荷图Fig.4 PCA load diagram of free amino acids in pickled pepper
2.5.2 基于泡辣椒游离氨基酸主成分分析的综合评价 根据表4、表5 以3 个主成分代表16 种游离氨基酸所表达的信息,建立游离氨基酸品质的评价模型,得到线性关系方程表达式如下,其中F1、F2、F3表示各个主成分的综合得分。
以每个主成分对应方差贡献率作为权重,对3个主成分得分进行加权求和,由评价函数F=0.543F1+0.377F2+0.660F3计算各样品的综合评分,综合得分高低反映样品游离氨基酸综合品质的高低,通过计算得到结果见表6。

表6 泡辣椒各主成分得分及综合得分Table 6 Principal component scores and comprehensive scores of pickled pepper
由表6 可知,第1、2、3 主成分中得分最高的分别为样品3、样品3、样品2,说明这三个成分对两次发酵特色泡辣椒的影响最大。根据综合得分F 值可以看出各样品的品质差异较大,综合得分最高为两次发酵特色泡辣椒,其次是首次发酵30 d 泡辣椒半成品,然后是传统自然一次发酵150 d 泡辣椒,新鲜辣椒得分最低。因此可认为两次发酵特色泡辣椒游离氨基酸综合品质更好。
3 结论
本文研究了两次发酵遵义特色泡辣椒的品质评价指标及游离氨基酸含量、组分和呈味特性分析,结果表明两次发酵遵义特色泡辣椒在发酵过程中脆度逐渐降低,∆E值逐渐增加,氨基酸态氮含量较其他辣椒高,传统自然一次发酵及两次发酵特色泡辣椒中游离氨基酸组成存在显著差异(P<0.05),TAA 含量为7.98~26.5 mg/g,两次发酵特色泡辣椒中呈味氨基酸普遍高于其他样品,其中鲜味氨基酸占TAA 总量的63.81%,进一步通过主成分分析得到谷氨酸、苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、组氨酸、精氨酸、甘氨酸、半胱氨酸、亮氨酸、酪氨酸对泡辣椒滋味影响程度大,并由各个主成分的综合得分得到遵义特色泡辣椒综合得分最高,综合评价分析可得两次发酵遵义特色泡辣椒相较于新鲜与传统自然一次发酵泡辣椒中游离氨基酸的综合品质更好。研究结果可为后续利用两次发酵技术,基于泡辣椒氨基酸含量开发辣椒制品以及为研究泡辣椒营养与特征风味研究等提供理论依据。

