物理协同酶法处理对青稞淀粉结构的影响
白 婷,李 琳,朱明霞,靳玉龙,王姗姗,张玉红,
(1.西藏自治区农牧科学院农产品开发与食品科学研究所,西藏拉萨 850000;2.西藏农牧学院,西藏林芝 860000)
食用淀粉可分为快速消化淀粉(Rapidly Digestible Starch,RSD,20 min 内消化)、慢消化淀粉(Slowly Digestible Starch,SDS,20~120min 内消化)和抗性淀粉(Resistant Starch,RS,≥120 min 仍未被消化)[1]。SDS 可缓释葡萄糖从而体内产生平缓的血糖应答[2];RS 和SDS 具有良好的抗消化特性和功能特性,RS 在人体内无法被消化,但在结肠中可以被微生物菌群发酵利用[3],在增加饱腹感的同时血糖应答水平较低,其相关制品具有较低的血糖生成指数,对糖尿病有一定的预防作用。
影响淀粉消化速率的因素很多,例如淀粉来源、直/支链淀粉含量比、淀粉颗粒形态、淀粉结构等[4]。多数淀粉中主要含RSD,能快速提高人体血糖水平,为改善这一缺陷并扩大淀粉的应用范围,可通过高压湿热、热挤压、超声、酶解、酸解等方法[5]对其进行改性从而获得较高含量的SDS 与RS。不同改性方法都有缺陷,传统高压湿热处理操作简单但制取率低、酶解法制取率高但制作成本高,所以考虑成本和制取率,联合多种处理方法是抗性淀粉制作的主要方向[6]。
青稞(Hordeum vulgareL.var.nudumHook.f.)作为我国青藏高原地区最主要的作物[7]。青稞中主要成分是淀粉,含量一般在45%~75%之间[8-10],青稞中直链淀粉和支链淀粉的比例在20:80~34:66 之间[11],因此研究和开展青稞淀粉深加工,有利于提升青稞附加值,利于青稞产业发展。青稞淀粉的研究集中在加工方式对青稞淀粉消化率的影响[12-14],对影响淀粉结构因素的研究多限于不同物理联合或酶联合多级物理法等处理方式对青稞淀粉分子结构和物理特性的影响[15-16]。本研究主要以青稞淀粉为原料,通过酶法联合物理处理对青稞淀粉进行处理,研究不同处理对青稞淀粉结构特性的影响,通过分析淀粉结构性质,明确不同改性处理方式对青稞淀粉结构的影响,从而为改性青稞淀粉制备及加工提供理论基础。
1 材料与方法
1.1 材料与仪器
青稞藏青2000 西藏圣科种业提供;普鲁兰酶(食品级1000 U/mL)北京索莱宝科技有限公司;总淀粉检测试剂盒、直/支链淀粉检测试剂盒、抗性淀粉检测试剂盒 爱尔兰Megazyme 公司;MOPS(钠盐)SigMa;所有试剂均为分析纯。
XZ-10DTD 超声波清洗机 宁波新芝生物科技股份有限公司;立式高压蒸汽灭菌锅 上海博迅医疗生物仪器股份有限公司;Nicolet 6700 傅立叶红外光谱仪 美国尼高力仪器公司;SU 8010 电子显微镜日立公司;Axio Scope A1 偏光显微镜 德国蔡司公司;Mastersizer 3000 激光粒度仪 英国马尔文公司;D8 ADVANCE X-射线衍射仪 布鲁克公司;SAXSpoint 2.0 小角X 射线散射仪 Anton Paar。
1.2 实验方法
1.2.1 青稞淀粉制备方法 水提法制备青稞淀粉。将青稞籽粒清洗干净,去除石子、燕麦等杂质,晒干备用。用去皮机粉碎去皮后加水浸泡1~2 h,磨浆机制浆过100 目筛,浆液4000 r/min 离心5 min,去除上清液,刮去沉淀上层灰黑色物质,进行3 次水洗,加水搅拌均匀,过筛、离心、去液、刮层,再用无水乙醇进行一次醇洗后40 ℃烘干,粉碎过筛备用,得青稞淀粉(Highland Barley Starch,HS)。
1.2.2 改性青稞淀粉的制备
1.2.2.1 普鲁兰酶法制备青稞改性淀粉 采用本实验室优化后的方法,即称取10.00 g 青稞淀粉,按料/水比为1:14 的量加入蒸馏水,制备成青稞淀粉悬浊液,混匀后调pH5.5,于100 ℃水浴中预糊化45 min,取出冷却至室温,加入22 U/mL 普鲁兰酶,在60 ℃温度条件下酶解16 h;100 ℃灭酶10 min,冷却至室温,4000 r/min 离心10 min,将沉淀在4 ℃条件下老化24 h,后40 ℃烘箱中烘干,粉碎并过100 目筛备用,即得P-HRS(Pullulanase-highland barley resistant starch)。
1.2.2.2 普鲁兰酶+超声制备青稞改性淀粉 称取10.00 g 按照1.2.2.1 方法制备的样品,按料/水比为1:11 的量加入蒸馏水,制备成悬浊液,充分混匀后置于100 ℃水浴中预糊化45 min,取出冷却至室温;设置超声功率为300 W,超声温度为70 ℃,超声时间为55 min,进行超声处理,超声结束后冷却,4000 r/min 离心10 min,将沉淀在4 ℃条件下老化24 h,最后40 ℃烘箱中烘干,粉碎并过100 目筛,即得PU-HRS(Pullulanase+Ultrasonic-highland barley resistant starch)。
1.2.2.3 普鲁兰酶+压热法制备青稞改性淀粉 称取10.00 g 按照1.2.2.1 方法制的的样品,按料/水比为1:17 的量加入蒸馏水,制备成悬浊液,充分混匀后,调节pH 为6,置于高压蒸汽灭菌锅中,设置压热温度为110 ℃,时间为90 min,进行压热处理,压热结束后,取出冷却,4000 r/min 离心10 min,将沉淀在4 ℃条件下老化24 h,最后40 ℃烘箱中烘干,粉碎并过100 目筛备用,即得PP-HRS(Pullulanase+Autoclave-highland barley resistant starch)。
1.2.2.4 普鲁兰酶+超声与压热制备青稞改性淀粉
按上述方法依次对青稞淀粉进行普鲁兰酶酶解、超声、压热处理,得到的样品40 ℃烘箱中烘干,粉碎并过100 目筛备用,即得PUP-HRS(Pullulanase+Ultrasonic+Autoclave-highland barley resistant starch)。
1.2.3 总淀粉及其组分含量测定 总淀粉含量:采用Megazyme 总淀粉试剂盒法测定;直/支链淀粉含量:采用Megazyme 直/支链淀粉试剂盒法测定;RS 含量采用Megazyme 抗性淀粉试剂盒法测定。
1.2.4 样品的表观结构测定
1.2.4.1 扫描电镜(SEM)使用扫描电镜分析样品的颗粒形貌。将样品用导电双面胶固定在金属样品台上,喷金镀膜,然后用扫描电镜在1000×和2000×下进行扫描观察。
1.2.4.2 偏光显微镜 用甘油和水按1:1 混合后加入样品配成5%的淀粉乳,吸取一滴于载玻片上,盖上盖玻片,置于载物台上,用偏光显微镜进行观察和拍摄样品的偏光十字。
1.2.4.3 激光粒度分析仪 使用马尔文激光粒度分析仪测定淀粉的粒径(μm)分布。准确称取0.30 g 样品,加入50 mL 蒸馏水摇匀,超声3 min,使颗粒充分分散。设定仪器参数为:蒸馏水的折射率为1.33,样品的折射率为1.52,散射模型为Mie,颗粒吸收率为0.100,分析模型为通用模式(模拟MS2000/MS2000E)。
1.2.4.4 X-射线衍射扫描 采用粉末衍射法对青稞淀粉及抗性淀粉进行X-射线衍射扫描分析。测试条件:Cu-ka 靶,测量角度2θ=5°~60°,步宽0.02°,扫描速度2°/min。利用JADE 9.0 对数据进行分析,计算样品相对结晶度,判读晶型。
1.2.4.5 傅里叶红外光谱 采用溴化钾压片法对淀粉进行傅里叶红外扫描分析。称取一定量的样品和干燥的溴化钾粉末放入玛瑙研钵中进行研磨,充分混合均匀后压片,置于傅里叶红外光谱仪中选用溴化钾片作空白参比,进行全波段扫描(400~4000 cm-1)得到样品的红外光谱图。利用OMNIC 8.2 对数据进行去卷积处理,计算有序度(DO)值和双螺旋度(DD)值。
1.3 数据处理
本文中所有数据统计均采用SPSS 26.0、OMNIC 8.2 和JADE 9.0 软件分析,曲线图采用Origin 2021和OMNIC 8.2 软件绘制。
2 结果与分析
2.1 青稞淀粉与改性青稞淀粉的组分含量
由表1 可知,水提法制备的青稞淀粉中总淀粉含量为94.48%,其中抗性淀粉含量为3.19%,经过四种改性处理能够显著(P<0.05)提高青稞抗性淀粉的含量,改性处理后青稞抗性淀粉含量达14.38%~15.53%,其中PUP 改性处理抗性淀粉含量最高。与普鲁兰酶改性处理相比,PU、PP 处理后青稞抗性淀粉含量与酶处理后差异不显著(P>0.05),而直/支链淀粉差异明显。青稞淀粉经过物理协同酶处理后,与原淀粉相比,四种种改性处理能显著降低支链淀粉的含量(P<0.05);直链淀粉比例升高,其中直链淀粉含量P-HRS>PUP-HRS>PP-HRS>PU-HRS>HS,P-HRS的直链淀粉含量最高为86.81%。高含量直链淀粉有助于降低淀粉消化速率,直链淀粉的中、短链相互作用有助于在回生淀粉中形成较小的凝胶网络晶胞,从而减缓淀粉的消化[4]。
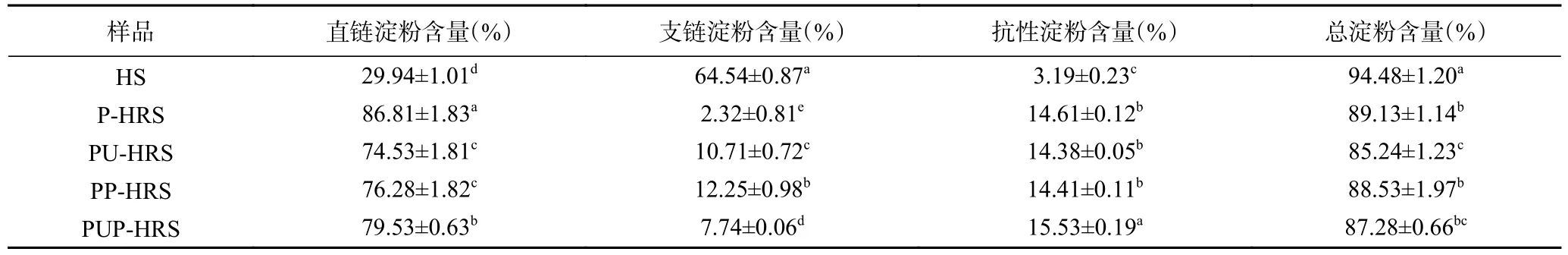
表1 青稞淀粉与改性青稞淀粉的组分含量Table 1 Composition content of highland barley starch and modified highland barley starch
2.2 青稞淀粉与改性青稞淀粉颗粒形态分析
由图1 可知,青稞原淀粉颗粒饱满完整,呈圆饼形、扁球状[17-20],分为大小两种,整体均匀、规则,表面光滑、有轻微凹陷,边缘整齐圆润,无褶皱、裂纹和孔洞。经改性处理后的青稞淀粉颗粒都遭到了严重破坏,原始形状消失,粘连成团,呈现出团状结构,表面粗糙、凹凸不平,布满褶皱、裂纹和孔洞。四种青稞抗性淀粉(HRS)都经过了普鲁兰酶酶解处理,淀粉脱支,部分短链小分子溶出,所以表面都有微孔结构[21]。
青稞原淀粉有清晰的偏光十字,主要呈“正十字”形态,也有“斜十字”和“X”型,偏光十字的交叉点位于淀粉颗粒脐点位置,具有典型的双折射现象,说明青稞原淀粉具有高度有序的晶体结构。经过不同的改性处理后的样品,偏光十字和双折射现象都明显消失。青稞原淀粉是从脐点开始生长,普鲁兰酶或者超声、压热会破坏淀粉颗粒的脐点,淀粉分子会降解成短链小分子,双螺旋结构和结晶层受到破坏,回生又使小分子重新组合排列形成新的结晶,使处理后的青稞淀粉颗粒的聚集程度提高。
2.3 青稞淀粉与改性青稞淀粉粒度分布
淀粉颗粒直径范围为10~30 μm 的为A 大淀粉颗粒(透镜型),直径范围<10 μm 的为B 小淀粉颗粒(球型),相同处理条件下,可以观察到青稞原淀粉呈现双峰的粒度分布(图2),说明青稞淀粉存在大小两种颗粒分布,以A 大淀粉颗粒为主,B 小淀粉颗粒较少,这和张玉玉[22]的研究结果相一致。
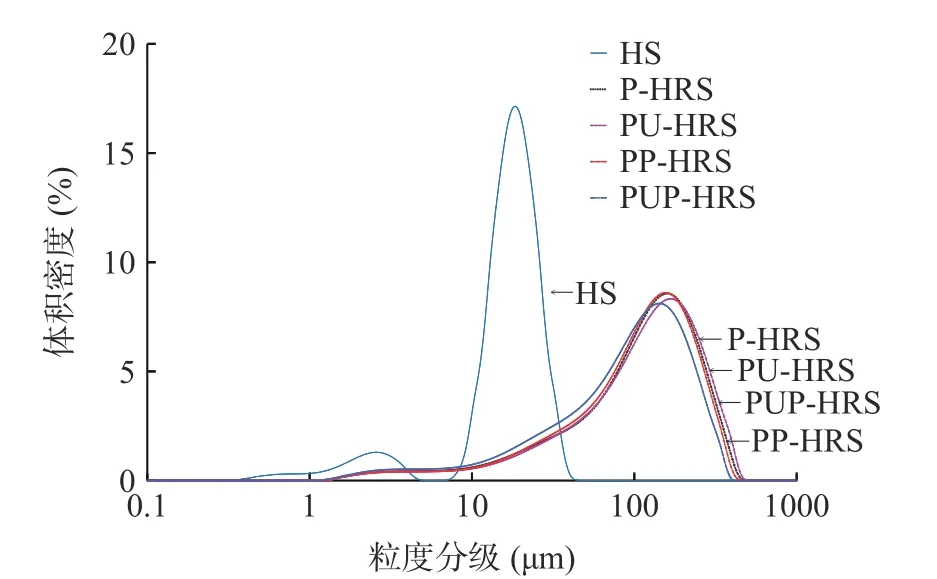
图2 青稞淀粉与改性青稞淀粉的分布曲线Fig.2 Grain size distribution curves of highland barley starch and modified highland barley starch
青稞原淀粉和4 种青稞改性淀粉的粒径分布差异较大(见图2、表2),经过改性处理使得4 种青稞抗性淀粉的比表面积平均粒径(D[3,2])显著提高(P<0.05),最大的是PU-HRS,为39.70%,最小的是PUP-HRS(31.83%),可能是因为经过超声处理使淀粉颗粒内部发生空洞化,体积变大。与青稞原淀粉相比,只经过普鲁兰酶处理的形成的青稞抗性淀粉(PHRS)的体积平均粒径(D[4,3])差异不显著(P>0.05),而PU-HRS、PP-HRS、PUP-HRS 的体积平均粒径(D[4,3])显著变小(P<0.05)。Dv(10)、Dv(50)、Dv(90)值的不断增大,代表样品中大颗粒数目增加,这可能是因为改性处理使青稞淀粉颗粒中的淀粉分子分解成更小的链条,经过老化处理,小分子又重新结晶,形成的青稞抗性淀粉具有更加致密的大淀粉晶体[23-24];其次,淀粉颗粒表面被破坏,表明活性增加,发生团聚行为,从而导致粒径尺寸增大[25]。
2.4 青稞淀粉与改性青稞淀粉的结晶结构
青稞淀粉颗粒是由微晶、亚微晶和非晶三种不同结构经过无规律耦合从而形成多晶体系,可分为结晶区和非晶区(即无定形区)。在结晶区中,多晶体系具有晶形完整、晶粒线度大、长程有序以及在衍射曲线上尖峰衍射特征明显的特点;在非晶区,多晶体系具有短程有序、长程无序以及在衍射曲线上弥散衍射特征明显的特征[26]。
由图3 可知,青稞淀粉的X-射线衍射谱图的衍射峰主要分布在为15.15°、16.95°、18.04°、23.05°,为典型的A 型晶体结构,这和曹承嘉等[24]对青稞淀粉的晶型结构判断相同。与青稞原淀粉相比,不同改性处理使青稞淀粉晶体峰的峰型和位置发生了明显的改变。P-HRS 在17.02°、22.11°、23.82°处有强衍射峰,为典型的B 型晶体类型[27],这可能是因为普鲁兰酶作用使青稞支链淀粉被酶解成更短的小分子,这些分支在4 ℃老化回生过程中重新结晶,增加了青稞原淀粉多晶体系中的直链淀粉分子含量,使不稳定的A 型晶体结构逐渐向结构更为稳定的B 型转变,相对结晶度增加。经过超声波处理的PU-HRS 的衍射角2θ为15.37°、17.09°、19.68°、22.25°、23.99°,相对结晶度为35.68%,表明在普鲁兰酶-超声波的作用下A 型晶体开始向B 型晶体转变。PP-HRS 在经过普鲁兰酶酶解及压热处理后,普鲁兰酶专一性地切断α-1,6 糖苷键,打破原有的晶体结构,提高了支、直链淀粉分子的比例,促进淀粉小分子重新结晶形成双螺旋结构,其衍射角2θ为15.30°、17.00°、19.61°、22.22°、23.85°相对结晶度为38.56%。普鲁兰酶+超声+压热处理的PUP-HRS 的衍射峰角2θ为5.73°、12.87°、15.18°、17.02°、19.47°、22.11°、23.88°,相对结晶度为38.87%,主要是转变为B 型晶体。
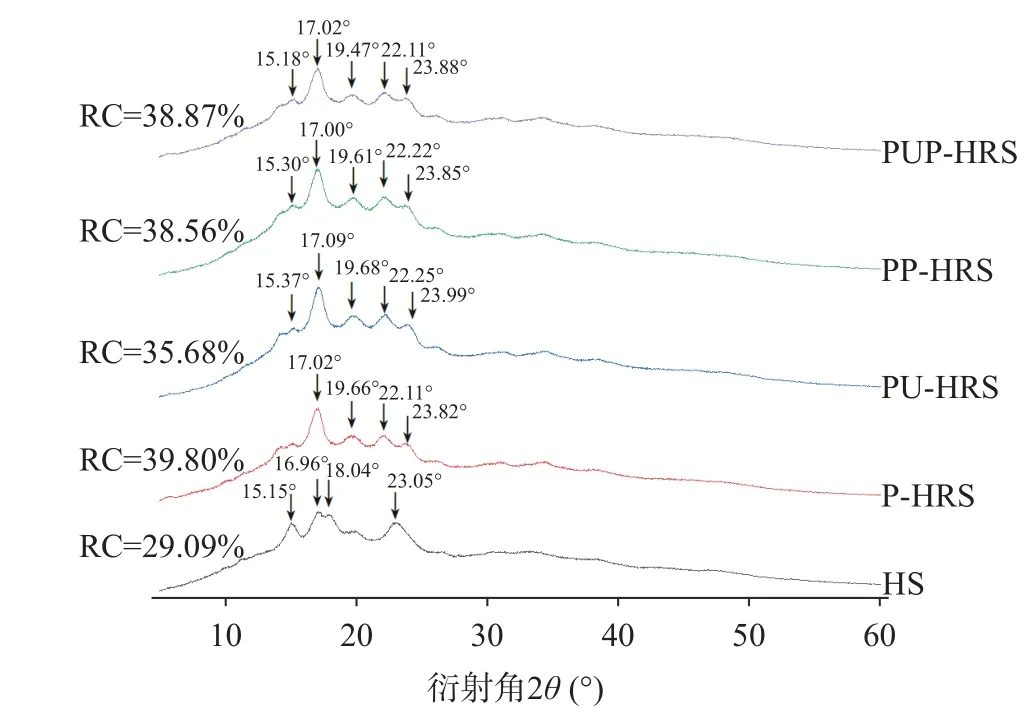
图3 青稞淀粉与改性青稞淀粉的XRD 曲线Fig.3 XRD patterns of highland barley starch and modified highland barley starch
2.5 青稞淀粉与改性青稞抗性淀粉的红外光谱分析
通过傅里叶红外光谱仪可对淀粉颗粒的短程有序结构进行相关分析研究,特别是链构象和双螺旋结构之间的差异化问题[28]。从图4、图5 和表3 可以看出不同处理青稞淀粉的红外分子结构情况,明确不同改性处理方式对青稞淀粉分子结构的影响。从图4中可以看出,5 种青稞淀粉样品的红外光谱图走势大致相同,表明其链构象和双螺旋结构的差异不大。
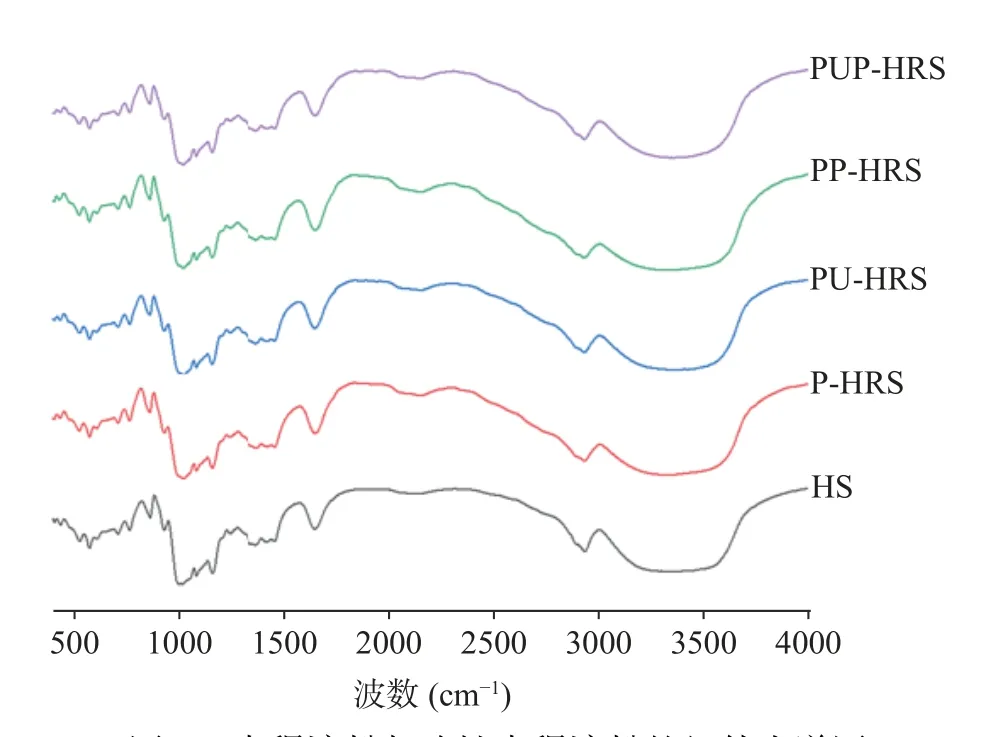
图4 青稞淀粉与改性青稞淀粉的红外光谱图Fig.4 Infrared spectra of highland barley starch and modified highland barley starch
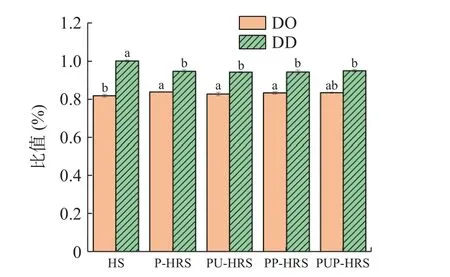
图5 青稞淀粉与改性青稞淀粉的DO 与DD 值Fig.5 DO and DD values of highland barley starch and modified highland barley starch

表3 青稞淀粉与改性青稞淀粉官能团的特征吸收峰Table 3 Characteristic absorption peaks of functional groups of highland barley starch and modified highland barley starch
由表3 分析可知,HS、P-HRS、PU-HRS、PPHRS、PUP-HRS 均在3370、2930、1652、930、765 cm-1附近出现特征吸收峰,分别对应O-H 伸缩振动峰、亚甲基-CH2的伸缩振动峰、淀粉中吸附水中无定型区域的吸收峰,以及指纹区的C 吡喃糖分子C=O 振动峰、葡萄糖吡喃糖环骨架模式振动区域。说明改性没有使青稞原淀粉的化学结构发生变化,没有产生新的化学基团和化学键,只是改变了青稞淀粉内部结构的重新排列。
995、1022、1047 cm-1是表征淀粉构象的特性谱带,1022 cm-1是无定型区的特征谱带,995 和1047 cm-1则分别表示双螺旋和有序结构的振动吸收,可用DO(A1047/A1022)和DD(A995/A1022)表示有序结构和双螺旋结构程度,DO 值增大,表明分子有序性增高[33]。由图5 可知,与原淀粉相比,处理后的青稞淀粉DO 值增大,表明改性处理使青稞淀粉的分子有序性提高;青稞淀粉样品的DD 值均大于DO 值,双螺旋度高于双螺旋有序度,说明并非所有的双螺旋必然是晶体的一部分,这和殷秀秀[34]以及Zhang 等[35]的结论相一致。
3 结论
通过对青稞淀粉及改性青稞淀粉的淀粉组分研究表明,物理协同酶改性处理能够显著提高青稞直链淀粉的含量,降低支链淀粉含量。青稞淀粉中抗性淀粉含量为3.19%,改性青稞淀粉中抗性淀粉含量达14.38%~15.53%。通过对青稞淀粉与改性青稞淀粉结构研究发现,物理协同酶改性能够破坏青稞淀粉原有淀粉结构,使原始形态消失,粘连成团,呈现类似土块、碎石形状;改性青稞淀粉偏光十字消失,物理协同酶改性处理使淀粉双螺旋结构和结晶结构受到破坏,从而导致偏光消失。改性处理增加了青稞抗性淀粉(HRS)的结晶度,A 型晶体向B 型转变。物理协同酶改性处理只是促使青稞淀粉的分子有序性提高,没有使青稞原淀粉的化学结构发生变化。
物理协同酶改性处理能够使青稞淀粉组分及分子结晶特性发生明显变化,这能显著改变青稞淀粉的加工特性;而本研究只进行了物理协同酶改性对青稞淀粉结构的影响,今后将对改性青稞淀粉加工特性进行研究,为青稞淀粉的类产品加工性质提供数据支撑。此外发现,青稞中抗性淀粉含量的提高可能是由普鲁兰酶酶解起主要作用,物理处理的贡献比较小,这为青稞抗性淀粉的制备提供一定的参考依据。

