超声-酶辅助低共熔溶剂提取桑叶总黄酮的工艺优化及其抗氧化活性研究
吴 均,吴俊葶,杨碧文,王 梅,赵 珮,马婧秋,黄 越,,黄传书,
(1.重庆市蚕业科学技术研究院,重庆 400700;2.中国人民解放军陆军勤务学院,重庆 401331)
桑叶(Mulberry Leaf)又名神仙叶、铁扇子,为桑属桑科类桑的叶子,富含黄酮、多糖、总酚、生物碱、维生素、有机酸、植物甾醇、挥发油、微量元素以及氨基酸等成分[1-2],于2002 年列入药食同源目录[3]。《神农本草经》记载,桑叶具有润肺止渴,疏风散热、清肝明目等药效[4]。桑叶作为天然药食两用的植物资源,少量用于养蚕饲料,大量的桑叶被焚烧处理,造成资源浪费。随着现代科技的发展,研究表明,桑叶具有降血糖、抗菌、抗病毒、抗氧化、保护心血管、抗癌、抗肿瘤、抗辐射、免疫调节、减肥减脂、恢复紊乱的肠道菌群等作用[5-11]。黄酮是桑叶的主要成分之一,具有显著的抗氧化和降血糖作用[12-13],因此桑叶总黄酮具有较高的利用价值且极具开发应用前景。
目前,提取黄酮主要方法有水提法、醇提法,酶提法、微波辅助溶剂提取法以及超声波辅助溶剂提取法等,这些方法虽然操作简单,但均存在耗时长、提取量少、能耗高等缺点[14]。低共熔溶剂(Deep Eutectic Solvents,DES),由氢键受体与氢键供体按一定摩尔比组成,具有制备简单、溶解性好、热稳定性高、提取效率高、价格低廉且无毒等优点[15]。已有一些关于DES 提取黄酮类[16]的报道。与传统溶剂相比,DES 可显著提高黄酮提取率,且可改善现有技术存在的耗时长、操作繁琐或长时间热效应导致有效成分分解氧化等弊端。雷永伟等[17]采用6 种DES提取荞麦壳黄酮,发现氯化胆碱-尿素的提取率最高,达到了 4.79%,优于传统的乙醇法,证实DES 可有效地提升荞麦壳黄酮的提取率;罗朝丹等[18]采用超声辅助DES 法提取番石榴叶总黄酮,发现ChCl+EG组成的DES 为提取溶剂,总黄酮提取率高达14.95%;谢茜等[19]以龙眼参为对象,采用超声波辅助低共熔溶剂法提取的龙眼参黄酮,提取率为(37.98±0.13)mg/g,且龙眼参黄酮显著延长小鼠的力竭时间,提升抗运动疲劳能力。目前关于DES 提取桑叶总黄酮的研究还未见报道。
本研究首次将超声、酶和低共熔溶剂三者联合起来用于提取桑叶总黄酮,以期缩短提取时间、最大限度提高提取量并降低能量的消耗。通过对比不同种类的DES、传统溶剂和传统方法提取桑叶总黄酮,筛选最佳DES,通过单因素和响应面法优化超声-酶辅助低共熔溶剂提取桑叶总黄酮的工艺,进一步研究其体外抗氧化活性,旨在获得一种绿色高效桑叶总黄酮的提取方法,为桑叶的综合利用与开发提供参考。
1 材料与方法
1.1 材料与仪器
桑叶 重庆市蚕业科学技术研究院;无水乙醇、葡萄糖、乙二醇、尿素 分析纯,成都市科隆化学品有限公司;氯化胆碱、果糖、苹果酸、柠檬酸、葡萄糖、纤维素酶(10 万U/g)、甘油、1-4-丁二醇、草酸、乳酸、抗坏血酸、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-Hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸 [2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)分析纯,上海麦克林生化科技有限公司;芦丁 对照品,北京索莱宝科技有限公司。
SOP 电子天平 赛多利斯科学仪器有限公司;TGL-16M 高速冷冻离心机 上海卢湘仪离心机仪器有限公司;UV-1800 型紫外-可见分光光度计 翱艺仪器有限公司;XY-500A 型高速多功能粉碎机浙江省永康市松青五金厂;HCJ-4D 磁力搅拌水浴锅常州朗越仪器制造有限公司;HGZF-11 电热恒温鼓风干燥箱 上海跃进医疗器械有限公司;SB25-12DTD 超声波清洗机 宁波新芝生物科技股份有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制 以芦丁为标准对照品,通过测量其在510 nm 的吸光度,建立芦丁标准曲线,测定桑叶总黄酮的含量。准确称取芦丁标准品20.0 mg,用50%的热乙醇溶解,定容至100 mL,摇匀,制备成0.2 mg/mL 标准溶液备用。精密量取0、1.0、2.0、3.0、4.0、5.0、6.0 mL 上述芦丁标准液,置于25 mL的容量瓶中,加入50%乙醇5 mL,加入5%亚硝酸钠溶液0.7 mL,摇匀,放置5 min 后加入10%硝酸铝溶液0.7 mL,摇匀,放置6 min 后加入1 mol/L 的氢氧化钠溶液10 mL,用50%乙醇定容至刻度,摇匀,放置10 min 后于波长510 nm 处测定吸光度,试剂空白为参比液。以芦丁质量浓度(X)为横坐标,测得的吸光度(A)为纵坐标绘制标准曲线。得到标准曲线为:A=10.286X-0.0023,R2=0.9993,线性范围为0~0.048 mg/mL。
1.2.2 桑叶总黄酮提取量的测定 精密称取1.0 g 桑叶粉末于250 mL 三角瓶中,按一定的液料比加入一定含水量的低共熔溶剂,置于一定功率和一定温度的超声波中,超声一定时间,超声结束后放冷,移至50 mL 离心管内,于10000 r/min 下离心10 min,取上清液过0.45 μm 的微孔滤膜,置于4 ℃冰箱保存备用。
精密量取桑叶总黄酮提取溶液1 mL 于25 mL容量瓶中,按照上述测定方法测定吸光度,根据所得芦丁标准曲线计算桑叶总黄酮浓度。按照公式计算总黄酮提取量:
式中:W 为桑叶总黄酮提取量,mg/g;C 为黄酮质量浓度,mg/mL;V 为提取液体积,mL;N 为稀释倍数;M 为桑叶质量,g。
1.2.3 不同提取方法 水提取法:精确称取1.0 g 桑叶粉于100 mL 锥形瓶中,加入40 mL 纯水,室温浸渍2 h。提取后在10000 r/min,离心10 min,取上清液,测定桑叶总黄酮提取量。
醇提取法:精确称取1.0 g 桑叶粉于100 mL 锥形瓶中,加入40 mL 50%乙醇溶液,室温浸渍2 h。提取后在10000 r/min,离心10 min,取上清液,测定桑叶总黄酮提取量。
超声-水提取法:精确称取1.0 g 桑叶粉于100 mL锥形瓶中,加入40 mL 纯水溶液,在超声清洗器中以超声功率300 W,提取温度40 ℃,提取2 h。提取后在10000 r/min,离心10 min,取上清液,测定桑叶总黄酮提取量。
超声-醇提取法:精确称取1.0 g 桑叶粉于100 mL锥形瓶中,加入40 mL 50%乙醇溶液,在超声清洗器中以超声功率300 W,提取温度40 ℃,提取2 h。提取后在10000 r/min,离心20 min,取上清液,测定桑叶总黄酮提取量。
超声-酶辅助低共熔溶剂提取法:精确称取1.0 g 桑叶粉于100 mL 锥形瓶中,加入40 mL 低共熔溶剂,3%纤维素酶,在超声清洗器中以超声功率300 W,提取温度40 ℃,提取1 h。提取后在10000 r/min,离心20 min,取上清液过0.45 μm 的微孔滤膜,测定总黄酮的提取量。
1.2.4 低共熔溶剂(DES)的制备及筛选 选择氯化胆碱(Hydrogen Bond Acceptor,HBA)作为氢键受体,分别与不同的氢键供体(Hydrogen Bond Donors,HBD)按摩尔比1:1 或者1:1:1,设计了17 组DES(见表1),在 80 ℃水浴条件下加热搅拌至溶液澄清,冷却至室温,备用。
精密称取1.0 g 桑叶粉末于250 mL 三角瓶中,按液料比40 mL/g 加入30%含水量的低共熔溶剂,置于超声功率300 W,超声温度40 ℃,超声40 min,超声结束后放冷,移至50 mL 离心管内,于10000 r/min 下离心10 min,取上清液过0.45 μm 的微孔滤膜,测定桑叶总黄酮的提取量,筛选出最佳低共熔溶剂。
1.2.5 单因素实验 以最佳DES 溶剂为提取剂,初始固定参数为:摩尔比1:1:2,含水量30%,液料比40 mL/g,超声功率300 W,超声温度40 ℃,超声时间40 min,酶添加量3%。考察不同摩尔比(1:1:1、1:1:2、1:1:3、1:1:4、1:1:5、1:2:1、1:3:1、1:4:1、2:1:1、3:1:1、4:1:1);不同含水量(20%、25%、30%、35%、40%);液料比(20、30、40、50、60 mL/g);超声功率(240、300、360、420、480 W);超声时间(20、30、40、50、60 min);超声温度(30、35、40、45、50 ℃);酶添加量(1%、2%、3%、4%、5%)对桑叶总黄酮提取量的影响。
1.2.6 响应面试验 根据单因素实验结果,选择对桑叶总黄酮提取量影响显著的含水量(A)、酶添加量(B)和超声时间(C)为自变量,以总黄酮提取量(Y)作为响应值,采用 Box-Behnken 响应面设计试验,进一步优化桑叶总黄酮的提取工艺条件。因素水平设计见表2。
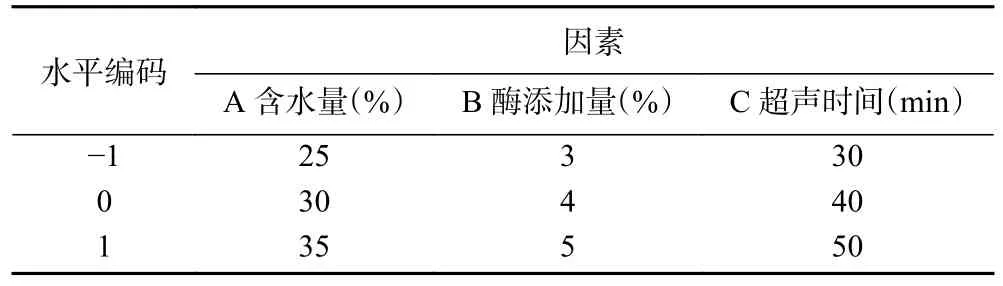
表2 Box-Behnken 设计试验因素水平及编码Table 2 Level and code of variables for Box-Benhnken design
1.2.7 抗氧化活性的测定 用无水乙醇将在最优条件下提取得到的桑叶总黄酮提取液配制成1.0 mg/mL的桑叶总黄酮溶液,备用。
1.2.7.1 DPPH 自由基清除率 取2 mL 0.2 mmol/L的DPPH 无水乙醇溶液分别加2 mL 浓度为0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08 mg/mL 的样品溶液,混匀,避光静置30 min,在517 nm 波长处测定吸光度,以相同浓度的Trolox 和VC作阳性对照[20]。
式中:A0为4 mL DPPH 溶液+4 mL 纯水;Ai为4 mL DPPH 溶液+4 mL 样品溶液;Aj为4 mL样品溶液+4 mL 纯水。
1.2.7.2 ABTS+自由基清除率 取6 mL ABTS 工作液分别加0.2 mL 浓度为0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mg/mL 的样品溶液,混匀后避光放置30 min,以无水乙醇为空白,于734 nm 处测定吸光度,以相同浓度的Trolox 和VC作阳性对照[21]。
式中:A0为6 mL ABTS+·溶液+0.2 mL 无水乙醇;Ai为6 mL ABTS+·溶液+0.2 mL 样品溶液;Aj为0.2 mL 样品溶液+6 mL 无水乙醇。
1.3 数据处理
采用Origin 9.0 和DesignExpert 8.0.6.1 进行作图和响应面分析,每个实验重复三次,计算平均值。
2 结果与分析
2.1 不同提取方法比较分析
采用水提取法、醇提取法、超声-水提取法、超声-醇提取法和超声-酶辅助低共熔溶剂提取法提取桑叶总黄酮。
由图1 可知,超声-酶辅助低共熔溶剂提取法与其他的4 种方法相比,不仅能够节约时间,也能提高总黄酮的提取量,因为DESs 中含有大量羟基和氨基,容易与黄酮形成氢键,可以增加黄酮在DESs 中的溶解度,同时在超声-酶的辅助作用下,快速溢出,使总黄酮提取量增加,因此选择超声-酶辅助低共熔溶剂法提取桑叶中的总黄酮是快速、高效、环保的方法。
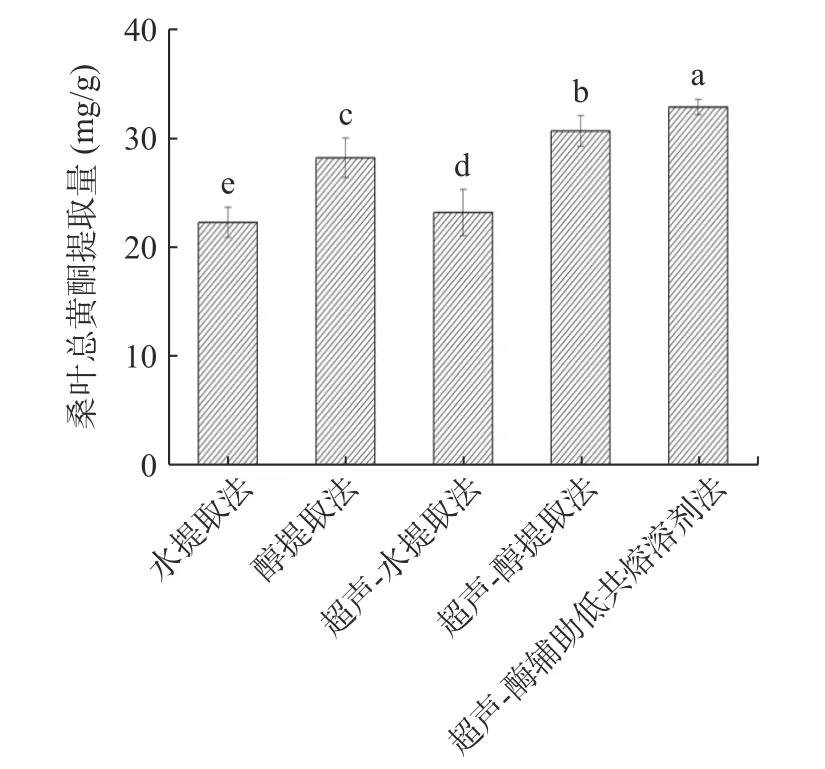
图1 不同方法对桑叶总黄酮提取量的影响Fig.1 Influence of different methods on the extraction amount of total flavonoids from mulberry leaves
2.2 低共熔溶剂(DES)的筛选
由图2 可知,不同低共熔溶剂对桑叶总黄酮的提取量有一定的影响,DES-13(氯化胆碱/果糖/乙醇)提取的桑叶总黄酮量最高,原因可能是由于该组合的扩散力与桑叶总黄酮提取液的极性比较接近,有利于黄酮的溶解和扩散。因此,选择氯化胆碱/果糖/乙醇作为提取桑叶中总黄酮的提取溶剂。
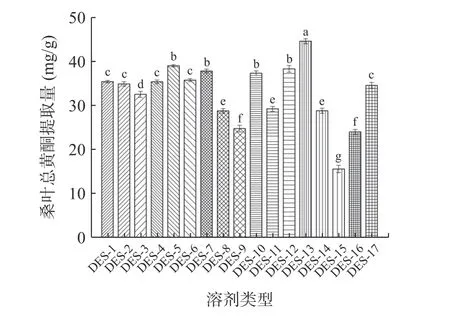
图2 溶剂类型对桑叶总黄酮提取量的影响Fig.2 Effect of solvent tpyes on the extraction amount of total flavonoids from mulberry leaves
2.3 单因素实验
2.3.1 DES 摩尔比对桑叶总黄酮提取量的影响 由图3 可知,当氯化胆碱/果糖/乙醇摩尔比为1:1:3 时的总黄酮提取量为最大值。总黄酮提取量随着乙醇占比的增加而先增加后降低;总黄酮提取量随着氯化胆碱或果糖占比的增加而降低;这可能与所形成的低共熔体系的黏度和表面张力有关,乙醇占比越大,体系的黏度越小,表面张力下降,桑叶总黄酮溶解与扩散的阻力减小,利于总黄酮的溶出,而随着乙醇占比进一步增大,体系极性减小,增大了溶剂与溶质的极性差,使得总黄酮的溶解度下降;氯化胆碱或果糖占比不断增加,体系的黏度增加,表面张力增强,桑叶总黄酮溶解与扩散的阻力增大,不利于总黄酮的溶出[22]。因此,选择低共熔体系为氯化胆碱/果糖/乙醇摩尔比为1:1:3。
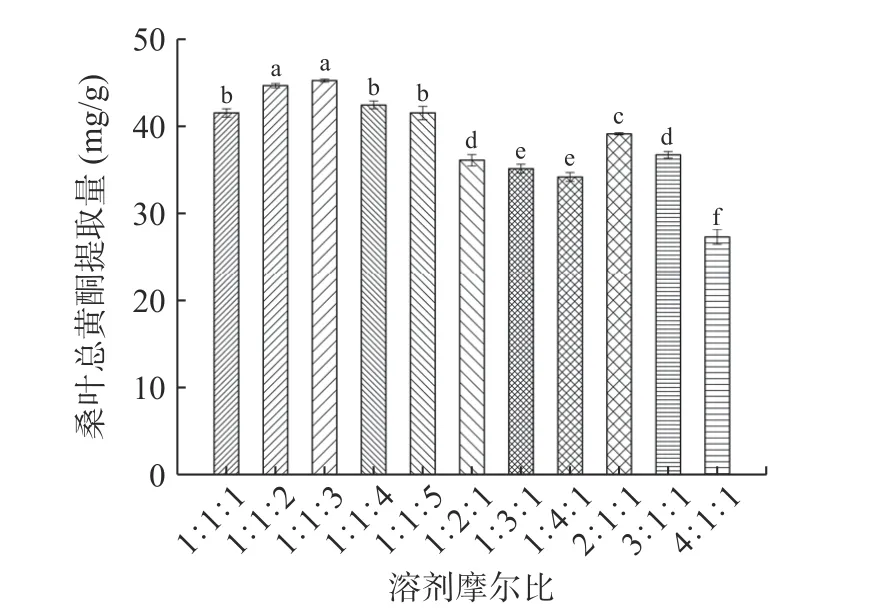
图3 溶剂摩尔比对桑叶总黄酮提取量的影响Fig.3 Effect of solvent molar ratio on the extraction amount of total flavonoids from mulberry leaves
2.3.2 DES 含水量对桑叶总黄酮提取量的影响 由图4 可知,当含水量为30%时,桑叶总黄酮提取量最大。当含水量从20%增加到30% 时,提取量随着含水量的增大而增大,低共熔体系的黏度不断减小,低共熔体系的极性不断增大,增大接触表面积,提高传质速率,促进桑叶总黄酮的溶出,从而提高了桑叶总黄酮的提取量;但当含水量大于30%时,桑叶总黄酮提取量逐渐下降,这可能是含水量过多使得体系黏度降低,极性过大,引起分子之间的氢键断裂,进而破坏体系的超分子结构,溶剂和总黄酮的相互作用减弱而导致桑叶总黄酮提取量的降低[20]。因此,选择低共熔溶剂的含水量为25%、30%、35%进行响应面试验。
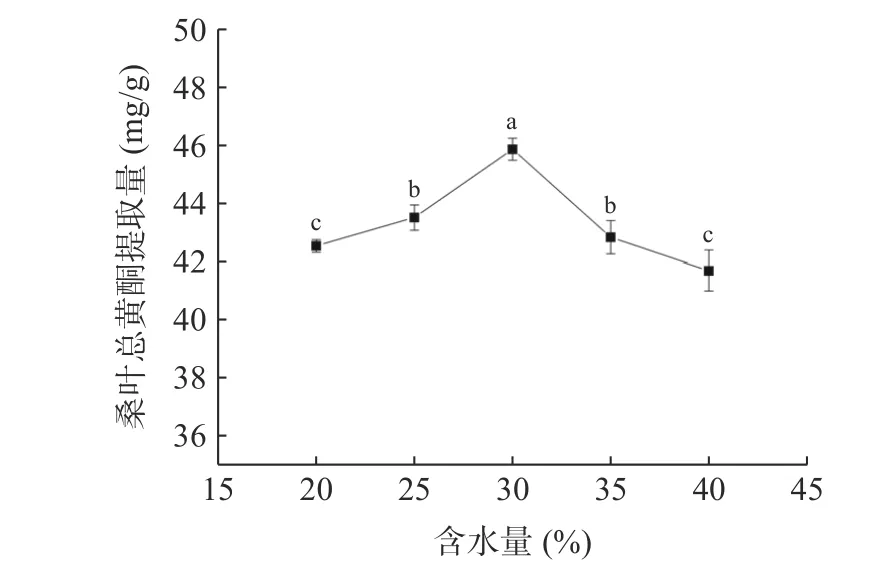
图4 含水量对桑叶总黄酮提取量的影响Fig.4 Effect of moisture content on the extraction amount of total flavonoids from mulberry leaves
2.3.3 DES 液料比对桑叶总黄酮提取量的影响 由图5 可知,当液料比为40:1 mL/g 时,桑叶总黄酮提取量最大。当液料比从20:1 mL/g 增加到40:1 mL/g时,提取量随着液料比的增大而增大,可能是因为液料比的增加使桑叶粉与体系的接触面积增加,充分浸提,促使桑叶粉中的总黄酮不断溢出[23];液料比大于40:1 mL/g 时,桑叶总黄酮提取量随液料比的增加呈现平稳趋势,可能是因为桑叶粉溶解达到饱和[24]。因此,选择低共熔溶剂的液料比为40:1 mL/g。
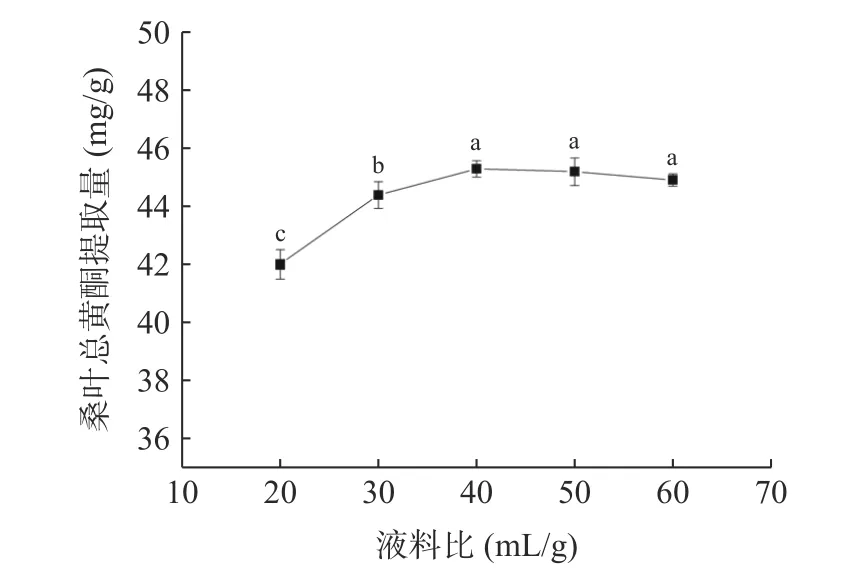
图5 液料比对桑叶总黄酮提取量的影响Fig.5 Effect of liquid to material ratio on the extraction amount of total flavonoids from mulberry leaves
2.3.4 超声功率对桑叶总黄酮提取量的影响 由图6可知,当超声功率为360 W 时,桑叶总黄酮提取量最大。当超声功率从240 W 增加到360 W 时,提取量随着超声功率的增大而增大,可能是因为空化效应不断增大导致,超声功率不断增大,体系中分子运动速度加快,对桑叶细胞壁的破碎作用增强,总黄酮物质溢出增多[25];而超声功率大于360 W 时,桑叶总黄酮提取量有所下降,可能是因为过高的超声功率引起的空化作用加强,产生了过多的杂质且破坏了总黄酮的成分,导致桑叶总黄酮提取量降低[26]。因此,选择超声功率为360 W。
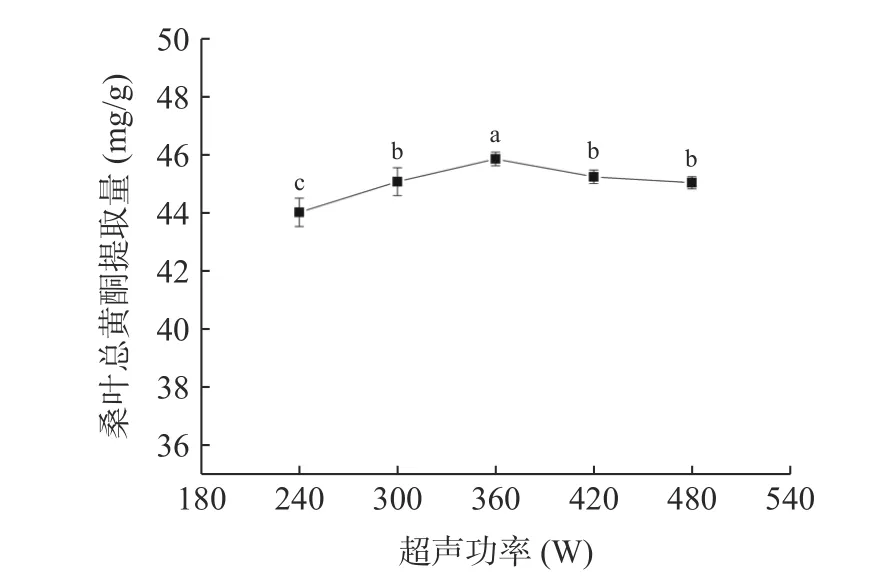
图6 超声功率对桑叶总黄酮提取量的影响Fig.6 Effect of ultrasound power on the extraction amount of total flavonoids from mulberry leaves
2.3.5 超声时间对桑叶总黄酮提取量的影响 由图7可知,当超声时间为40 min 时,桑叶总黄酮提取量最大。当超声时间从20 min 增加到40 min 时,提取量随着超声时间的增加而增大,可能是因为时间延长,超声波能量在溶剂体系中形成的空化效应使得桑叶细胞壁不断破损[27],桑叶总黄酮不断溶出,提取量就越高;而超声时间大于40 min 时,桑叶总黄酮提取量有所下降,可能是因为过长的超声时间导致溶剂体系中乙醇挥发、大量杂质溶出而使桑叶总黄酮溶出受限和部分黄酮降解[28]。因此,选择超声时间为30、40、50 min 进行响应面试验。
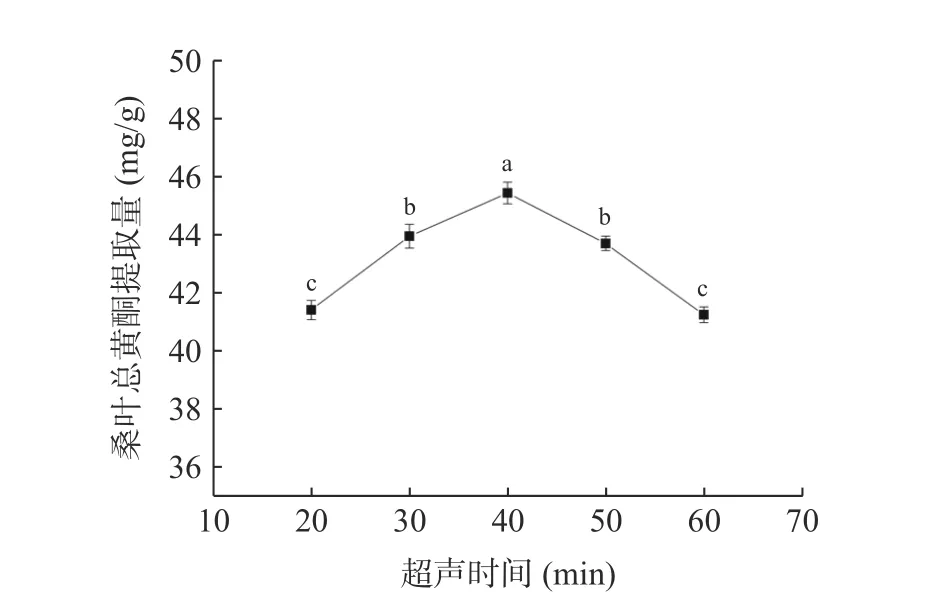
图7 超声时间对桑叶总黄酮提取量的影响Fig.7 Effect of ultrasound time on the extraction amount of total flavonoids from mulberry leaves
2.3.6 超声温度对桑叶总黄酮提取量的影响 由图8可知,当超声温度为40 ℃时,桑叶总黄酮提取量最大。当超声温度从30 ℃增加到40 ℃时,提取量随着超声温度的增加而增大,可能是因为随着温度的升高,体系溶剂的黏度和表面张力降低[29],黄酮与样品基质之间的相互作用减少[30],使得桑叶总黄酮不断溶出;而超声温度大于40 ℃时,桑叶总黄酮提取量有所下降,可能是因为高温使黄酮发生了降解,体系溶剂中乙醇挥发,体系溶剂的极性和氢键稳定性下降[31]。因此,选择超声温度为40 ℃。
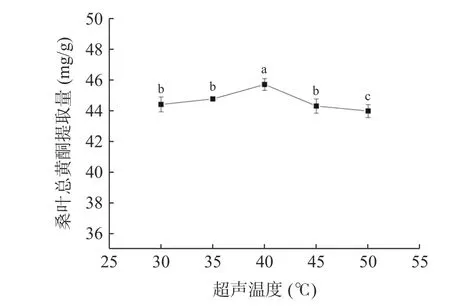
图8 超声温度对桑叶总黄酮提取量的影响Fig.8 Effect of ultrasound temperature on the extraction amount of total flavonoids from mulberry leaves
2.3.7 酶添加量对桑叶总黄酮提取量的影响 由图9可知,当酶添加量为4%时,桑叶总黄酮提取量最大。总黄酮提取量随着酶添加量的增加先增大后降低,可能是因为随着酶添加量的增加,破坏了细胞壁使得桑叶总黄酮不断溶出,但过量的酶又会使黄酮结构发生破坏,桑叶总黄酮提取量随之下降。因此,选择酶添加量为3%、4%、5%进行响应面试验。
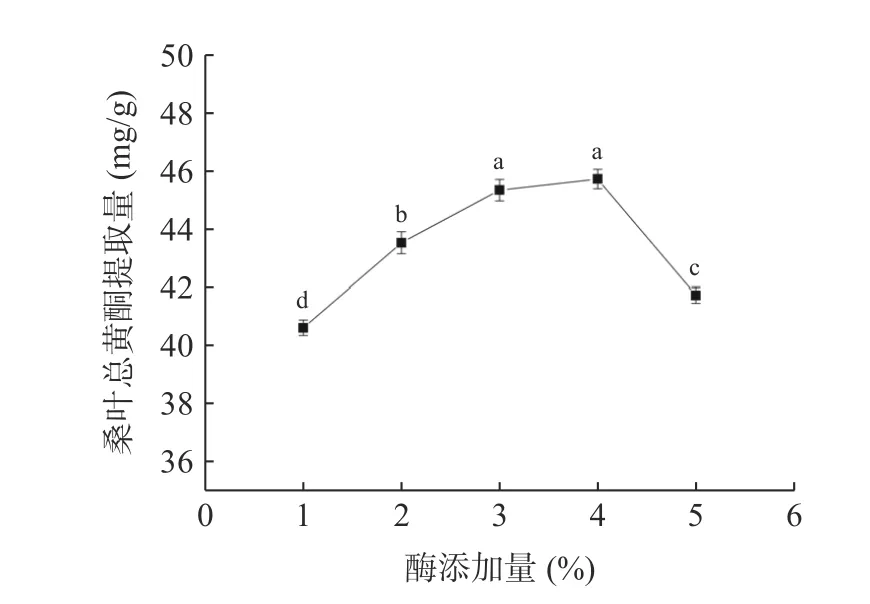
图9 酶添加量对桑叶总黄酮提取量的影响Fig.9 Effect of enzyme dosage on the extraction amount of total flavonoids from mulberry leaves
2.4 响应面试验
2.4.1 响应面试验结果与方差分析 在单因素实验基础上,选择含水量、酶添加量和超声时间为考察变量,以桑叶总黄酮提取量为响应值,响应面试验设计与结果见表3,方差分析见表4。
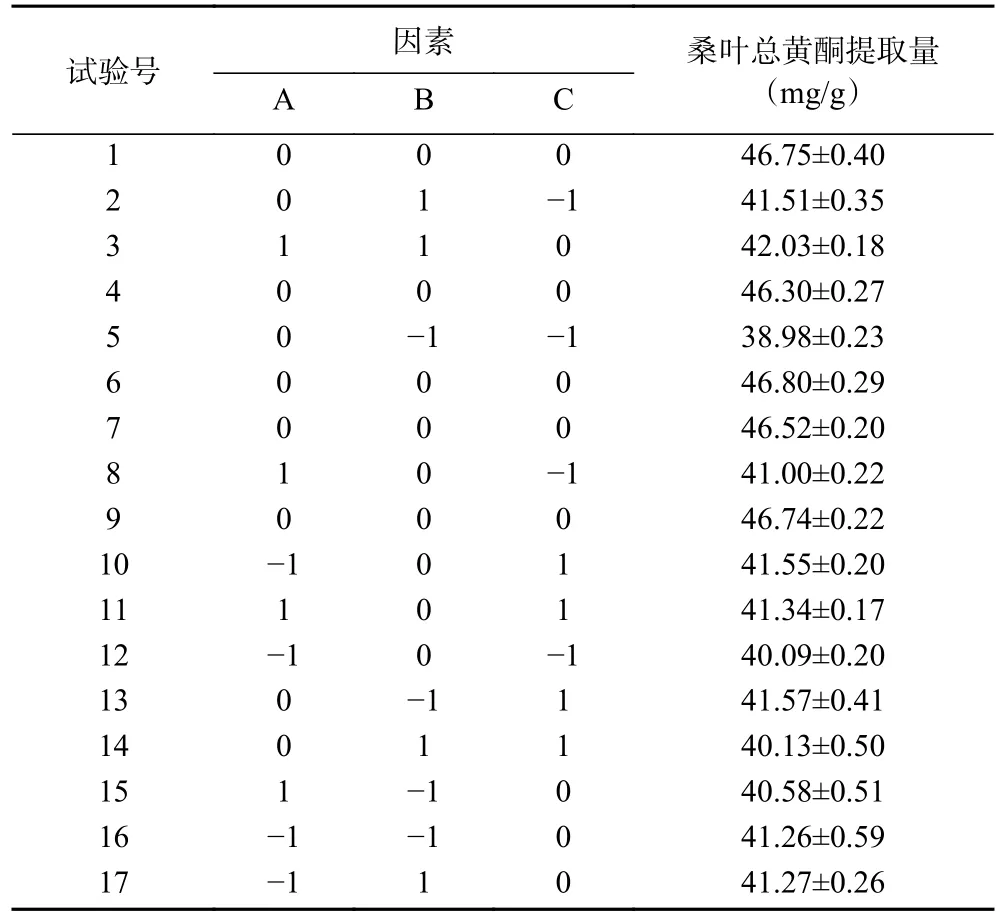
表3 Box-Behnken 试验设计方案及结果Table 3 Design scheme and results Box-Behnken experiment
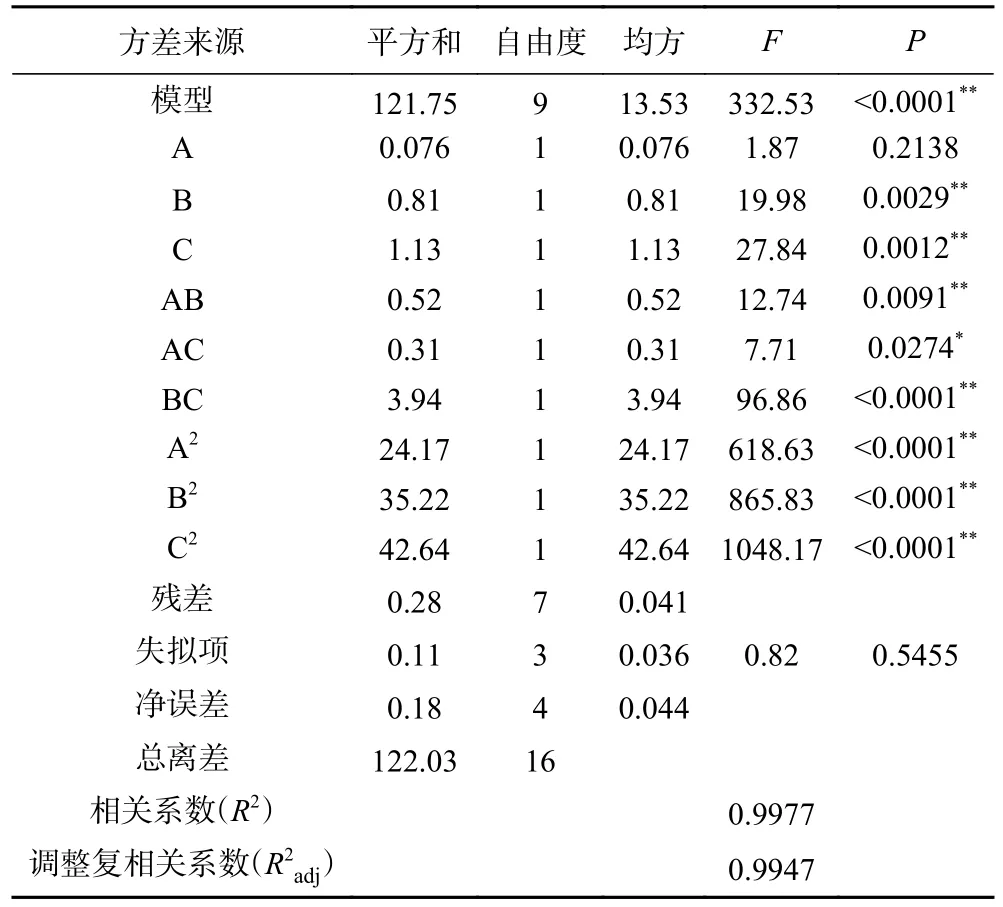
表4 回归模型的方差分析Table 4 Analysis of variance for the regression model
根据软件预测得到二元多次回归方程:桑叶总黄酮提取量(mg/g)=46.62+0.098A+0.32B+0.38C+0.36AB-0.28AC-0.99BC-2.44A2-2.89B2-3.18C2
由表4 可知,该模型P<0.0001,极显著,失拟项P=0.5455>0.05,不显著,说明该模型拟合度较好。一次项B、C、二次项A2、B2、C2对桑叶总黄酮提取量的影响均为极显著(P<0.01),交互项AB 和BC 对桑叶总黄酮提取量的影响极显著(P<0.01),AC 对桑叶总黄酮提取量的影响为显著(P<0.05),R2=0.9977,R2adj=0.9947,说明模型预测的桑叶总黄酮提取量与试验的桑叶总黄酮提取量相关性好,拟合度较好,能很好地反映桑叶总黄酮提取量与它们三者之间的关系。根据F值,影响桑叶总黄酮提取量的各因素大小顺序为超声时间(C)>酶添加量(B)>含水量(A)。
2.4.2 响应面交互作用 3D 响应面曲线图弯曲程度越大表明2 个因素交互作用越显著,等高线形状越扁表明因素对响应值的影响越显著[32]。由图10 可以看出AB、AC、BC 曲线有较好的倾斜度,等高线呈椭圆形且等高线较为密集,说明含水量、酶添加量和超声时间,两两之间的交互作用对桑叶总黄酮提取量的影响显著。
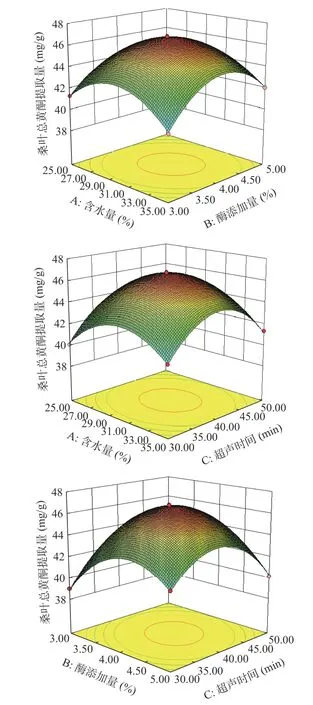
图10 各因素交互作用对桑叶总黄酮提取量影响的响应面分析Fig.10 Response surface analysis of the influence of interaction of various factors on the extraction amount of total flavonoids from mulberry leaves
经模型分析预测得到桑叶总黄酮最佳提取工艺条件为含水量30.10%、酶添加量4.05%、超声时间40.51 min,桑叶总黄酮提取量预测值为46.64 mg/g;为了方便操作,将提取条件调整为含水量30%、酶添加量4%、超声时间40 min,在此条件下进行3 次重复实验,测定桑叶总黄酮提取量为46.58 mg/g,真实值与预测值相符度高,说明该工艺可行。
2.5 桑叶总黄酮抗氧化能力测定
2.5.1 DPPH 自由基清除率 如图11 所示,随着质量浓度的增加,桑叶总黄酮、抗坏血酸和Trolox 的DPPH 自由基清除率先增加后趋于平稳。质量浓度小于0.05 mg/mL 时,同一质量浓度下,桑叶总黄酮清除能力明显低于抗坏血酸和Trolox,质量浓度大于0.05 mg/mL 时,同一质量浓度下,桑叶总黄酮清除能力与抗坏血酸和Trolox 几乎一致。当质量浓度从0.01 mg/mL 增加到0.08 mg/mL 时,桑叶总黄酮、抗坏血酸和Trolox 的清除率分别从25.25%、47.77%、83.18%增加到98.36%、98.57%、98.87%。结果表明桑叶总黄酮具有一定的清除DPPH 自由基的能力。
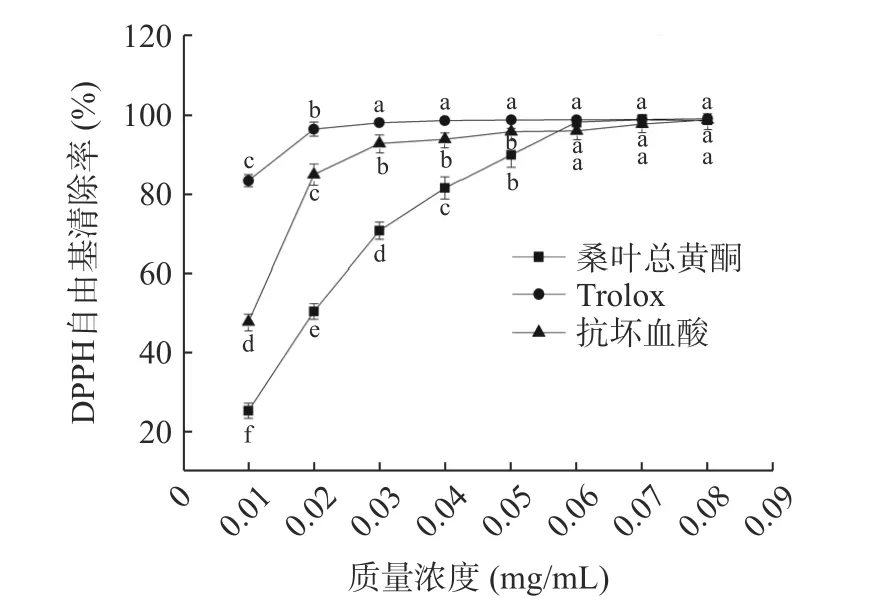
图11 不同样品清除 DPPH 自由基能力Fig.11 DPPH free radical scavenging ability of different samples
2.5.2 ABTS+自由基清除率 如图12 所示,随着质量浓度的增加,桑叶总黄酮的ABTS+自由基清除能力不断增加,抗坏血酸和Trolox 的ABTS+自由基清除能力先增加后趋于平稳,桑叶总黄酮ABTS+自由基清除能力明显低于抗坏血酸和Trolox。当质量浓度从0.02 mg/mL 增加到0.20 mg/mL 时,桑叶总黄酮、抗坏血酸和Trolox 的清除率分别从8.33%、16.53%、23.07%增加到72.12%、99.48%、99.67%。结果表明桑叶总黄酮具有一定的清除ABTS+自由基的能力。
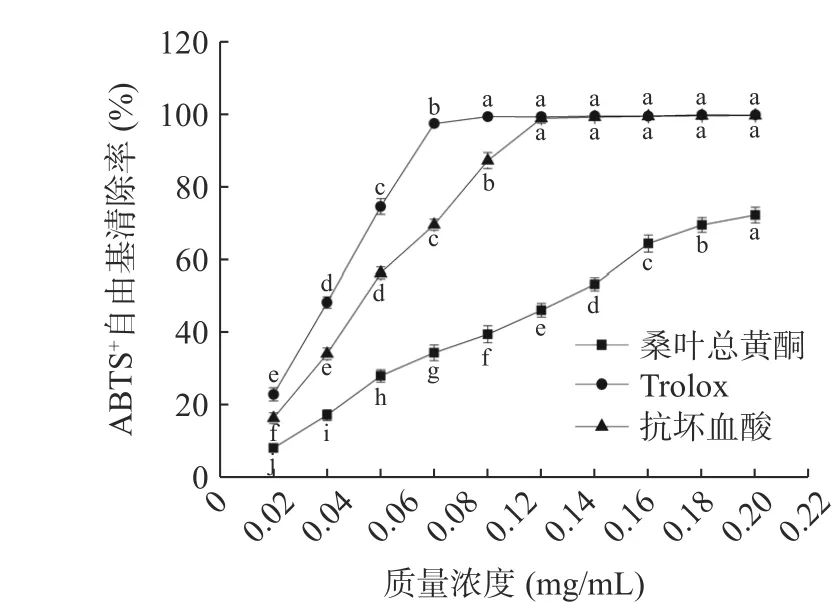
图12 不同样品清除ABTS+自由基能力Fig.12 ABTS+ free radical scavenging ability of different samples
3 结论
本文建立了一种绿色、经济、环保、高效、低廉的超声-酶辅助低共熔溶剂提取桑叶总黄酮新型方法。通过比对水提取法、醇提取法、超声水提取法、超声醇提取法和超声低共熔溶剂提取法,确定了超声-酶辅助低共熔溶剂提取法效果最佳;筛选17 种二元或三元DES 溶剂对桑叶总黄酮提取量的影响,以DES-13 氯化胆碱/果糖/乙醇摩尔比为1:1:3 为最佳提取溶剂。结合单因素实验和响应面试验得到桑叶总黄酮的最佳提取工艺条件:含水量为30%、液料比为40 mL/g、超声功率为360 W、超声温度为40 ℃、超声时间为40 min、酶添加量4%条件下,桑叶总黄酮提取量为46.58 mg/g;当总黄酮质量浓度为0.08 mg/mL 时,桑叶提取物的DPPH 自由基清除率为98.36%,当总黄酮质量浓度为0.2 mg/mL 时,桑叶提取物的ABTS+自由基清除率为72.12%。这为后续桑叶总黄酮提取物的应用提供了数据支撑和理论基础。

