乳提技术提高干姜提取物生物利用度及其抗炎活性研究
马 真,徐 军,邬 娟,王彩云,何 剑 ,敬 璞,
(1.上海交通大学农业与生物学院,上海 200240;2.上海交通大学四川研究院,四川成都 610000;3.内蒙古乳业技术研究院有限责任公司,内蒙古呼和浩特 010080;4.伊利伊诺科技(上海)有限责任公司,上海 201111;5.国家乳业技术创新中心,内蒙古呼和浩特 010080)
干姜作为一种传统的食品香辛料和药材在世界各地享有盛誉。干姜中含有多种活性成分,其中姜酚是其主要的活性物质[1]。根据苯环的取代基不同、位置及侧链长短不同等差异,姜酚类物质包括多种分子质量不同、分子结构仅略有差异的姜酚类物质,其中6-姜酚、8-姜酚、10-姜酚、6-姜烯酚、8-姜烯酚、10-姜烯酚及姜酮是代表性的活性物质[2]。研究表明,姜酚类物质具有抗炎、抗氧化、抗癌、健胃止呕、保护心血管等多种功效[3-5]。
干姜中姜酚类活性成分存在稳定性差、水溶性低,易在胃肠道环境中降解失活、生物利用度低等问题,制约了其在功能性食品原料中的应用。传统干姜提取方法多以水/乙醇为溶剂,辅助微波、超声波、超临界流体萃取法等技术,但仍存在活性成分提取率低、溶解度差等问题。乳提技术是利用含乳脂的乳化体系(如全脂奶、稀释稀奶油等)作为提取溶剂,通过相似相溶原理,能更有效地对脂溶性成分进行提取[6]。此外,脂溶性物质与乳蛋白以非共价键或共价键形式结合形成复合物,可以改善脂溶性物质的溶解性[7]。研究发现,牛奶可以提高茶饮中黄酮醇、儿茶素的生物可及性及肠道吸收[8-9]。因此利用全脂奶作为溶剂,依据相似相溶原理有望提高干姜中姜酚类物质的提取率,改善姜酚类物质的生物利用度和生物功效。
本文利用全脂奶作为溶剂制备干姜乳提物,分析其姜酚类物质的含量变化,进一步构建Caco-2 细胞模型研究乳提方法对干姜提取物生物利用度的影响,并以大鼠急性结肠炎模型评估干姜乳提物的抗结肠炎活性功效,为干姜提取物(活性成分)的高效提取及含姜类功能食品的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
SPF 级雄性SD 大鼠36 只,5~6 周龄,体重量246±11 g 上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2022-0004;人结肠腺癌细胞株(Caco-2)购自中国科学院上海细胞库;干姜(云南省罗平县,2022,姜科植物姜ZingiberofficinaleRosc.的根茎)安徽益生源药业有限公司;干姜水提物 黄山华绿园生物科技有限公司;全脂奶新西兰恒天然集团;6-姜酚、8-姜酚、10-姜酚、6-姜烯酚、8-姜烯酚、10-姜烯酚、姜酮(纯度均 ≥98%)上海源叶生物科技有限公司;无水乙醇(AR,>99.8%)国药集团化学试剂有限公司;甲酸(色谱纯)上海安谱实验科技股份有限公司;胎牛血清美国Thermo Fisher Scientific 公司;0.25%胰蛋白酶-乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)消化液 上海少辛生物科技有限公司;DMEM 不完全高糖培养基、细胞活检测试剂盒(cell counting kit-8,CCK-8)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒 南京凯基生物科技有限公司;丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-1β(interleukin-1β,IL-1β)酶联免疫吸附测定试验(enzyme-linked immunosorbent assay,ELISA)试剂盒 南京建成生物工程研究所有限公司;葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)美国MP 公司;粪便隐血试剂盒 上海源叶生物科技有限公司;其余化学试剂 均为分析纯,购自国药集团化学试剂公司。
AB104-N 电子天平 梅特勒-托利多(上海)有限公司;LC-2030C 高效液相色谱(high performance liquid chromatography,HPLC)仪 岛津(中国)有限公司;TECAN 多功能酶标仪 美国TECAN 公司;Biomate 3S 紫外-可见光分光光度计、Steri-Cycle 370二氧化碳细胞培养箱 美国赛默飞世尔科技公司;XO-650D 超声波细胞破碎仪 南京先欧仪器制造有限公司;SW-CJ-1FD 超净工作台 苏净安泰公司;Leader-A1 标准型纯水仪 上海领德仪器有限公司;L535R 冷冻离心机 长沙湘仪离心机仪器有限公司;DMIL-LED 型倒置显微镜 德国莱卡公司。
1.2 实验方法
1.2.1 干姜乳提物制备 干姜原料粉碎后,过10 目筛网。将500 mL 全脂奶于60 ℃水浴加热,称取20 g 干姜粉加入上述全脂奶中,于60 ℃下加热搅拌提取1 h。提取结束后,提取液过120 目筛网。滤液进一步离心,转速为3000 r/min,时间5 min。取上层离心液,进行冻干,即得干姜乳提物。
1.2.2 姜酚类物质的测定 称取干姜水提物2.0 g于50 mL 离心管,加入10 mL 乙醇,冰浴下超声15 min,12000 r/min 离心5 min,取上清液,再向下层沉淀物中加入10 mL 乙醇,重复上述超声步骤2次。将3 次离心后的上清液混合,减压蒸干后,加入4 mL 无水乙醇复溶,过0.22 μm 滤膜,过膜后进样。
称取干姜乳提物2.0 g 于50 mL 离心管,加入10 mL 氯仿/丙酮(1:1),过夜静置后,超声15 min,12000 r/min 离心5 min,取上清液后,再向下层沉淀物中加入10 mL 氯仿/丙酮,重复上述超声步骤3 次。将4 次离心后的上清液混合,减压旋干(除去氯仿/丙酮),加入4 mL 无水乙醇复溶,过0.22 μm 滤膜,过膜后进样。
HPLC 条件:色谱柱为Athena C18(4.6 mm×250 mm,5 μm);流动相A 体积分数0.4%甲酸溶液;流动相B 乙腈;梯度洗脱程序:0~3 min,90%A、10%B;3~5 min,70%A、30%B;5~45 min,50%A、50%B;45~110 min,20%A、80%B;110~115 min,90%A、10%B;115~130 min,90%A、10%B。流速:1 mL/min;柱温:40 ℃;紫外检测器波长:282 nm;进样量50 μL。
通过比较样品中各检测峰和标准品的保留时间及光谱特性进行定性,根据各标准品的标准曲线方程计算样品中各姜酚的含量,结果以每g 干姜提取物中所含的各姜酚质量表示(mg/g),以干质量计。
1.2.3 细胞培养 细胞培养参考MA 等[10]对Caco-2细胞复苏、培养、传代。将复苏后的Caco-2 细胞用细胞培养液(含10%胎牛血清和90% DMEM)接种到25 cm2的透气培养瓶中,标上记号,置于37 ℃、5% CO2细胞培养箱中进行培养,每隔一天更换一次培养液。将培养瓶置于倒置显微镜下观察细胞贴壁生长状态,当细胞密度达到90%时,吸去旧液,加入1 mL 的0.25%胰蛋白酶-0.02% EDTA 混合消化液,轻轻摇晃培养瓶放于37 ℃培养箱中消化1 min,使细胞分散。加入培养基停止消化,得到细胞悬浮液。将细胞悬浮液离心后再次加入新鲜培养基悬浮,并按1:2 的比例进行细胞传代。
1.2.4 细胞毒性考察 分别称取干姜水提物和干姜乳提物1.0 g 于50 mL 离心管,加入10 mL 超纯水溶解,过0.22 μm 无菌滤膜后,用DMEM 分别稀释至50、20、15、10、5、1、0.1、0.05 mg/mL,备用。
试验在眉山中车紧固件科技有限公司完成。转向架制动杠杆1、2铆接位置预先铆接完成,试验的检测对象为转向架制动杠杆的4个铆接位置(3、4、5、6号位置)的铆接状态。
将处于对数期的Caco-2 细胞,以密度1×105个/mL 接种到96 孔板。设置空白组、对照组、样品组A(干姜水提物溶液)和样品组B(干姜乳提物溶液)。对照组和样品组每孔分别加混合的细胞悬液100 μL,空白组加入完全培养基100 μL,置于37 ℃、5% CO2培养。24 h 细胞贴壁后,弃去上层培养基。样品组A 和B 每孔分别加入不同浓度梯度的干姜水提物和干姜乳提物溶液100 μL,空白组和对照组均加入完全培养基100 μL,摇匀,相同培养条件再孵育24 h。之后弃去上层培养基,每孔加入100 μL 含CCK-8(CCK-8:总体积=1:10)培养基。将培养板继续放在培养箱孵育1 h,用酶标仪测定450 nm 吸光度OD 值,计算细胞存活率。存活率计算公式:
1.2.5 Caco-2 细胞吸收模型建立 参考LIU 等[11]细胞模型建立方法,将Caco-2 细胞以1×106个/mL密度接种于6 孔板中,每孔加入2 mL 细胞培养液,培养24 h 后,吸除培养皿中的培养液,用pH7.4 的PBS 缓冲液冲洗后,每孔加入2 mL PBS 缓冲液,置于培养箱中孵育15 min。然后吸除培养皿中的PBS 溶液,每孔2 mL 加入DMEM 稀释后的干姜水提物溶液和干姜乳提物溶液,继续培养不同时间(1、3、6、12、24 h)。培养结束后,快速吸取并弃去培养液,用PBS 溶液冲洗细胞3 次。吸除PBS 溶液,每孔加入150 μL 的RIPA 细胞裂解液,将培养皿中Caco-2 细胞全部转移到2 mL 离心管中,超声破碎2 min,氮气吹干后,加入200 μL 色谱级甲醇,超声溶解后,13000 r/min 离心10 min,取上清50 μL 进HPLC 测定分析摄取进入Caco-2 细胞中的酚类物质的含量。
1.2.6 构建DSS 诱导的大鼠结肠炎模型 参考文献[12]建立大鼠溃疡性结肠炎模型,36 只SD 大鼠适应性喂养一周后,随机分为6 组,每组6 只,除正常组外,其余组在第3 d 后用超纯水配制4% DSS溶液代替日常饮用水给予大鼠自由饮用,诱导大鼠溃疡性结肠炎。正常组第0 d 开始灌胃生理盐水,其余组灌胃不同剂量干姜提取物,具体分组及构建方法如图1 所示。依据干姜水/乳提物中总姜酚的含量及姜酚对老鼠模型结肠炎抑制剂量,DSS+干姜乳提取物组(DSS+MG)灌胃剂量为6.6 g/kg,换算成总姜酚的量为10 mg/kg,该剂量与文献报道剂量一致[13]。DSS+干姜水提取物低剂量组(DSS+WGL)与DSS+MG 组灌胃剂量相同,其总姜酚的量为8.0 mg/kg。DSS+干姜水提取物高剂量组(DSS+WGH)灌胃剂量8.3 g/kg,该组与DSS+MG 组中总姜酚的量相同。实验所用干姜乳提物每克中含0.92 g 全脂乳粉,为排除干姜乳提取物中全脂乳粉的影响,以DSS+MG 的灌胃剂量为对照,DSS+全脂乳粉组(DSS+M)灌胃剂量为6 g/kg。本实验经上海交通大学实验动物伦理与使用委员会批准,批文编号202201352。

图1 大鼠溃疡性结肠炎模型构建Fig.1 Experimental scheme for construction of rat model of ulcerative colitis
模型组和实验组大鼠第3 d 开始饮用4% DSS饮用水造模,连续饮用9 d 后,造模结束断食24 h 后大鼠称量,脱颈处死,动脉取血收集血清。称量脾脏质量并记录。取盲肠到直肠末端的距离作为大鼠结肠长度,并对其称重。收集的大鼠各组织器官保存于-80 ℃冰箱。
1.2.7 大鼠体质量变化率、脾脏指数和疾病活动指数测定 体质量变化率按下式计算。
从适应性喂养结束后开始到动物饲养结束,对大鼠的体重、便血情况(联苯胺法检测)、粪便形态3 个方面进行评分,评分标准参照[14]。具体的体重评分标准,0 分:体重无变化;1 分:体重降低5%以内;2 分:体重降低5%~10%;3 分:体重降低10%~15%;4 分:体重降低15%以上;便血评分标准,0 分:正常;2 分:隐血阳性;4 分:大出血;粪便评分标准,0 分:正常;1 分:柔软但有形;2 分:松散;3 分:非常柔软;4 分:腹泻。疾病活动指数(disease activity index,DAI)为以上3 个指标得分总和的平均值[15]。
称取大鼠脾脏质量并记录,按如下公式计算小鼠脾脏指数。
1.2.9 大鼠结肠组织促炎因子水平测定 按照ELISA 试剂盒说明书中的要求,测定10%大鼠结肠组织匀浆中促炎因子TNF-α、IL-6、IL-1β水平。
1.3 数据处理
实验结果采用平均值±标准偏差表示。采用SPSS 16.0 软件对数据进行单因素方差分析,P<0.05 表示差异显著。
2 结果与分析
2.1 干姜提取物中酚类物质定性及定量分析
根据特征姜酚物质6-姜酚、8-姜酚、10-姜酚、6-姜烯酚、8-姜烯酚、10-姜烯酚、姜酮标准品的HPLC 图谱的出峰时间,确定干姜水提物和干姜乳提物中各姜酚的色谱峰,结果如图2 所示。以标准物质的进样量(mg)为横坐标,以峰面积为纵坐标,计算各标准品的线性关系如表1 所示。根据表1 各姜酚标准品的液相保留时间和标准曲线,计算水/乳提干姜样品中7 种酚类物质的含量(mg/g,干重),结果如表2 所示。由结果可知,干姜乳提物中酚类物质的含量与干姜水提物相比具有差异性,其中6-姜酚、8-姜酚、6-姜烯酚、8-姜烯酚、10-姜烯酚、姜酮的含量均显著高于干姜水提物(P<0.05)。然而干姜乳提取物中10-姜酚含量略低于干姜水提物,这可能是因为乳提工艺加热过程有助于10-姜酚转化为姜酮[16]。

表1 标准品线性关系Table 1 Linear relationship of standards

表2 样品中酚类物质的含量(mg/g,干重,n=3)Table 2 Content of phenol in samples (mg/g,dry weight,n=3)
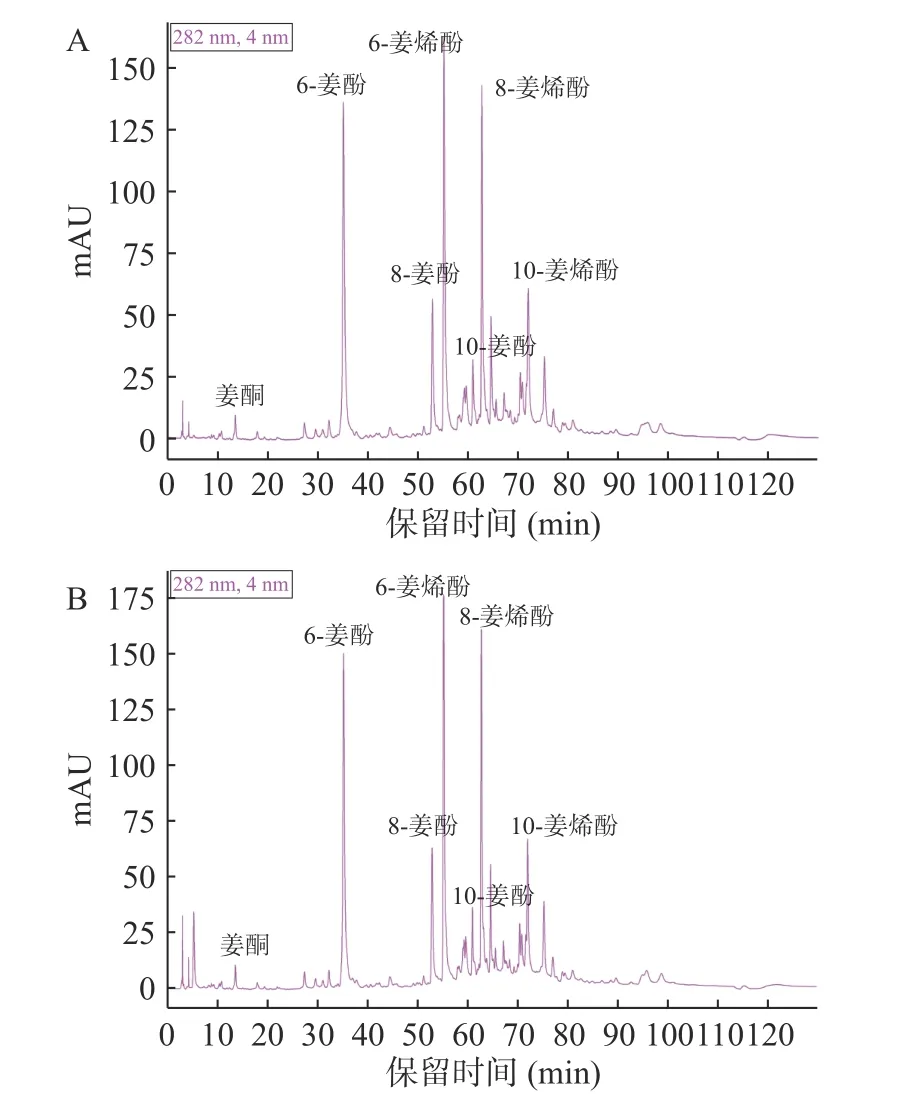
图2 干姜水提物(A)、干姜乳提物(B)的HPLC 图谱Fig.2 HPLC chromatograms of ginger water extract (A) and ginger milk extract (B)
2.2 不同浓度水提/乳提干姜提取物对Caco-2 细胞毒性的影响
采用CCK-8 检测两种干姜提取物对Caco-2 细胞的毒性作用,筛选出用于Caco-2 细胞吸收模型的最佳样品浓度。待测样品处理Caco-2 细胞24 h 后,细胞存活率大于90%,说明该浓度样品对细胞毒性可忽略不计。不同浓度(50、20、15、10、5、1、0.1 mg/mL)的水提干姜提取物处理Caco-2 细胞24 h 后,细胞存活率如图3A 所示。样品浓度为50~15 mg/mL时,细胞存活率均低于90%,说明以上浓度干姜提取物中姜酚类物质的剂量对Caco-2 细胞具有毒性。当样品浓度为10 mg/mL,细胞活力值为92.3%>90%,说明该浓度对 Caco-2 细胞无明显毒性。参考干姜水提物浓度处理Caco-2 细胞的最佳浓度,采用50、10、5、1、0.1 mg/mL 的干姜乳提取物处理Caco-2细胞24 h 后细胞存活率如图3B 所示。当样品浓度为50 mg/mL,细胞存活率为85.1%,且与未处理的对照组相比差异显著(P<0.05),说明该浓度对 Caco-2细胞有一定毒性。当样品浓度为10 mg/mL,细胞存活率为93.2%>90%,说明该浓度对Caco-2 细胞无明显毒性。因此,综合以上细胞毒性实验结果,选用10 mg/mL 作为两种干姜提取物处理Caco-2 细胞浓度。
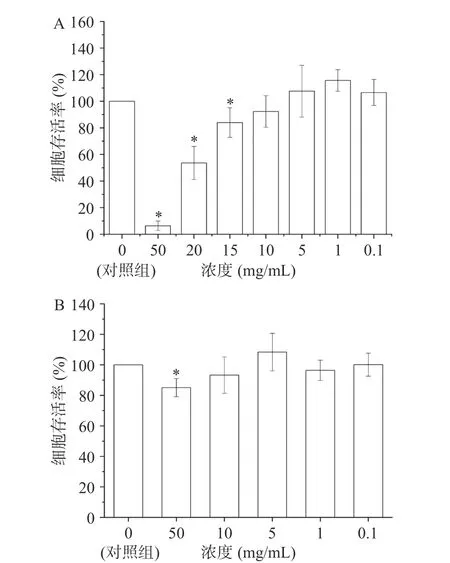
图3 不同浓度干姜水提物(A)和干姜乳提物(B)对Caco-2 细胞存活率的影响Fig.3 Anti-proliferation effects of ginger water extract (A) and ginger milk extract (B) on Caco-2 cells
2.3 干姜提取物在Caco-2 细胞中的吸收特性
Caco-2 细胞的结构和生理功能与小肠上皮细胞类似,因此Caco-2 细胞是最典型研究活性物质体外吸收的模型[17]。不同物质在肠细胞内吸收途径有差异,包括被动扩散、囊泡胞吞胞吐、受体或转运介质的主动运输[18]。根据细胞毒性实验确定的干姜水提物和干姜乳提物的安全剂量(10 mg/mL)加入到Caco-2 细胞模型中,培养不同时间后,收集破碎细胞,取上清液,参照表1 中各酚类标准品的液相保留时间和标准曲线,分析Caco-2 细胞对7 种酚类物质的吸收量(μg/mg),结果如表3 所示。在培养3 h 时,Caco-2 细胞对干姜水提物中的各酚类物质的吸收达到最大值,而干姜乳提物中的酚类物质的吸收量在培养12 h 时达到最大。相比于其他酚类物质,Caco-2细胞对10-姜酚的吸收量最大,这可能是10-姜酚的脂溶性较强,可通过被动扩散进入肠道细胞,从而更容易被Caco-2 细胞吸收[19]。8-姜烯酚、姜酮在细胞上清液中均未检出,可能是因为其本身在干姜提取物中含量偏低,导致Caco-2 细胞吸收量低于检出限(0.001 μg/mg)。

表3 样品中各酚类物质在Caco-2 细胞的吸收量(μg/mg,n=3)Table 3 Content of phenols absorbed by Caco-2 cells in the samples (μg/mg,n=3)
依据表3 数据计算7 种酚类物质含量总和,分析干姜水提物和干姜乳提物中总姜酚在Caco-2 细胞中的吸收量(μg/mg),结果如图4 所示。随着时间的增加,干姜水提物中总姜酚的含量在3 h 达到最高,为2.39 μg/mg。随后,总姜酚的含量逐渐降低,12 h 后总姜酚的细胞中的吸收量降低至1.26 μg/mg,这可能是因为细胞内部含有II 相异源物质代谢酶[20],容易使得酚类物质降解。干姜乳提物中总姜酚的含量在3 h 为1.85 μg/mg,12 h 后达到最高,为2.34 μg/mg,随后降低,24 h 后总姜酚的细胞中的吸收量降低至1.70 μg/mg,但显著高于干姜水提物(P<0.05)。乳提干姜样品中的总姜酚进入细胞的速度较慢,这是因为水提干姜样品中酚类物质主要根据浓度差被动进入细胞,而乳提样品中含有的乳蛋白与酚类结合,可能会通过蛋白质或多肽的吸收途径(如胞吞)进入细胞[21]。酚类物质与乳蛋白的结合可以抑制酚类物质的自动氧化,减缓其在细胞中的降解,有利于提高酚类物质在Caco-2 细胞中的吸收量[9]。此外,姜酚物质可能被乳提样品中的脂肪成分包埋形成乳脂包埋体系,由于细胞膜主要由磷脂双分子层组成,根据相似相容原理,包埋姜酚的乳脂体系也更容易透过细胞膜被细胞吸收[22]。上述结果说明,采用乳提技术改变了姜酚类物质的细胞吸收机制,提高了干姜中姜酚类物质的细胞吸收量。该技术有助于提高干姜提取物生物利用度。
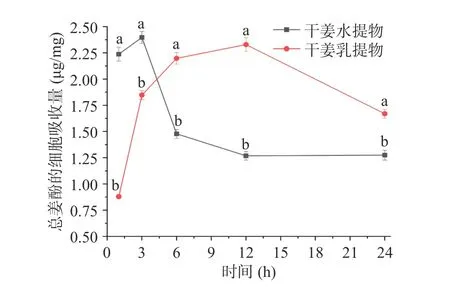
图4 不同时间水提和乳提干姜提取物中的总姜酚在Caco-2 细胞的吸收量(μg/mg)Fig.4 Content of total phenols absorbed by Caco-2 cells in ginger water extract and milk extract at different times (μg/mg)
2.4 干姜提取物对大鼠体质量变化率及DAI 的影响
体重减轻、腹泻或粪便疏松和可见的血便是结肠炎大鼠建模成功的典型症状之一[23]。从动物实验第3 d 开始进行DSS 诱发结肠炎模型造模,造模9 d 后(即实验第12 d)结束,造模结束后DSS 组大鼠出现行动迟缓、腹泻、肛门处可明显观察到血便,且与NC 组对比,DSS 组大鼠的体重显著降低(P<0.05),说明造模成功。如图5A 所示,以各组DSS 处理前大鼠体重为参照,测量DSS 结肠炎诱导期间大鼠体重的变化。随着DSS 处理时间的增加,大鼠体重开始下降,造模结束后DSS 组大鼠体重较造模初始(实验第3 d)下降了28.42%,而NC 组大鼠体重较初始增加了22.28%,DSS 组大鼠相较于NC 组体质量显著下降(P<0.05)。与DSS 组相比,干姜提取物处理组(DSS+MG、DSS+WGL、DSS+WGH)大鼠体重下降趋势减缓,分别下降至初始体质量的11.33%、18.43%、15.22%,其中灌胃干姜乳提物的大鼠体质量下降最低。以上结果说明干姜提取物能有效减缓DSS 诱导结肠炎体重减轻症状,并且干姜乳提物的效果要优于干姜水提取物。

图5 干姜提取物对大鼠体质量变化率(A)和DAI 评分(B)的影响(x¯±s,n=6)Fig.5 Effect of ginger extracts on percentage body mass change (A) and DAI score (B) in rat (,n=6)
DSS 组大鼠从第5 d 起部分大鼠出现懒动体毛凌乱、大便松散、肉眼血便;第7 d,DSS 组大鼠全部出现上述症状,且随着造模天数延长病情逐渐加重。如图5B 所示,DSS 组大鼠DAI 评分与NC 组相比显著升高(P<0.05)。与DSS 组大鼠相比,干姜提取物处理组(DSS+MG、DSS+WGL、DSS+WGH)大鼠上述症状均有不同程度的减轻,DAI 评分明显降低,并且第12 d 后,DSS+MG 处理组的DAI 评分显著低于DSS+WGL 和DSS+WGH 处理组(P<0.05),说明乳提干姜处理组具有较好的降低结肠炎DAI 的效果。
2.5 干姜提取物对大鼠结肠长度、重量及脾脏指数的影响
在DSS 诱导下,大鼠的结肠会出现萎缩的症状[24]。结肠质量和长度的变化是评价大鼠结肠炎症状的重要参数[25]。如图6A、6B 所示,DSS 组大鼠结肠长度为11.03 cm,结肠重量为6.77 g,而NC 结肠长度为18.51 cm、结肠重量为9.19 g,因此DSS 组与NC 组相比结肠的长度和重量均显著降低(P<0.05),也说明了结肠炎模型造模成功。DSS+MG、DSS+WGL、DSS+WGH 组大鼠结肠长度和质量均显著高于DSS 组(P<0.05),而DSS+M 组大鼠结肠长度和重量与DSS 组无显著差异。三种干姜提取物处理组中相同质量浓度灌胃处理下,DSS+MG 组大鼠结肠长度为14 cm、重量为8.83 g,DSS+WGL 组结肠长度为12 cm、重量6.95 g;与DSS+MG 组具有相同姜酚含量的DSS+WGH 组大鼠结肠长度为12.5 cm、重量为7.74 g,三者比较说明,不同提取方式的干姜提取物均有改善大鼠结肠萎缩的效果,其中干姜乳提物缓解DSS 诱导的大鼠结肠缩短的效果最好。

图6 干姜提取物对大鼠结肠长度(A)、结肠重量(B)和脾脏指数(C)的影响(x¯±s,n=6)Fig.6 Effect of ginger extracts on colon length (A),mass (B),and spleen index (C) in rat (,n=6)
脾脏是大鼠最大的免疫器官,炎症反应会使脾脏发生肿大从而导致质量增加[26]。如图6C 所示,DSS 组大鼠脾脏指数显著高于NC 组(P<0.05),与DSS 组相比,DSS+MG、DSS+WGL、DSS+WGH 组脾脏指数均显著降低(P<0.05),其中DSS+MG 组大鼠脾脏指数最低,说明相较于干姜水提物,干姜乳提物具有更高的降低肠炎大鼠脾脏指数的效果。
2.6 干姜提取物对大鼠结肠组织炎症因子的影响
TNF-α、IL-1β和IL-6 促炎细胞因子在机体中具有调节炎症反应、免疫应答等重要作用,是反映肠道炎症程度的关键标志物[27]。为明确不同提取方式干姜提取物对DSS 诱导的肠炎大鼠促炎细胞因子的影响,分析了各处理组结肠中TNF-α、IL-1β、IL-6 的分泌量,分析结果如图7 所示。由图可知DSS 组大鼠结肠组织中TNF-α、IL-1β、IL-6 的分泌量分别为12.39、145.96、24.04 pg/mg prot,与NC 组相比显著上升(P<0.05),说明肠炎大鼠结肠组织中促炎细胞因子分泌量增多。DSS+M 组大鼠结肠组织中TNF-α、IL-1β、IL-6 的含量与DSS 组相比变化不显著。DSS+MG、DSS+WGL、DSS+WGH 组与DSS 组相比,大鼠结肠组织中TNF-α、IL-1β、IL-6 的含量显著降低(P<0.05),其中DSS+MG 组大鼠结肠组织中TNF-α、IL-1β、IL-6 的分泌量最低,分别为7.13、49.45、11.49 pg/mg prot,说明干姜乳提物对DSS 诱导的肠炎大鼠结肠组织的促炎细胞因子具有良好的抑制作用。

图7 干姜提取物对大鼠结肠组织炎症因子水平TNF-α(A)、IL-1β(B)、IL-6(C)的影响(,n=6)Fig.7 Effect of ginger extracts on serum inflammatory factors TNF-α (A),IL-1β (B),IL-6 (C) in colon tissue of rat (,n=6)
2.7 干姜提取物对大鼠结肠组织中SOD 和MDA 水平的影响
活性氧的代谢产物在大鼠结肠炎的发生发展过程中具有重要的作用[28]。氧化应激与细胞凋亡及炎症反应紧密相关[29]。SOD 是抗氧化防御体重中一种重要的酶,主要通过降解超氧化物,清除自由基发挥作用[30]。不同提取方式干姜提取物对大鼠结肠组织中典型抗氧化酶SOD 活性的影响如图8A 所示,与NC 相比,DSS 组大鼠结肠组织中SOD 活性显著下降(P<0.05)。与DSS 组相比,干姜提取物处理组(DSS+MG、DSS+WGL、DSS+WGH)均显著提高了DSS 诱导下大鼠结肠组织中SOD 活性(P<0.05),且DSS+MG 组结肠组织中SOD 活性高于DSS+WGL和DSS+WGH 组,说明干姜乳提物具有更高缓解肠炎引起的抗氧化酶活性降低的能力。
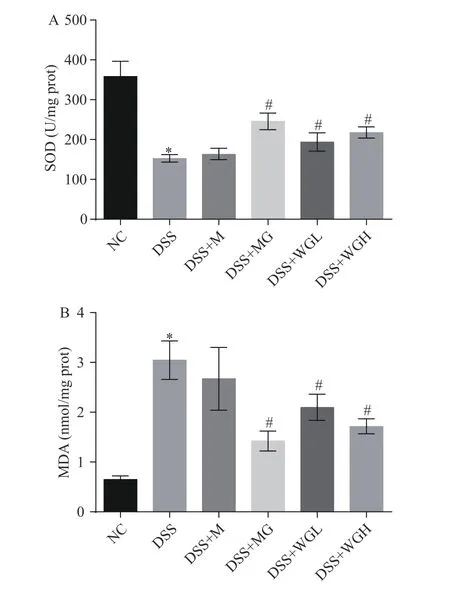
图8 干姜提取物对大鼠结肠组织SOD(A)和MDA(B)的影响(x¯±s,n=6)Fig.8 Effect of ginger extracts on the SOD activity (A) and MDA content (B) in colon tissue of rat (,n=6)
活性氧自由基与富含多不饱和脂肪酸的生物膜的磷脂、酶和膜受体及核酸等大分子物质发生脂质过氧化反应,能够生成丙二醛(MDA)等脂质过氧化物,损害生物膜及其功能,引起细胞纤维化,从而造成组织、器官等损伤[31]。为明确不同提取方式干姜提取物对DSS 诱导的结肠炎大鼠脂质过氧化水平的影响,分析了各处理组大鼠结肠组织中的MDA 的含量。由图8B 可知,与NC 组相比,DSS 组大鼠结肠组织中MDA 含量显著上升(P<0.05)。DSS+M 组大鼠结肠组织中MDA 含量与DSS 组相比没有显著变化(P>0.05)。DSS+MG、DSS+WGL、DSS+WGH组与DSS 组相比MDA 含量显著降低(P<0.05),其中,DSS+MG 组大鼠结肠中MDA 的含量最低,说明干姜乳提物可以更有效地缓解DSS 诱导的肠炎大鼠结肠脂质过氧化损伤。
3 结论
本实验比较分析了乳提和水提方式对干姜提取物中酚类活性物质含量的影响,利用Caco-2 细胞吸收模型和大鼠结肠炎模型研究了不同方式下干姜提取物的生物利用度和抗炎功效。结果表明,乳提技术能提高干姜中绝大多数姜酚类活性物质的提取率,干姜乳提物中以6-姜酚为代表的活性物质较干姜水提物提高了13.1%;干姜提取物的提取方式影响其在Caco-2 细胞的吸收。Caco-2 细胞吸收24 h 后,干姜乳提物中的酚类物质在Caco-2 细胞中的吸收量比干姜水提物提高了34.9%,说明乳提方法有利于提高干姜提取物的生物利用度。另外,干姜乳提物能显著改善DSS 诱导的结肠炎大鼠体重下降(P<0.05),显著减少结肠组织炎症因子TNF-α、IL-1β、IL-6 的表达量(P<0.05),提高SOD 活性,降低MDA 含量,且与干姜水提物相比具有更好的抗炎功效。综上,相较于市售的干姜水提物,干姜乳提物中活性成分含量更高,在生物利用度及抗氧化、抗炎功效方面具有优势。本研究为干姜乳提物在胃肠保护、抗氧化免疫功能产品的应用奠定了基础。

