两株代谢咖啡酸人肠道来源菌株的筛选、鉴定及其代谢过程初探
杨 雯,胡海明,刘洪涛,魏晓博,刘慧燕, ,方海田,
(1.宁夏大学食品科学与工程学院,宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川 750021;2.湖北中医药大学基础医学院,湖北武汉 430065)
咖啡酸(Caffeic acid,CA)又叫做3,4-二羟基肉桂酸,是一类天然的酚类化合物[1]。咖啡酸广泛存在于多种物质中,包括水果、豆类、葡萄酒、橄榄油和咖啡等[2]。而近年来开展的科学研究也证实,咖啡酸有抗氧化[3]、清除自由基[4]、抗癌细胞[5]、抗病毒[6]、热耐受性强[7]、降血糖[8]等各种生理作用,在人体保健发挥着特殊的作用,是一类纯天然的活性物质。此外,作为一种金属的螯合体,咖啡酸也能够避免由紫外线造成的细胞损伤[9-10]。
目前的研究多集中于咖啡酸的生物活性功能研究,然而对咖啡酸是如何在人体内代谢进而发挥作用机制尚不明晰。人体肠道是发酵和消化的场所[11],其中的肠道菌群组成复杂,数量巨大,包括拟杆菌、肠杆菌科、芽孢杆菌等。然而,人体肠道菌群并非绝对恒定的,与年龄、环境、性别、饮食等多种因素相关,其中饮食是改变肠道菌群最直接可行的方法之一[12-14]。肠道是药物代谢的主要器官之一,多种化学功能物质都在肠道菌群的共同作用下进行新陈代谢过程,其中肠道菌群和肠壁酶起着十分关键的作用,利用药效学活性成分和粪便悬浮液与肠道菌群在厌氧条件下孵育,是研究中药物质代谢的最有效方法之一[15-17]。经科学研究的证实,咖啡酸在胃和小肠中的吸收率仅为30%左右,其主要吸收和代谢部位是结肠[18]。但肠道微生物与咖啡酸如何相互作用,参与咖啡酸代谢的肠道微生物以及代谢产物尚不清楚。
本研究旨在明确参与咖啡酸代谢的肠道微生物及它们之间的相互作用,并借助形态学研究,生理生化实验以及16S rRNA 基因对两株肠道单菌株进行鉴定,将该菌直接运用于咖啡酸体外发酵中,并通过对咖啡酸发酵过程中指标研究,采用薄层层析法和高效液相分析法鉴定咖啡酸代谢产物,进一步阐明了咖啡酸的主要代谢方式以及代谢过程,为营养物质的靶向代谢的科学研究提供了必要的参考和依据。
1 材料与方法
1.1 材料与仪器
人体肠道粪便 联系5 名志愿者(3 男2 女),要求无消化系统疾病,3 个月内未服用抗生素或益生菌;咖啡酸(AR,98%)、间香豆酸(≥98%)、3-(3-羟基苯基)丙酸(≥98%)上海源叶生物科技有限公司;细菌基因组DNA 提取试剂盒、琼脂粉 北京索莱宝科技有限公司;切胶回收试剂盒 OMEGA 公司;Taq 酶PCR 试剂盒 武汉康为世纪生物科技有限公司;甲醇(≥99.5%)、甲酸(88%)、冰乙酸、氯仿国药集团化学试剂有限公司;琼脂糖 北京擎科生物科技有限公司;BHI 液体培养基 青岛高科技工业园海生物技术有限公司。
薄层色谱铝箔板 青岛邦凯高新技术材料有限公司;BXM-30R 压力蒸汽灭菌器 上海博讯实业有限公司;SW-CJ-2FD 超净工作台 北京东联哈尔仪器制造有限公司;V-5100 紫外分光亮度计 上海精科实业有限公司;LRH-250 生化培养箱 广东省医疗器械厂;凝胶成像系统、BioRad CFX 96 梯度PCR 仪 Eppendorf 公司;Spectra Max iD3 多功能酶标仪 美谷分子仪器上海有限公司;S210 pH 计上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 培养基的配制 BHI 液体培养基:胰蛋白胨10.0 g/L,牛心浸粉17.5 g/L,氯化钠5.0 g/L,葡萄糖2.0 g/L,磷酸氢二钠(12H2O)2.5 g/L,调pH 在7.4±0.2 之间,高温高压115 ℃灭菌15 min。使用的BHI固体培养基所需琼脂粉量:20 g/L。
1.2.2 人体粪便样品预处理 称取1.00 g 新鲜粪便,在超净台中加入10 mL 无菌PBS,涡旋1~3 min,以1000 r/min 离心5 min,将上清液移到无菌EP 管中,加入无菌PBS 5000 r/min 离心3 min,弃去上清液,洗涤两次并用无菌PBS 重悬沉淀。部分粪便悬浮液用于实验,其余部分加入无菌厌氧甘油(0.04% L-半胱氨酸)中,等分并储存于-80 ℃以备用[19]。
1.2.3 咖啡酸贮存液的配制 准确称取50.0 mg 咖啡酸粉末到2 mL 无菌EP 管中,加入1.0 mL 80%甲醇并倒置混合,在超净工作台中用无菌0.22 μm 滤膜过滤灭菌,以获得50 mg/mL 无菌咖啡酸储存溶液。保存在-40 ℃备用。
1.2.4 人体粪便菌的富集 取一定量粪便悬液,以5000 r/min 离心5 min,弃去上清,再用PBS 洗涤两次后,离心重悬,并按1:50 的体积比例,接种至BHI液体培养基中,然后置于厌氧罐中放在37 ℃摇床上,200 r/min,厌氧培养24 h。
1.2.5 人类粪便菌代谢咖啡酸实验
1.2.5.1 咖啡酸体外发酵实验 将29.1 mL BHI 液体培养基、300 μL 咖啡酸母液(终浓度0.5 mg/mL)和600 μL 人粪便细菌悬浮液加入到50 mL 的锥形瓶中(未加咖啡酸的人粪便细菌悬浮液作为阴性对照)。之后将混合发酵液置于厌氧罐中,37 ℃下在200 r/min 转速的振荡培养箱中避光发酵,在0、12、24、48、72 h 时采样。将每个样品以13000 r/min 离心3~5 min,然后将发酵液转移到1.5 mL EP 管中并储存在-20 ℃。动态监测在发酵过程中细菌繁殖含量(OD600)和pH 变化。
1.2.5.2 薄层层析法检测咖啡酸粪便体外发酵代谢产物 将1.2.5.1 中体外发酵培养基解冻,利用薄层色谱法定性测定咖啡酸代谢情况[20],展开剂为氯仿:甲醇:水:甲酸:冰醋酸(15:5:0.5:1:1,V/V),以浓度为0.5 mg/mL 咖啡酸、间香豆酸和5 mg/mL 3-(3-羟基苯基)丙酸为对照,在254 nm 的紫外波长显色,比较比移值(Rf 值)。如果样品的Rf 值等于咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸的标准品,则表明样品含有咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸。
1.2.6 代谢咖啡酸肠道菌分离 根据1.2.5.2 中的检测结果,将12 h 的发酵液用BHI 液体培养基稀释至10-4~10-6的梯度,于BHI 固体培养基上进行涂布,置于恒温37 ℃的培养箱中厌氧培养12 h。将培养基中不同颜色、形态和大小的菌株挑至BHI 液体培养基中,并在37 ℃下厌氧孵育12 h。将液体培养基中获得的菌株在BHI 固体培养基中重复划线,以保证得到纯度较好的菌株,同时将得到的单菌落用50%厌氧甘油保存并储存在-80 ℃的冰箱中。
1.2.7 代谢咖啡酸菌株的筛选 将分离纯化的单个细菌以1:50 的比例加入含有咖啡酸的BHI 液体培养基中,咖啡酸的终浓度为0.5 mg/mL,置于37 ℃振荡器中厌氧孵育24 h,用薄层层析法测定咖啡酸代谢情况。
1.2.8 代谢咖啡酸菌株的鉴定
1.2.8.1 形态鉴定 将1.2.7 中得到的可以代谢咖啡酸的菌株10、20 号菌进行鉴定。根据《常见细菌系统鉴定手册》[21]和《伯杰氏细菌系统分类学手册》[22]对分离出的细菌进行细菌形态鉴定。
1.2.8.2 16S rRNA 基因分子生物学鉴定,以菌株10 和20 的基因组作为PCR 扩增模板,正向和反向引物分别为8F:5'-AGAGTGATCCTGGCTCAG-3'/1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR反应(20 μL)如下:模板DNA 2 μL,KOD 酶(1 unit/μL)0.4 μL,10×KOD 缓冲液2 μL,dNTP(2 mmol/L)2 μL,引物(F+R)1.2 μL,MgSO4(25 mmol/L)1.2 μL,双蒸水(ddH2O)11.2 μL。PCR 扩增参数设置为94 ℃预变性2 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s 持续35 个循环,72 ℃再延伸2 min。将所得PCR 扩增产物进行1%琼脂糖凝胶电泳。PCR 扩增产物约为1600 bp,送往上海生工进行测序,16S rDNA 序列在NCBI 中进行BLAST 同源序列检索,可以比较筛出菌株与已知菌株的系统发育关系和系统发育状态,如果同源性大于99%,则确认它们是同一类型的细菌,并使用Mega X 软件创建系统发育树。
1.2.9 筛选菌株代谢咖啡酸能力 将10、20 号菌划线活化后接至BHI 液体培养基中,在37 ℃厌氧环境下孵育24 h,最后再按1:50(v/v)的比例加入到含有咖啡酸的BHI 液体培养基中,咖啡酸的最终浓度为0.5 mg/mL。将其置于厌氧罐中,37 ℃下进行厌氧发酵,并在发酵过程中动态监测细菌生长含量(OD600)和pH 的变化。最后通过薄层层析法和高效液相法鉴定咖啡酸的代谢产物。
1.2.9.1 发酵过程中菌株生长曲线的测定 将菌株以1:50 的比例加入到含有咖啡酸的BHI 液体培养基中,置于37 ℃摇床上厌氧培养,在0、6、12、24、48 h 取样,用紫外分光亮度计测定OD600,并在相同条件下重复实验3 次。
1.2.9.2 发酵过程中pH 测定 将菌株以1:50 的比例加入含咖啡酸的BHI 液体培养基中,置于37 ℃摇床中厌氧培养,在0、6、12、24、48 h 取样,以1:50比例接种菌株的BHI 液体培养基为对照,用pH 计测定pH,在相同条件下重复实验3 次。
1.2.9.3 发酵过程中咖啡酸代谢情况测定 用薄层层析法测定咖啡酸代谢情况,参照张学佳[23]的方法稍作修改。以氯仿:甲醇:水:甲酸:冰乙酸(15:5:0.5:1:1,V/V)为展开剂,浓度为0.5 mg/mL 的咖啡酸、间香豆酸和5 mg/mL 标准品3-(3-羟基苯基)丙酸为对照,在254 nm 的紫外波长显色,比较比移位值(Rf 值)。如果样品的Rf 值等于咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸的标准品,则表明样品含有咖啡酸,间香豆酸和3-(3-羟基苯基)丙酸。
1.2.9.4 发酵过程中咖啡酸代谢产物的测定 咖啡酸代谢产物的测定参照张砚垒[24]的方法略作修改。利用高效液相色谱法检测咖啡酸代谢产物,取2 mL 发酵液样品13000 r/min 离心2 min,取上清过0.45 μm 滤膜。高效液相色谱条件:C18色谱柱(250 mm×4.6 mm,5 μm),流动相A 为甲醇,流动相B 为0.1%甲酸,流速为0.8 mL/min;梯度洗脱表见表1,柱温20 ℃,进样量20 μL,检测波长280 nm。

表1 流动相梯度洗脱程序Table 1 Gradient elution program of mobile phase
1.3 数据处理
实验均重复三次取平均值,所有实验结果均用平均值±标准差来表示,采用Mega X 软件建立系统发育树,用统计学分析软件SPSS 进行实验结果显著性分析,Excel 2019 进行数据统计并分析,由Graph Pad Prism 8 软件进行实验数据作图。
2 结果与分析
2.1 人粪便菌群体外发酵咖啡酸动态变化
OD600可以用于评价细菌在培养基中的繁殖能力[25]。如图1A 所示,体外培养条件下,人体粪便菌群在前12 h 快速增殖,在48~72 h 之间逐渐趋于平台期。人体粪便菌群达到平台期时,菌液的OD600为0.89。当培养基中添加咖啡酸后,人体粪便菌群在前12 h 同样呈现快速增殖趋势,但是12 h 后,菌群生长速率缓慢。发酵72 h 后,人体粪便菌群的OD600为0.69,最大吸光值低于无咖啡酸添加的对照组(图1A)。结果表明,浓度为0.5 mg/mL 的咖啡酸会抑制人体粪便菌群体外增殖。
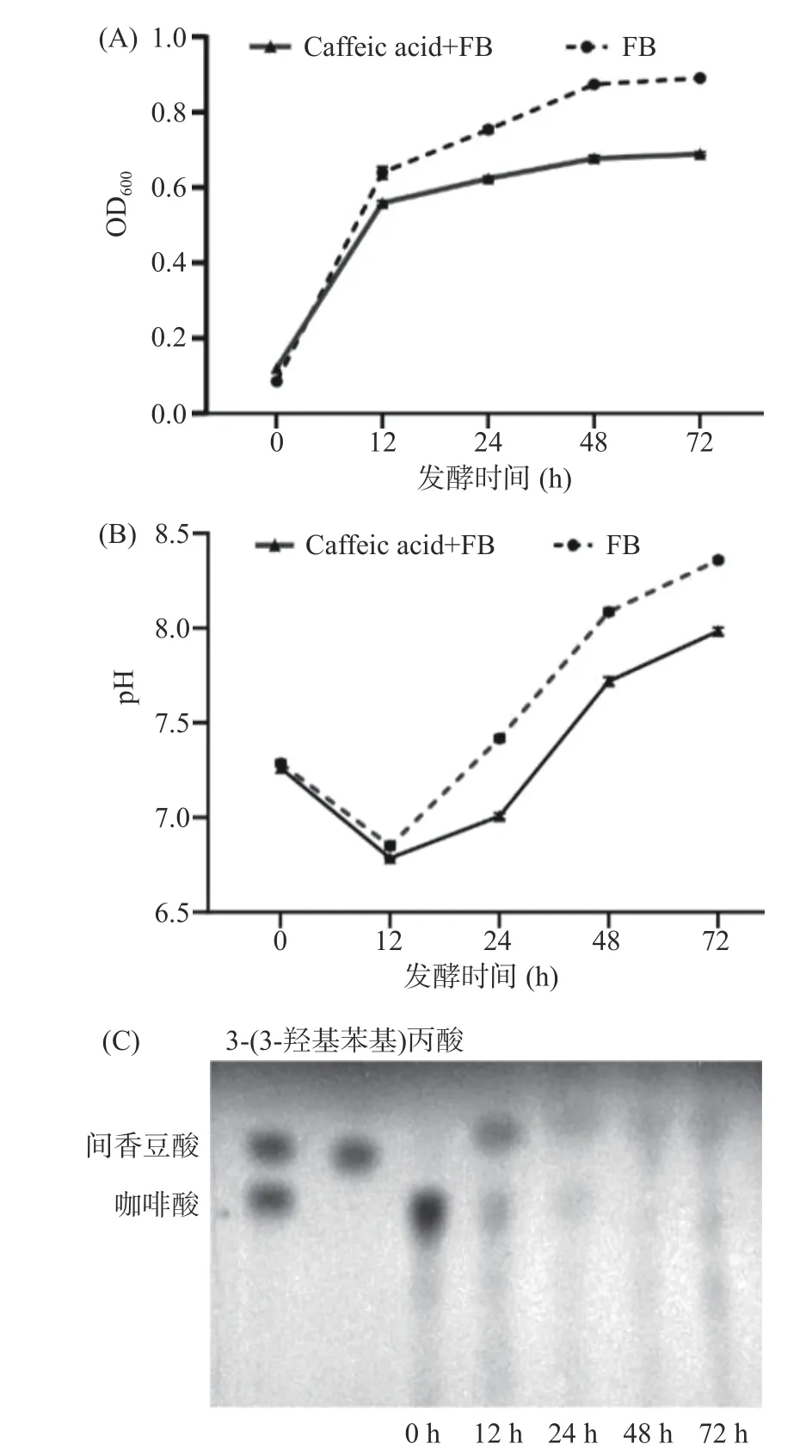
图1 肠道菌群发酵咖啡酸生长曲线和pH 动态变化Fig.1 Dynamic changes of growth curve and pH in fermentation of caffeic acid in the intestinal flora
pH 是监测微生物发酵过程的一个重要参数,因此检测了培养基pH 的动态变化[26-27]。如图1B 所示,在0~12 h,粪便菌组和粪便菌+咖啡酸组的pH都呈现下降趋势。其中,粪便菌组的pH 从7.28 下降至6.85,而粪便菌+咖啡酸组的pH 从7.26 降至6.78。从12~72 h,两组的pH 均逐渐上升。其中,粪便菌组的pH 升高至8.36,粪便菌+咖啡酸组的pH升高至7.98。然而在整个发酵过程中,粪便菌组的pH 一直比粪便菌+咖啡酸组的pH 高,和OD600的实验现象吻合,咖啡酸对人体粪便菌发酵有抑制效果,这与骆成尧等[28-29]研究结果相似。而0~12 h 出现下降的原因推测是生成了代谢产物,且代谢产物为酸性从而使pH 下降。
图1C 可以看出,咖啡酸粪便发酵液第12 h 已经开始代谢直至24 h 咖啡酸被完全代谢。代谢产物在与间香豆酸标准品相同的Rf 值处出现斑点,并且随着发酵时间的延长,颜色逐渐加深,在12 h 颜色最深,但12 h 之后颜色又逐渐减少。
2.2 参与咖啡酸代谢的肠道微生物筛选
将人类粪便菌悬液进行梯度稀释,涂布在BHI固体培养基平板上,然后再挑取26 个单克隆,接种到含有咖啡酸的液体培养基中进行发酵。厌氧发酵12 h 后,收集培养基,并利用薄层层析法分析培养液中咖啡酸及其代谢产物的改变。如图2A 和2B 所示,第10 号、20 号肠道菌可以代谢咖啡酸。
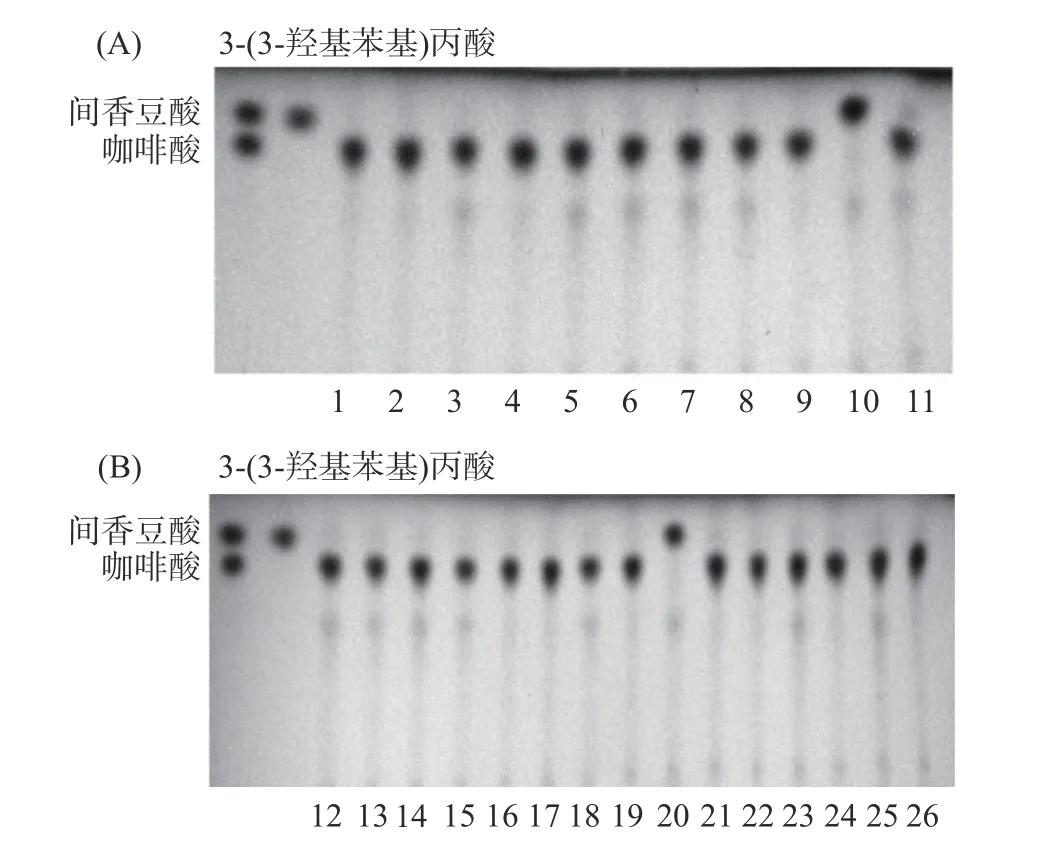
图2 参与咖啡酸代谢的肠道微生物筛选Fig.2 Screening of gut microbes involved in caffeic acid metabolism
2.3 咖啡酸代谢菌株的形态及鉴定
2.3.1 菌株形态学观察 采用梯度稀释法将10 号菌和20 号菌在BHI 固体培养基上划线。10 号菌的形态如图3A 所示。菌落呈圆形,湿润,边缘光滑,中间凸起为白色,边缘略带黄色。20 号菌的形态如图3B所示。菌落透明或半透明,灰白色,边缘整齐,中间凸起。根据菌落形态特征,初步判断两种菌株均为细菌。利用革兰氏染色初步确认了10 号菌为革兰氏阴性菌,在显微镜下成葡萄状球菌,而20 号菌为革兰氏阴性菌,在显微镜下成杆型。
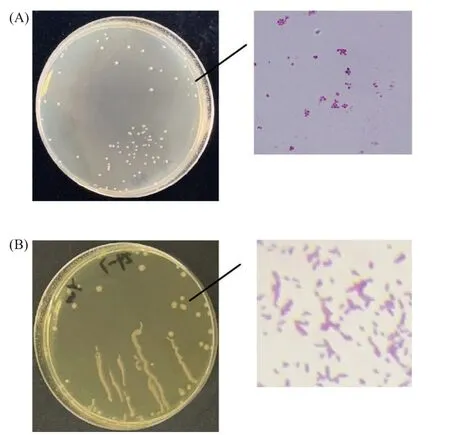
图3 菌株形态学特征Fig.3 Morphological characteristics of strains
2.3.2 分子生物学鉴定 利用引物对所提取的基因组DNA 进行扩增,所扩增的结果如图4 所示,在1500 bp 左右出现了目的条带,条带整齐,能够进行测序分析。利用Snap Gene Viewer 软件对测序序列进行拼接,借助NCBI 中的BLAST 和数据库中已知菌株的16S rRNA 基因进行序列比对,选择相似度最高的菌株来判断10 号和20 号的种属状况。结果表明,10 号菌株的16S rRNA 基因序列与数据库中已知腐生葡萄球菌的16S rRNA 基因的相似性大于99%。20 号菌株的16S rRNA 基因序列与数据库中已知奇异变形杆菌的16S rRNA 基因的相似性大于99%。为更加清楚该菌株与已知菌株的亲缘关系及分类地位,构建系统发育树,结果显示10 号菌与Staphylococcus xylosusstrain Fop 108A 和Staphylococcus xylosusstrain JCM 2418 在系统发育树聚为一支(图5A),20 号菌与Proteus mirabilisstrain ATCC 29906 在系统发育树聚为一支(图5B)。

图4 菌株16S rDNA 琼脂糖凝胶电泳图Fig.4 Strain 16S rDNA agarose gel electrophoresis

图5 菌株的系统发育树Fig.5 Phylogenetic tree of strains
2.4 肠道菌株代谢咖啡酸分析
2.4.1 菌株生长曲线和发酵液pH 变化分析 在发酵过程中监测筛选菌株代谢咖啡酸的生长情况和pH 的动态变化。如图6A 所示,腐生葡萄球菌组在前6 h 快速增殖,36 h 到达最高时,菌液的OD600为0.77。加入咖啡酸后,腐生葡萄球菌在前6 h 呈现快速增长趋势,36 h 之后到达平台期时菌液OD600为0.85。如图6C 所示,奇异变形杆菌组同样在前6 h呈现快速增长趋势,24 h 菌液OD600为0.62,36 h 突然增长达到峰值0.84 后又随着发酵时间的增加,培养基中的营养成分减少,菌株的生存能力降低。加入咖啡酸后,在24 h 到达平台期时菌液OD600为0.56,同样也在36 h 增长达到峰值0.69 后恢复到平台期。结果显示,咖啡酸抑制腐生葡萄球菌和奇异变形杆菌的体外增殖,对奇异变形杆菌的抑制效果大于腐生葡萄球菌。
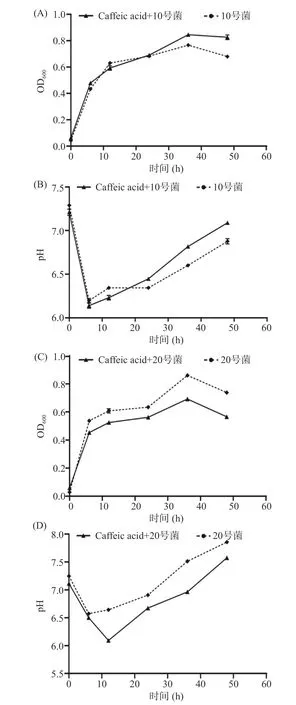
图6 代谢菌株发酵过程中不同时间点生长曲线和pH 变化Fig.6 Growth curves and pH changes at different time points during fermentation of metabolic strains
根据研究,咖啡酸会被菌株分解产生间香豆酸等代谢产物,从而导致pH 的改变,所以,pH 的变化是反应发酵过程中一项关键参数[30]。从图6B 中可以看出,腐生葡萄球菌代谢咖啡酸发酵6 h 时pH 下降至6.11,推测可能生成了酸性代谢产物,而6 h 之后pH 又出现回升直至48 h 到达7.19,可能生成的酸性代谢产物进一步代谢生成了碱性代谢产物。而图6D 中奇异变形杆菌代谢咖啡酸12 h 之后pH才出现回升直至48 h 到达7.54,推测可能奇异变形杆菌代谢咖啡酸的能力可能没有腐生葡萄球菌强。
2.4.2 菌株发酵过程中代谢产物的检测 对腐生葡萄球菌和奇异变形杆菌发酵咖啡酸不同时间的发酵液进行薄层层析检测。从图7A 可以看到,腐生葡萄球菌从6 h 开始已经将咖啡酸代谢,12 h 之后咖啡酸代谢完全,代谢产物12 h 之后也没有出现增加现象。图7B 中,奇异变形杆菌也在第6 h 就可以将咖啡酸代谢,24 h 时咖啡酸就已经代谢完全,代谢产物24 h 之后也没有出现增加的现象。但从图中可以看出,腐生葡萄球菌代谢咖啡酸的效果优于奇异变形杆菌。
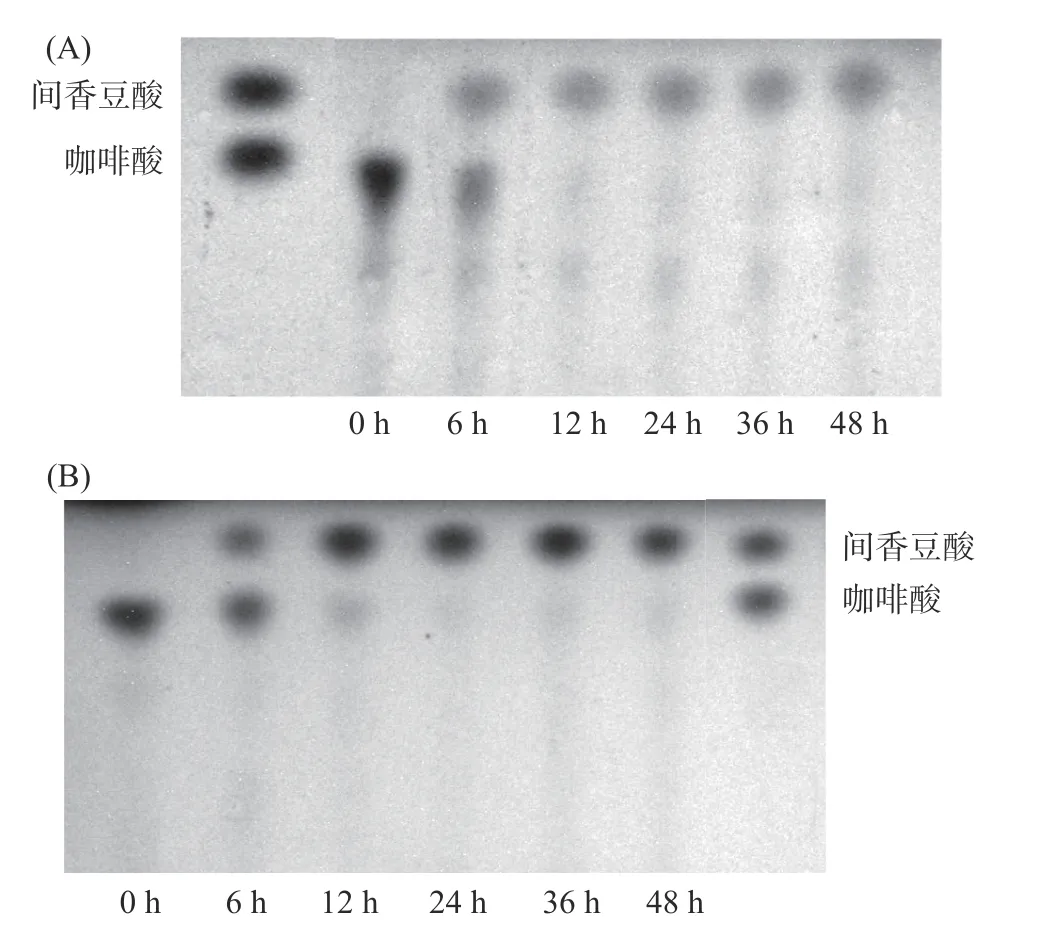
图7 代谢菌株发酵咖啡酸产物TLC 分析Fig.7 TLC analysis of fermented caffeic acid products of metabolic strains
2.4.3 菌株发酵过程中代谢产物确定 采用HPLC法更精确反映咖啡酸变化及其确定代谢产物。由图8 和图9 可知,根据三种标准品的出峰时间不同确定腐生葡萄球菌和奇异变形杆菌可以将咖啡酸代谢为间香豆酸。
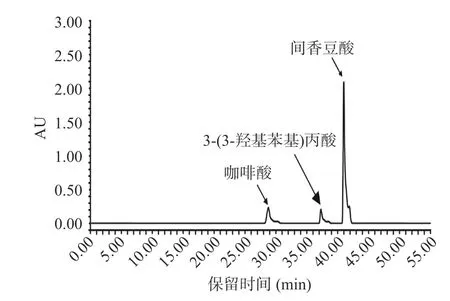
图8 咖啡酸标准品及其代谢产物标准品HPLC 图Fig.8 Caffeic acid standard and its metabolite standard HPLC diagram
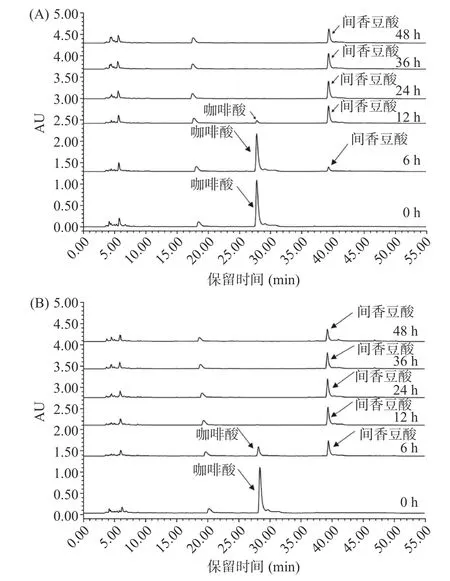
图9 菌株发酵液中咖啡酸及代谢产物HPLC 分析Fig.9 HPLC analysis of caffeic acid and metabolites in fermentation broth of strains
对HPLC 结果进行定量分析,从图10A 中看出咖啡酸6 h 含量从0.539 mg/mL 降至0.087 mg/mL,12 h 之后基本被完全代谢。图10C 中看到咖啡酸在第6 h 含量从0.543 mg/mL 降至0.352 mg/mL,第12 h 含量降至0.030 mg/mL,24 h 之后被完全代谢。从中可以看出,腐生葡萄球菌代谢咖啡酸的能力比奇异变形杆菌好。

图10 菌株发酵液中咖啡酸及代谢产物HPLC 定量分析Fig.10 Quantitative analysis of caffeic acid and metabolites in fermentation broth of strains by HPLC
代谢产物间香豆酸的变化可以从图10B 中看出,腐生葡萄球菌发酵咖啡酸第6 h 间香豆酸生成,第12 h 间香豆酸浓度达到峰值0.045 mg/mL,12 h之后间香豆酸含量开始降低,直至48 h 降至0.029 mg/mL。奇异变形杆菌发酵咖啡酸从图10D 中可以看到间香豆酸从第6 h 开始生成,第24 h 浓度达到峰值0.044 mg/mL,24 h 之后间香豆酸含量开始降低,直至48 h 为0.035 mg/mL。可以看出腐生葡萄球菌代谢咖啡酸的能力优于奇异变形杆菌,但是两株菌代谢的间香豆酸都在24 h 后逐渐降低,推测间香豆酸有可能进一步代谢生成了其它代谢产物。
通过薄层层析法和高效液相色谱法检测可以看到腐生葡萄球菌和奇异变形杆菌在代谢咖啡酸过程中代谢产物为间香豆酸。这与魏玲[31]的研究相同,在大鼠体内代谢咖啡酸产物中检测出13 种代谢产物中就有间香豆酸。腐生葡萄球菌和奇异变形杆菌在自然界中广泛存在,具有丰富的生物学功能,周华书[32]和闫建英等[33]只对其安全性和耐药性进行研究并未研究其它药用作用。本实验通过对其代谢途径进行研究为两株菌以及咖啡酸新的研究方向奠定了基础。
3 结论
本研究通过对人体粪便样品中分离出两株肠道单菌各项指标的检测,发现随着发酵过程的进行,咖啡酸代谢为间香豆酸,间香豆酸又进一步代谢生成其他酚酸类化合物导致pH 呈现先下降后上升趋势。发酵12 h 后,咖啡酸被腐生葡萄球菌完全代谢,同时在发酵12 h 时,间香豆酸浓度达到峰值0.045 mg/mL;而奇异变形杆菌在发酵24 h 后完全代谢咖啡酸,间香豆酸的浓度在发酵24 h 达到峰值0.044 mg/mL。综上,咖啡酸抑制了肠道菌的增殖,人肠道来源的腐生葡萄球菌和奇异变形杆菌可代谢咖啡酸,且腐生葡萄球菌代谢能力优于奇异变形杆菌,对咖啡酸在肠道微生物作用下代谢机制的研究具有指导意义,但详细的机制还需要进一步研究。

