薏苡附子败酱散通过调控NF-κB 信号通路对结肠炎癌转化模型小鼠结肠癌发生的影响
杨利梅,张影茹,于 浩,朱惠蓉,2*,王 炎*
(1.上海中医药大学附属曙光医院肿瘤研究所,上海 201203; 2.上海中医药大学附属曙光医院肿瘤科,上海 201203)
结直肠癌(colorectal cancer,CRC)是全球发病率第三、死亡率第二的恶性肿瘤。2018 年,我国结直肠癌新发病例51.83 万例[1]。炎症性肠病 (inflammatory bowel disease,IBD)是结肠癌发展的重要危险因素[2-3],“炎症-异常隐窝-腺瘤-癌症” 是结肠炎相关结直肠癌发生的基本路径,促炎细胞因子通过激活促生存和增殖途径加速肿瘤的发生和发展[4-5],因此,控制“炎-癌转化” 对防治CRC意义重大。“既病防变” 是中医药治疗疾病的重要思想理论,结肠炎癌转化具有起病缓、病程长的特点,因而对肠道炎症迁延阶段进行早期干预是抑制肠炎发展为肠道实体瘤形成的重要方法[6]。
薏苡附子败酱散出自《金匮要略》,是治疗肠痈的代表方。当代医家多用此方治疗消化道慢性炎症性疾病[7]。课题组前期研究发现,薏苡附子败酱散可以预防炎症相关结肠癌的发生,并从肠道微生物群和免疫等方面对其机制进行了研究[8-9]。目前许多研究发现,中药可以调节IL-5、IL-6、IL-17、IL-10、IL-2 和IFN-γ 等炎性因子的表达[10-11],同时NF-κB 作为可以被炎性介质激活致癌的转录因子,在连接炎症和致癌作用方面起关键作用,许多天然药物可以通过抑制NF-κB 信号通路活化抑制癌变[12-13]。因此,本研究将从炎性微环境角度对薏苡附子败酱散干预结肠癌的作用进行验证,并从NF-κB 信号通路探讨薏苡附子败酱散预防结肠癌发生的机制。
1 材料
1.1 动物 72 只SPF 级C57BL/6J 雌性小鼠,6 ~8 周龄,体质量16 ~18 g,购自上海吉辉实验动物饲养有限公司[实验动物生产许可证号SCXK (沪)2017-0012],饲养于上海中医药大学实验动物中心,饲养室恒温20~22 ℃,相对湿度45% ~70%,光照周期12 h,自由饮食,适应性饲养1 周后进行实验。各项实验操作均严格遵守上海中医药大学实验动物伦理委员会的相关规定 (伦理号PZSHUTCM210528005)。
1.2 药物 苡附子败酱散由薏苡仁30 g (批号210608)、附子6 g (批号210414)、败酱草15 g (批号210201)组成,购自上海中医药大学附属曙光医院药房。药材先用清水浸泡30 min,大火煮沸后小火煎煮40 min,过滤,药渣再加水2 次煎煮40 min,过滤,合并2 次药液,蒸发浓缩至约150 mL,配制成质量浓度为0.386、0.774、1.547 g/mL的药液(按每只小鼠20 g 计算给药量,每天每只小鼠给药0.2 mL),用50 mL 离心管分装后于-20 ℃冰箱保存,使用前4 h 于4 ℃冰箱中解冻,每2 周配制1 次新鲜药液。阿司匹林肠溶片(批号J20171021)购自德国拜耳公司,取600 mg 阿司匹林肠溶片捣碎成粉末状,加入100 mL 纯水和100 mL 1%CMC-Na,使用涡旋振荡仪振荡混匀,配制成3 mg/mL 的阿司匹林溶液(根据阿司匹林人临床用量每天200 mg 和人鼠剂量系数9.1 换算得到),于-4 ℃下保存。
1.3 试剂 氧化偶氮甲烷 (azomethane,Aom,货号A5486,美国 Sigma 公司); 2.5% 葡聚糖硫酸钠(dextransulfatesodium,DSS,货号 9011-18-1,美国 MP Biomedicals 公司); 0.9% 氯化钠(批号H20023146,华仁药业股份有限公司); IKB、p-IKBα、NF-κB p65 一抗(货号4814S、2859S、3033S,美国CST 公司); IL-5、IL-6、IL-10、IL-17、IL-2、γ 干扰素(IFN-γ)ELISA 试剂盒(货号MEI020S、MEI021、MEI025、MEI029、MEI016、MEI004,上海博谷生物科技有限公司)。
2 方法
2.1 分组、造模及给药 小鼠按随机数字表法分成空白组、模型组、阿司匹林组和薏苡附子败酱散低、中、高剂量组,每组12 只,除空白组外,其余各组小鼠一次性腹腔注射诱变剂Aom (10 mg/kg)。正常饮水1 周后,给予2.5% DSS 连续饮用7 d (每2 d 更换1 次新鲜的DSS),继续恢复正常饮水2 周,以此为1 个DSS 周期,共进行3 个DSS 周期循环[14-15]。从给予DSS 饮用的第1 天开始药物干预,薏苡附子败酱散低、中、高剂量组灌胃给予3.87、7.74、15.47 g/kg 药液0.2 mL (根据薏苡附子败酱散临床成人的有效剂量每天0.85 g/kg 和人鼠剂量系数9.1 换算得到剂量为7.74 g/kg,设为中剂量,以中剂量的0.5、2 倍为低、高剂量,即3.87、15.47 g/kg); 阿司匹林组给予30 mg/kg 阿司匹林溶液0.4 mL; 模型组给予0.2 mL 等体积纯水,每天1 次,连续12 周。
2.2 小鼠一般情况和DAI 评分 实验过程中隔天观察并记录小鼠的一般状态、毛发光泽、活动情况、大便性状等,每2 d 称量1 次体质量,通过体质量下降百分率、大便性状分数、便血分数3 项指标进行进行DAI 评分[16],评分标准见表1。

表1 DAI 评分标准
2.3 样本采集和脾脏指数计算 给药结束后,采集小鼠血液样本并制备血清,用于血清炎性因子检测; 采集结肠组织样本,观察记录结肠组织大体形态,拍照并记录大肠内肿瘤数目、大小、结肠长度和脾脏状态; 结肠组织一部分于-80 ℃冰箱中保存,用于Western blot 实验; 另一部分于4%多聚甲醛中固定,用于HE 染色; 采集脾脏样本,计算脾脏指数,公式为脾脏指数=脾脏质量/体质量×10。
2.4 HE 染色观察结肠组织病理变化并进行组织学评分取固定于4%多聚甲醛中的结肠组织,经常规脱水、石蜡包埋、切片(4 μm),二甲苯透明,乙醇梯度脱水后,按照HE 试剂盒说明书进行HE 染色,中性树胶封片,于光学显微镜下观察结肠黏膜组织形态,并根据炎症、肉芽肿、溃疡、纤维化、病变深度、上皮内瘤变情况进行评分[17-19],无溃疡、无炎症、无肉芽肿、无纤维化、无病变,为0 分;小溃疡<3 mm、轻度炎症、有肉芽肿、病变局限于黏膜下层,为1 分; 大溃疡≥3 mm、重度炎症、病变深度达肌层、重度纤维化,为2 分。
2.5 炎性因子水平检测 按照试剂盒说明书,采用ELISA法检测血清炎性因子IL-5、IL-6、IL-17、IL-10、IL-2、IFNγ 水平。
2.6 Western blot 法检测NF-κB p65、IKB-α 蛋白表达 取结肠部位肿瘤组织,提取总蛋白,采用BCA 试剂盒检测蛋白浓度,加入5×loading buffer,100 ℃煮沸10 min 使蛋白变性。采用SDS-PAGE 凝胶电泳,再将蛋白转至PVDF 膜上,5% BSA 室温封闭2 h,加稀释后的一抗NF-κB p65、IKBα、p-IKB-α 及GAPDH,4 ℃冰箱孵育过夜,TBST 洗涤后,加稀释后的HRP-山羊抗兔IgG 孵育2 h,TBST 洗涤后,使用超敏ECL 化学发光试剂盒,通过凝胶成像系统对蛋白印迹进行显影,通过Image J 软件分析蛋白条带灰度值,以目的蛋白条带灰度值/GAPDH 条带灰度值为目的蛋白的相对表达量。
2.7 统计学分析 通过SPSS 23.0 软件进行处理,计量资料以(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 表示差异有统计学意义。
3 结果
3.1 薏苡附子败酱散对小鼠一般情况的影响 模型组小鼠在饮用DSS 期间均出现不同程度的消瘦、蜷缩、动作迟缓、腹泻、便血、脱肛等症状,更换正常饮用水后逐渐缓解,但总体症状随造模时间逐渐加重; 薏苡附子败酱散组小鼠在饮用DSS 期间一般状态优于模型组,且停饮后精神状态、体质量、腹泻等情况恢复更快。
3.2 薏苡附子败酱散对小鼠DAI 评分、体质量和生存率的影响 空白组小鼠体质量平稳增长,其余各组小鼠体质量均随着DSS 的摄入持续下降,在停药后1 周左右逐渐恢复正常水平,与模型组比较,薏苡附子败酱散组小鼠体质量下降较少,且恢复较快,见图1A。第13 周末对各组小鼠疾病活动指数进行评分,模型组小鼠DAI 评分高于空白组,而薏苡附子败酱散各剂量组DAI 评分低于模型组,其中高剂量组最低(P<0.01),见图1B。模型组生存率较空白组降低,实验结束时12 只小鼠只存活5 只; 薏苡附子败酱散干预后小鼠生存率高于模型组,其中高剂量组(存活9 只)生存率最高且高于阿司匹林组(存活7 只),实验结束时,薏苡附子败酱散中、低剂量组分别存活8 只和6 只,见图1C。
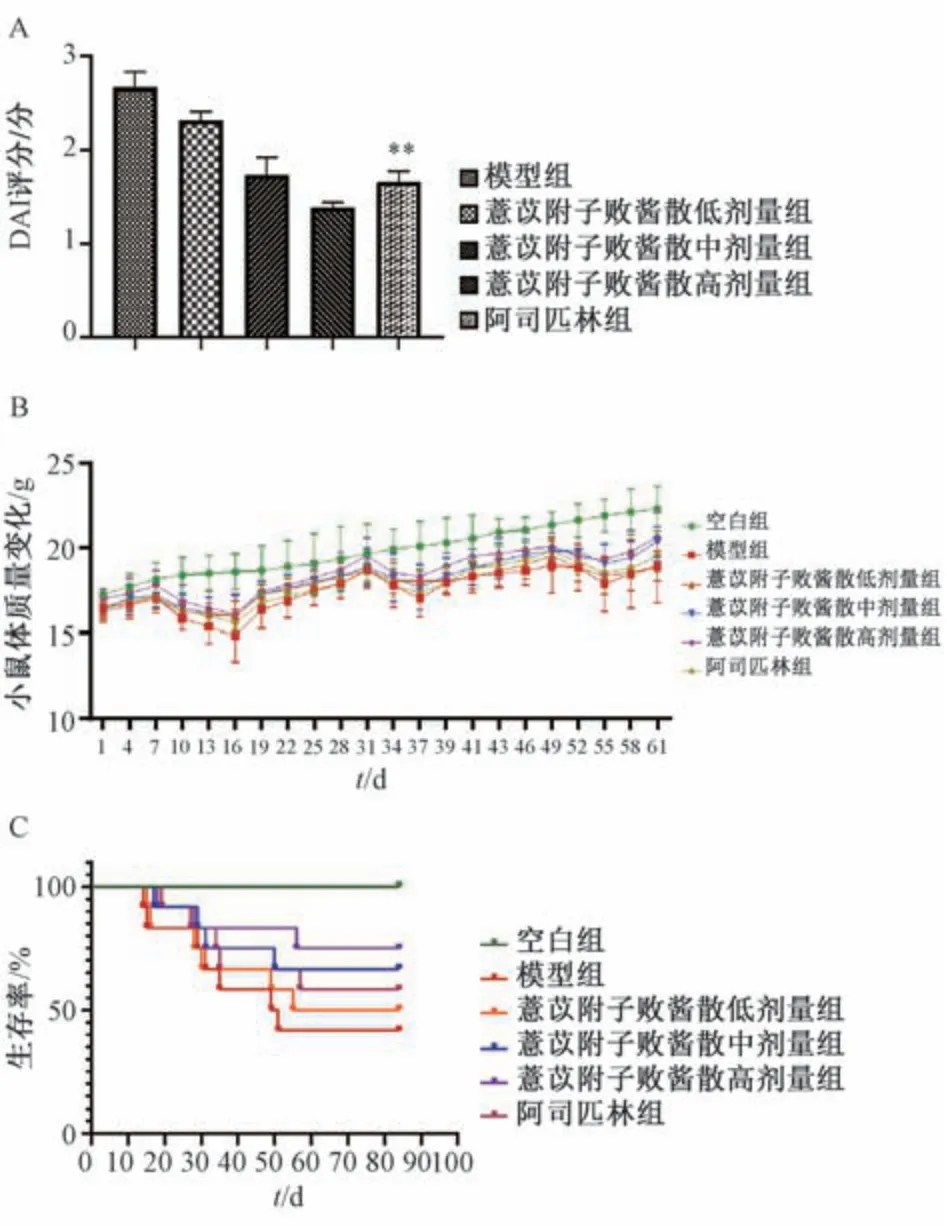
图1 薏苡附子败酱散对小鼠DAI 评分、体质量和生存率的影响(±s,n=5)
3.3 薏苡附子败酱散对小鼠成瘤率、结肠长度和脾脏指数的影响 与空白组比较,模型组小鼠结肠出现瘤体; 与模型组比较,薏苡附子败酱散中、高剂量组和阿司匹林组结肠组织中肿瘤数量减少(P<0.01),其中高剂量组效果最好(P<0.01),见图2A~2B。与空白组比较,模型组脾脏指数降低(P<0.01); 与模型组比较,薏苡附子败酱散各剂量组和阿司匹林组脾脏指数均升高(P<0.01),见图2C。与空白组比较,模型组结肠长度缩短(P<0.05); 与模型组比较,薏苡附子败酱散各剂量组和阿司匹林组结肠长度均增长(P<0.05,P<0.01),见图2D。以上结果表明,薏苡附子败酱散可以预防结直肠腺瘤的发生。

图2 薏苡附子败酱散对小鼠成瘤率、结肠长度和脾脏指数的影响(±s,n=5)
3.4 薏苡附子败酱散对小鼠结肠组织病理学的影响 如图3 所示,空白组小鼠结肠黏膜组织结构完整,腺体排列规整,可见隐窝与杯状细胞,黏膜下层无充血与水肿,未见病变及炎症现象; 与空白组比较,模型组结肠组织可见黏膜上皮部分缺损,腺体结构紊乱或消失,大量炎性细胞浸润,且肌层纤维化明显,隐窝分支不规则,肿瘤恶性程度高; 与模型组比较,阿司匹林组结肠组织结构部分紊乱,部分腺体遭到破坏,可见少量炎性细胞,病理组织学评分降低(P<0.01); 薏苡附子败酱散各剂量组结肠肌层稍见增厚,隐窝腔较为完整,杯状细胞明显,炎性程度和肿瘤恶性程度减轻,病理组织学评分降低(P<0.05,P<0.01),其中高剂量组改善效果最好。

图3 薏苡附子败酱散对小鼠结肠组织病理学的影响(x±s,n=5)
3.5 薏苡附子败酱散对小鼠血清炎性因子水平的影响 如图4 所示,与空白组比较,模型组血清促炎因子IL-17 水平升高(P<0.05),促炎因子IL-5、IL-6 水平升高,但差异无统计学意义(P>0.05),抑炎因子IL-2 水平降低(P<0.05),IL-10、IFN-γ 水平降低,但差异无统计学意义(P>0.05); 与模型组比较,薏苡附子败酱散低剂量组血清IL-5水平降低(P<0.05),薏苡附子败酱散中剂量组血清IL-5、IL-6、IL-17 水平降低 (P<0.05),IL-10 水平升高 (P<0.05),薏苡附子败酱散高剂量组血清IL-5、IL-6、IL-17 水平降低(P<0.05,P<0.01),IL-2、IL-10、IFN-γ 水平升高(P<0.05,P<0.01),阿司匹林组血清IL-5、IL-6 水平降低(P<0.05,P<0.01)。
3.6 薏苡附子败酱散对小鼠结肠肿瘤组织NF-κB 信号通路相关蛋白表达的影响 如图5 所示,与模型组比较,薏苡附子败酱散各剂量组和阿司匹林组大鼠结肠肿瘤组织NFκB p65、IKBα 和p-IKBα 蛋白表达降低 (P<0.05,P<0.01)。
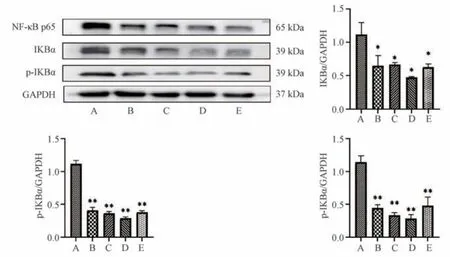
图5 薏苡附子败酱散对小鼠结肠肿瘤组织NF-κB 信号通路相关蛋白表达的影响(±s,n=5)
4 讨论
本研究发现各剂量薏苡附子败酱散均能不同程度地改善小鼠的一般状态,降低DAI 评分,减轻结肠黏膜水肿、充血、炎症、溃疡等损伤,降低结肠长度缩短程度,升高脾脏指数,在数量和大小上减少结直肠腺瘤发生,在组织病理学层面,薏苡附子败酱散组小鼠结肠组织隐窝腔较为完整,杯状细胞明显,炎性程度和肿瘤恶性程度低于模型组,其中高剂量组改善效果最好,表明薏苡附子败酱散对结肠癌发生具有抑制作用。
由于炎性肠癌与炎症反应有着密切的相关性[20-21],本研究对小鼠血清多种炎性相关细胞因子进行检测。IL-6 是炎症性肠病发展过程中的一种核心促炎细胞因子,也是炎性疾病严重程度和预后指标的生物标记物[22-25]。IL-17 是T细胞诱导的炎症反应的早期启动因子,通过促进T 细胞的激活和刺激上皮细胞、内皮细胞、成纤维细胞产生IL-6、IL-8 等多种炎性细胞因子来放大炎性反应,促进炎癌转化[26-28]。IL-10 是一种抗炎与免疫抑制性细胞,可以抑制多种炎性介质释放及促炎细胞因子分泌,发挥免疫调节作用[29]。IL-2 是一种抑炎因子,具有活化T 细胞,刺激NK细胞增殖,促进B 细胞增殖和分泌抗体等作用[30]。IFN-γ具有增强巨噬细胞抗肿瘤活性功能[31]。本研究发现,薏苡附子败酱散能降低血清促炎细胞因子IL-5、IL-6、IL-17 水平,升高抑炎因子IL-10、IL-2、IFN-γ 水平,表明薏苡附子败酱散可以通过调节结肠癌小鼠体内炎性因子水平,减轻炎症反应,促进机体恢复。
NF-κB 作为炎性介质激活致癌转录因子,在促进炎癌转化过程中发挥关键作用,目前研究发现,在IBD 和CRC患者的巨噬细胞和上皮细胞中均可以检测到活化的NF-κB,NF-κB 的活化可以促进炎症因子释放,而释放的炎症因子又可反过来促进NF-κB 活化,形成正反馈过程,导致炎症不断放大加深,进而恶化为肿瘤。IKB 作为NF-κB 家族的抑制因子,通过从NF-κB 复合体中解离并降解,暴露NFκB 的核定位序列,使NF-κB 发生核易位,并与特异的KB序列结合来促进NF-κB 的激活[32]。本研究发现,薏苡附子败酱散可以降低NF-κB p65、IKBα 和p-IKBα 蛋白表达,其中高剂量组降低最为明显,表明薏苡附子败酱散可能通过抑制NF-κB 信号通路的激活,对结肠炎癌转化模型小鼠结肠组织炎症起到抑制作用。
综上所述,薏苡附子败酱散具有预防Aom/DSS 致结肠炎癌转化模型小鼠肿瘤生长的作用,其机制可能是通过对炎性细胞因子水平的调节,降低NF-κB 信号通路相关蛋白表达,从而降低NF-κB 信号过度激活引起的炎症反应,减缓炎癌转化进程,预防结肠癌的发生。

