汉黄芩素在骨关节炎中的药理作用及其机制的研究进展
段 航,王林华,邝高艳,卢 敏
(1.湖南中医药大学第一中医临床学院,湖南 长沙 410208; 2.湖南中医药大学第一附属医院,湖南 长沙 410007)
骨关节炎(Osteoarthritis,OA)是指由于关节或关节周围组织异常引起的关节应力失衡从而导致关节损伤的一种全关节慢性退行性疾病[1],常见于中老年患者,表现为关节软骨发生缓慢的、进行性的、不可逆性的破坏,其病理生理学复杂,不仅表现为关节软骨变性,还表现为关节软骨下骨和关节滑膜液的改变[2-3]。从分子水平上分析,其主要是由于软骨细胞合成和分解代谢途径之间失衡而改变其原有的代谢稳态[4],早期的临床表现为局部症状,包括疼痛、僵硬、关节活动减少和肌肉无力,长期发展可能引起全身症状,包括身体机能退化、睡眠受损、疲劳及抑郁,严重者甚至出现功能障碍。骨关节炎的发病机制尚不明确,故目前暂无有效的治疗方案,患者首选的治疗方案是非手术治疗,包括健康宣教、运动治疗、体重管理、口服药物治疗、中医药治疗等[5-6],只有在一线和二线治疗方案失效后才考虑手术治疗,但昂贵的关节置换手术使得许多患者望而生畏。研究证实黄芩的有效提取物汉黄芩素能够通过多个途径抑制氧化应激、炎症反应和软骨细胞基质的降解,有望成为治疗骨关节炎的补充及替代疗法[7]。核因子(红血球来源2)样2 [nuclear factor (erythroid-derived 2)-like 2,Nrf2]是一种氧化还原敏感的转录因子,通过细胞保护基因来调节抗氧化防御系统,以响应亲电和氧化应激[8]。最近一项研究表明,Nrf2 的激活对骨关节炎有保护作用,Nrf2/ARE 信号通络的激活能够保护机体免受各种炎症刺激和氧化应激相关疾病的侵袭[9]。本文通过分析国内外文献,对汉黄芩素作用于ROS/ERK/Nrf2 信号通路干预骨关节炎的研究进展作一综述,以期为汉黄芩素在骨关节炎治疗中的进一步研究及开发应用提供参考。
1 汉黄芩素的概述
汉黄芩素(5,7-二羟基-8-甲氧基-2-苯基-4H-1-苯并呋喃-4-酮)是从唇形科植物黄芩ScutellariabaicalensisGeorgi、滇黄芩SratellaruaamoenaC.H.Wright、半枝莲Scutellaria barbataDon 的根及夹竹桃科植物鳝藤(神葛)Anodendron affine(Hook.et Arn.)Druce 茎中提取的天然黄酮类化合物,主要来源是中药黄芩。黄芩作为临床运用最广泛的中草药之一,属于清热解毒类中药,一般以根入药,被广泛用于治疗炎性疾病、过敏性疾病、呼吸道和胃肠道的细菌和病毒感染及肿瘤疾病[10]。研究证实从黄芩根提取物的主要生物活性成分为黄芩苷、黄芩素、汉黄芩素[11],目前已被证实能抑制大鼠肝脏的脂质过氧化、减轻心肌细胞的氧化应激、抑制NF-κB 信号通路、激活人结肠癌细胞和人单核细胞的Nrf2 信号通路来抑制炎症相关的结直肠癌发生[12-13]。近年来,黄芩与儿茶的天然混合物被广泛用于缓解膝骨关节炎相关的关节症状不适[14-15],黄芩的活性成分黄芩素和汉黄芩素能够抑制炎症反应,其抗炎作用是通过抑制诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)和环氧化酶-2 (cyclooxygenase-2,COX-2)的表达来介导的[16-17]。此外,Park 等[18]采用骨关节炎软骨细胞检测汉黄芩素的抗炎和软骨保护作用的研究结果表明,汉黄芩素能降低炎性因子水平并抑制兔关节软骨细胞中MMP-3 蛋白的表达。Khan 等[19]通过HPLC 和串联质谱技术对黄芩进行了系统、全面的分析,结果表明黄芩发挥抗炎及抗氧化最有效的成分之一是汉黄芩素,并针对汉黄芩素进行了体内及体外实验,体内实验结果表明汉黄芩素能抑制白介素1β(iinterleukin-1β,IL-1β)诱导的氧化应激、炎症反应和人骨关节炎软骨细胞的基质降解,体外实验证实了汉黄芩素能抑制IL-1β 诱导的丝裂原活化蛋白激酶 (mitogen activated protein kinase,MAPK)、转录因子NF-κB 和激活因子蛋白-1 (activator protein-1,AP-1)的激活。通过上述实验结果表明汉黄芩素能调控骨关节炎在内的多种疾病的氧化应激,对多种炎性疾病均具有治疗作用,具有广阔的开发应用前景。
2 白介素-1β 在骨关节炎中的作用
白介素-1β 是一种促炎细胞因子,由关节组织的细胞产生,包括软骨细胞,具有多种化学和生物活性特征,在骨关节炎发病中起关键作用,是多种骨关节炎分解因子的有效诱导剂,包括基质降解金属蛋白酶 ( matrix metalloproteinase,MMPs)和聚集酶。骨关节炎中的软骨降解是由基质降解蛋白酶和聚集酶的过量产生破坏代谢稳态所致,特别是MMP-3 能降解关节软骨中的蛋白多糖并激活前胶原酶,已被报道能降解细胞外基质的成分如蛋白聚糖,在骨关节炎中发挥重要的病理生理作用[4]。IL-1β 还能够诱导白介素6 (iinterleukin-6,IL-6)、COX-2、前列腺素E2(prostaglandin E2,PGE2)、iNOS、一氧化氮(nitric oxide,NO)等炎症介质的表达和产生,这些炎性介质的表达和产生都与骨关节炎发病有关[20-22]。此外,IL-1β 主要由IL-1β的前体(pro-IL-1β)产生,必须通过剪切产生成熟和活跃的细胞因子IL-1β 才能产生病理学效应。负责这种卵裂的细胞内酶是caspase-1,缺乏caspase-1 的动物没有成熟的IL-1β。IL-1β 的生物学效应可被其天然抑制剂IL-1 受体拮抗剂(IL-1Ra)和IL-1 诱骗受体(IL-1RⅡ)所抑制,IL-1诱骗受体可以结合IL-1β 而不传递信号[23]。IL-1β 一旦与其Ⅰ型受体(IL-1RⅠ)结合,可启动多个信号转导通路,使得细胞内Ca2+增加,PKC、p38、ERK1/2 和JNK 被激活,核因子-κB (NF-κB)、活化转录因子(ATF)和活化蛋白1(AP1)发生核转运。IL-1β 在关节内的表达增加及与受体IL-1RⅠ的相互作用可导致一系列分子效应,每种分子效应都在一定程度上参与了骨关节炎的发病过程[24]。因此,降低局部IL-1β 水平,阻断其特异性受体或阻断其信号转导具有重要的临床价值。
3 汉黄芩素对IL-1β 诱导骨关节炎软骨细胞的保护作用
3.1 汉黄芩素抑制IL-1β 诱导的骨关节炎软骨细胞炎症介质的表达和产生 炎症现在已经成为骨关节炎发病的重要介质,因为在骨关节炎关节中发现了高水平的炎症因子,如IL-1β、肿瘤坏死因子-α (tumor necrosis factor-α,TNFα)和IL-6。IL-1β 是参与骨关节炎发病的关键细胞因子,能够刺激其他炎症介质的表达[25]。多种炎症介质,如IL-6和COX-2 的释放引起的炎症被认为是骨关节炎发病机制的重要组成部分[26]。研究表明黄芩水提物能抑制脂多糖(lipopolysaccharide,LPS)刺激兔软骨细胞培养液上清中IL-6、COX-2 和iNOS 的分泌以及PGE2、NO 的产生[27]。Khan 等[19]研究汉黄芩素对IL-1β 诱导的骨关节炎软骨细胞IL-6、COX-2 表达的影响,结果显示汉黄芩素能够抑制IL-1β 诱导骨关节炎软骨细胞中IL-6、COX-2 基因和蛋白表达,此外,检测中还发现汉黄芩素完全阻断了IL-1β 刺激骨关节炎软骨细胞培养上清液中IL-6 的分泌,这表明汉黄芩素能抑制骨关节炎软骨细胞炎性因子的表达。COX-2 通过产生前列腺素(PGE2)发挥炎症作用,而PGE2在骨关节炎软骨细胞中抑制蛋白多糖合成和刺激基质降解方面发挥着重要的作用。因此,Attur 等[28]检测了汉黄芩素对IL-1β 诱导的PGE2产生的影响,结果显示,经IL-1β 处理后,骨关节炎软骨细胞PGE2表达显著增加,使用汉黄芩素预处理的骨关节炎软骨细胞PGE2表达被显著抑制。沈晓庆等[29]研究汉黄芩素治疗胶原诱导性关节炎 (collagen induced arthritis,CIA)大鼠的作用机制,发现汉黄芩素降低IL-1β、TNF-α 及白介素-18 (iinterleukin-18,IL-18)的水平; 也能降低核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)、pro-caspase-1 及caspase-1 蛋白表达,提示汉黄芩素可能是通过抑制NLRP3炎症小体介导的炎症反应以改善胶原诱导的关节炎。上述的研究结果提示汉黄芩素可能是通过抑制IL-6、TNF-α、IL-18、COX-2 等炎症介质的表达和PGE2的水平来阻断IL-1β 诱导的炎症反应,从而发挥抗炎作用。
3.2 汉黄芩素抑制IL-1β 诱导的骨关节炎软骨细胞的氧化和亚硝化应激 研究表明,过量活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS),如NO 引起的氧化和亚硝化应激激活细胞内信号传导过程,导致软骨细胞凋亡和细胞外基质 (extracellular matrix,ECM)降解,从而在骨关节炎进展中发挥重要作用[30]。Kimura 等[31]为确定汉黄芩素对IL-1β 诱导的氧化应激的影响,通过检测骨关节炎软骨细胞中ROS 的水平来观察细胞氧化还原状态,发现经IL-1β 处理骨关节炎软骨细胞的氧化敏感染料(dihydrorhodamine,DHR)荧光的表达升高。这一实验结果显示IL-1β 能诱导骨关节炎软骨细胞ROS 水平升高,相较来看,经汉黄芩素预处理的组别,ROS 水平降低,实验结果表明汉黄芩素对IL-1β 诱导的骨关节炎软骨细胞的ROS 生成具有抑制作用,这也证实汉黄芩素有效的抑制了IL-1β 诱导的氧化应激。王慧莲等[32]也证实汉黄芩素可通过激活p38 MAPK 信号通路以诱导类风湿关节炎成纤维样滑膜细胞的增殖,增加其凋亡及ROS 水平,并呈现剂量依赖性。细胞的氧化还原状态是由细胞ROS 和还原物质谷胱甘肽(glutathione,GSH)水平之间的平衡维持的,GSH 是最丰富的硫醇抗氧化剂,负责解毒ROS,这一过程也消耗GSH[33],因此,汉黄芩素在抑制IL-1β 诱导软骨细胞的ROS 生成时,GSH 水平也应该会随之降低。有研究团队基于荧光检测方法检测了软骨细胞GSH 水平,结果显示汉黄芩素处理骨关节炎软骨细胞后,GSH 水平呈剂量依赖性地降低。这些结果表明汉黄芩素通过抑制ROS 的产生来调节骨关节炎软骨细胞的氧化还原状态,从而降低细胞GSH 水平[19]。
为研究汉黄芩素对IL-1β 介导的亚硝化应激的影响,Akhtar 等[34]检测了IL-1β 处理的软骨细胞培养上清液中NO的产生情况,实验结果表明经过IL-1β 刺激的骨关节炎软骨细胞的NO 分泌增加,使用汉黄芩素预处理的骨关节炎软骨细胞,NO 完全不分泌,这表明汉黄芩素抑制了亚硝化应激。NO 是由诱导型iNOS 催化底物精氨酸氨基上的N 与分子氧结合生成,该酶在骨关节炎软骨细胞中受炎症细胞因子IL-1β 调控[35]。Khan 等[19]通过研究汉黄芩素对IL-1β诱导的骨关节炎软骨细胞iNOS 表达的影响,结果显示在IL-1β 处理的骨关节炎软骨细胞中,iNOSmRNA 的基因表达比对照组骨关节炎软骨细胞高数百倍,而汉黄芩素预处理则显著抑制了iNOSmRNA 表达,这种表现在iNOS 蛋白表达的结果上也得到了印证。上述的研究表明,汉黄芩素可通过抑制骨关节炎软骨细胞中iNOS 的表达和ROS、RNS的产生,进而有效抑制IL-1β 诱导的氧化应激和亚硝化应激。
3.3 汉黄芩素抑制IL-1β 诱导的骨关节炎软骨细胞的基质降解 由基质降解酶如聚集酶和金属蛋白酶激活引起的基质降解是骨关节炎发病的主要机制之一[36]。MMP-13、MMP-3、MMP-9 和含凝血酶敏感蛋白模体的解整合素样金属蛋 白 酶 ( A disintegrin and metalloprotease with thrombospondin motifs-4,ADAMTS-4)是软骨细胞对IL-1β的反应产生的主要胶原酶,有助于骨关节炎的发病[37]。Khan 等[19]研究了汉黄芩素对人骨关节炎软骨细胞中IL-1β诱导的MMPs 和ADAMTS-4 mRNA 表达的影响,结果显示IL-1β 刺激人骨关节炎软骨细胞后,ADAMTS-4、MMP-3、MMP-9、MMP-13 mRNA 表达升高,而经汉黄芩素预处理的骨关节炎软骨细胞ADAMTS-4、MMP-3、MMP-9、MMP-13 mRNA 表达降低。MMP-13 是一种参与软骨降解的主要胶原酶,研究表明经IL-1β 刺激后的骨关节炎软骨细胞培养上清液中MMP-13 分泌增加,然而,经汉黄芩素预处理的软骨细胞MMP-13 分泌水平降低,且呈剂量依赖性。此外,Western blot 结果同样显示,经汉黄芩素预处理的人骨关节炎软骨细胞,MMP-13 蛋白表达降低[38]。在近期的研究中,使用特定的MMPs 抑制剂作为治疗骨关节炎的思路被引起广泛的关注[34],汉黄芩素能有效抑制骨关节炎软骨细胞基质降解蛋白酶的表达,为骨关节炎的防治提供一种新的选择。
骨关节炎的软骨降解是通过胶原酶介导的细胞外基质的主要成分(包括2 型胶原和聚蛋白多糖)的消耗发生的,Khan 等[19]使用体外人类软骨降解模型探讨汉黄芩素是否对成软骨分化中Ⅱ型胶原A1 (collagen,typeⅡ,alpha 1,COL2A1)和软骨聚糖蛋白(aggrecan,ACAN)水平有影响。通过检测汉黄芩素处理、不处理及IL-1β 刺激的人软骨移植体上清液中COL2A1 和ACAN 的释放,发现经IL-1β处理后的上清液中COL2A1 和ACAN 分泌显著增加,表明基质降解,然而预先使用汉黄芩素干预则显著阻断IL-1β介导的COL2A1 和ACAN 在培养基中的释放,并呈剂量依赖性,表明汉黄芩素具有软骨基质保护能力。Li 等[39]使用体外软骨降解模型检测了聚集蛋白降解水平,结果显示,与未刺激的对照组比较,使用IL-1β 处理的软骨外植体培养基中硫酸化糖胺多糖 (sulfated glycosaminoglycan,s-GAG)的释放显著增加。然而,汉黄芩素显著抑制IL-1β诱导的软骨外植体s-GAG 在培养基中的表达,并呈剂量依赖性。因此,汉黄芩素可能是一种有效的软骨保护剂,通过抑制IL-1β 介导的骨关节炎软骨基质降解,上调病理条件下人骨关节炎软骨细胞软骨合成因子COL2A1 和ACAN 的表达,这表明汉黄芩素有可能逆转软骨细胞的代谢轴,将分解代谢调整为合成代谢方向,进而来控制疾病进展。
通过上述研究可以发现从黄芩根提取物中分离的汉黄芩素可抑制IL-1β 刺激的氧化应激介质(ROS、NO)水平,炎症介质 (IL-6、COX-2、PGE2、iNOS、NO)表达和产生,主要蛋白酶(MMP-3、MMP-9、MMP13、ADAMTS4)和s-GAG 的释放等多种生物学效应来防止软骨退化[40]。还发现汉黄芩素通过上调骨关节炎软骨细胞中软骨合成因子COL2A1、ACAN 表达来发挥软骨保护能力,具体作用途径(详见表1)。因此,可以推测汉黄芩素可能具有软骨保护特性,在抑制骨关节的诱导和发病机制方面有重要价值。基于汉黄芩素的特性,富含汉黄芩素活性组分的中药可能是潜在治疗骨关节炎的药物。
4 汉黄芩素通过激活ROS/ERK/Nrf2/HO-1-SOD2-NQO1信号轴来调节氧化还原介导的Nrf2/ARE 通路
过度氧化应激将触发骨关节炎信号通路的激活,导致骨关节炎软骨细胞凋亡或坏死[30]。诱导线粒体功能障碍、高水平ROS 产生及炎症细胞因子IL-1β、TNF-α、IL-6 水平,这些都是骨关节炎发病的重要介质[41]。Nrf2 信号通路作为抗氧化应激的主要调控因子,能调控抗氧化反应基因和Ⅱ期解毒酶的表达,如醌氧化还原酶1、血红素氧合酶1、谷胱甘s-转移酶、谷胱甘肽过氧化物酶、谷氨酸-半胱氨酸连接酶、和过氧化物蛋白I,通过增强对细胞毒性ROS 的清除来对抗组织损伤中的氧化损伤[42]。多项研究表明,Nrf2在调节炎症反应中发挥着不可或缺的作用,缺乏它会增加炎症反应的易感性[43-44]。Nrf2 的激活已被证明可以在多种炎症条件下抑制炎症通路[45]。为进一步证实Nrf2 在汉黄芩素介导的软骨保护中的作用,Innamorato 等[45-46]利用特异性siRNA 在人类骨关节炎软骨细胞中对Nrf2 进行了基因消融,然后用汉黄芩素处理这些软骨细胞,并用IL-1β 刺激细胞,观察到siRNA 介导的Nrf2 的缺失消除汉黄芩素对IL-1β 诱导的骨关节炎软骨细胞IL-6、COX-2、iNOS、MMP-13、ADAMTS-4 mRNA 表达的抑制以及COL2A1 和ACAN 表达的上调,这说明了Nrf2 在病理条件下对汉黄芩素介导的骨关节炎软骨细胞炎症、分解代谢分子表达的抑制和合成代谢分子的上调中起着直接的作用。这验证了汉黄芩素通过调节Nrf2/ARE 通路来保护软骨,突出了汉黄芩素通过激活人骨关节炎软骨细胞Nrf2 来抑制关节退变和疾病进展的潜力。但这一结论仍需要通过在体实验进一步深入研究。
由于汉黄芩素通过低水平的ROS 生成扰乱了软骨细胞的氧化还原平衡,有研究团队通过共聚焦显微镜检测Nrf2在汉黄芩素处理的骨关节炎软骨细胞中的活化,结果显示Nrf2 在软骨细胞的细胞核中显著积累[47]。Khan 等[48]对汉黄芩素和Keap1 Kelch 域晶体结构的硅分子进行了分子对接研究来解释汉黄芩素介导Nrf2 激活的分子机制以确定汉黄芩素是否可以干扰Keap1 和Nrf2 之间的相互作用,结果表明汉黄芩素能够有效地与Keap1 蛋白Kelch 结构域中的Arg415 和Asn414 特异性结合,直接阻断Keap1 蛋白中Nrf2的结合位点,从而阻止其泛素化和随后的降解,导致Nrf2的激活。综上所述,汉黄芩素治疗骨关节炎是通过激活氧化还原敏感转录因子Nrf2,干扰其与Keap1 的相互作用来实现的。目前通过直接抑制Keap1-Nrf2 蛋白与蛋白之间的相互作用来调节Nrf2 的激活,已经成为治疗各种疾病的有效分子靶点[49]。
据报道,一些富含多酚和黄酮类化合物的植物化学物质可以通过激活Nrf2 和诱导血红素氧合酶1 (Heme oxygenase-1,HO-1)等细胞保护酶来保护细胞和组织损伤[50]。为确定汉黄芩素介导的Nrf2 激活如何提供软骨保护,Khan 等[48]检测了汉黄芩素对人骨关节炎软骨细胞Nrf2效应下游表达的影响,结果表明,汉黄芩素诱导骨关节炎软骨细胞超氧化物歧化酶-2 (superoxide dismutase-2,SOD-2)、醌过氧化物还原酶-1 (nicotinamide quinone oxidoreductase-1,NQO-1)及其下游靶基因谷氨酸半胱氨酸连接酶催化亚基(glutamate cysteine ligase catalytic subunit,GCLC)和HO-1 mRNA 的表达,并呈剂量和时间依赖性。在汉黄芩素处理的骨关节炎软骨细胞中,这些分子的蛋白水平也呈时间和剂量依赖性地增加。这表明汉黄芩素介导的ROS 的增加和GSH 的水平下降与Nrf2 激活增加和Nrf2 依赖基因(包括HO-1、GCLC、SOD-2 和NQO-1)转录增加有关。由于PI3K/AKT/GSK3β 是细胞氧化还原调节Nrf2 的重要环节[51-54],Gupta 等[53]通过探索PI3K/AKT/GSK3β 信号轴进一步研究了汉黄芩素介导Nrf2 激活的分子机制,然而,结果显示汉黄芩素处理的骨关节炎软骨细胞没有诱导磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶B (protein kinase B,PKB/Akt)或糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK3β)蛋白磷酸化,这表明汉黄芩素在骨关节炎软骨细胞中激活Nrf2 不通过调节PI3K/AKT/GSK3β 信号轴。最近的研究表明,黄酮类药物介导的 Nrf2 激活涉及上游细胞外信号调节激酶(extracellular signal regulated kinase1/2,ERK1/2)的磷酸化[54]。Khan 等[48]研究汉黄芩素对骨关节炎的治疗是否诱导骨关节炎软骨细胞ERK1/2 磷酸化,结果显示经汉黄芩素处理后,人骨关节炎软骨细胞ERK1/2 的磷酸化水平显著增加,还发现处理后的骨关节炎软骨细胞ROS 的表达,这可能与ERK1/2 激活有关,因为ROS 介导的信号通路被认为是MAP 激酶活化的重要介质。上述研究结果表明汉黄芩素诱导Nrf2 的激活不是通过PI3K/AKT/GSK3β 信号轴,而是通过激活MAP 激酶ERK1/2 信号通路,示意图详见图1。
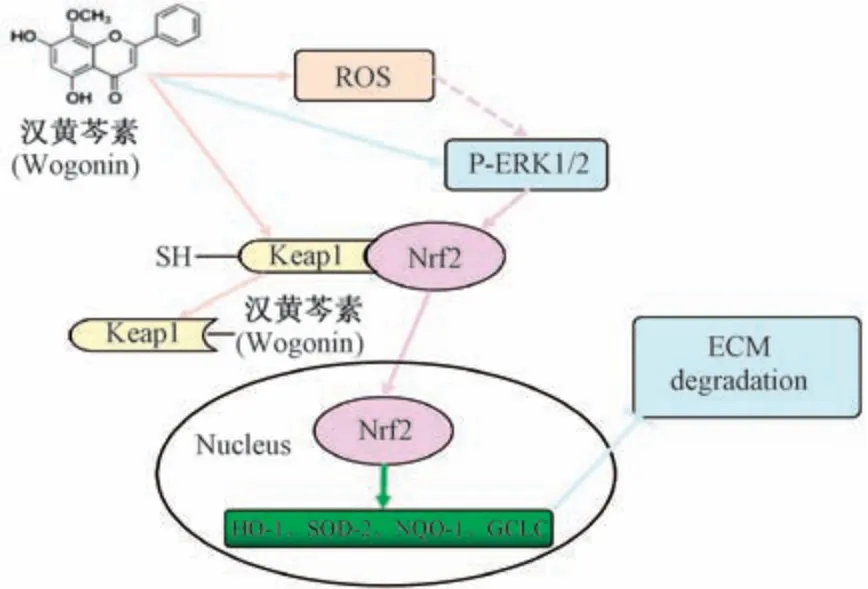
图1 汉黄芩素对人骨关节炎软骨细胞Nrf2 激活机制示意图
5 总结与展望
现有的研究证明天然黄酮类化合物汉黄芩素通过抑制软骨或者软骨细胞的氧化应激、炎症、基质降解等关键分子学效应来中发挥对软骨和软骨细胞的保护作用,从而延缓骨关节炎的病情进展。汉黄芩素在骨关节炎软骨细胞中诱导低水平的ROS,可通过激活ROS/ERK/Nrf2/HO-1-SOD2-NQO1 信号轴调节氧化还原介导的Nrf2/ARE 通路来调节软骨细胞的代谢。目前发现氧化还原调节剂具有抗炎和软骨保护剂的潜力,汉黄芩素作为一种有希望的候选药物,有巨大的开发利用前景。Nrf2 在骨关节发病中调节作用为骨关节炎的治疗提供了新的思路,但目前汉黄芩素调节Nrf2/ARE 通路对骨关节治疗的作用机制尚未完全阐明,在未来的研究中,进一步明确汉黄芩素多途径、多靶点的调控机制将为开发汉黄芩素的衍生物或类似化合物提供有利的条件。

