在脓毒症相关急性肾损伤中FOXM1靶向调控NLRP3表达*
孙 甜,张振旺
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖北科技学院医学部医药研究院)
脓毒症是一种宿主对感染反应失调,导致危及生命的器官功能障碍综合症,约45%~70%脓毒症患者会发生急性肾损伤[1]。脓毒症相关急性肾损伤(sepsis-induced acute kidney injury,SA-AKI)预示着比单独的任何一种综合征都有更差的预后,并且与重症监护病房(ICU)时间、住院时间、长期残疾率、致死率、人群生活质量相关[2]。长期以来人们对于SA-AKI在诊断和指导治疗的生物标志物方面仍然缺乏描述[3],使得临床上对SA-AKI患者缺乏切实有效的早期风险分层和治疗监测方案。
既往研究表明,NLRP3炎性小体的激活可促进SA-AKI[4],且靶向NLRP3炎症小体已被证明对急性肾损伤具有明确的治疗作用,激活FOXM1通路可以促进炎症因子分泌[5],沉默FOXM1能够降低糖尿病小鼠肾脏炎症因子的表达[6],然而FOXM1能否通过靶向调控NLRP3表达而影响SA-AKI的发生发展尚无相关报道。因此,本文拟从免疫组化、免疫印迹、双荧光素酶报告基因和qRT-PCR等途径探讨在LPS诱导的SA-AKI中炎性因子的表达变化及炎症相关因子的可能调控机制,以期筛选出新的生物损伤标志物,应用于SA-AKI的早期诊断和疾病干预。
1 材料与方法
1.1 实验材料
1.1.1 实验动物与细胞
10只SPF级C57BL/6雄性小鼠购自斯贝福(北京)生物技术有限公司[许可证号为SCXK(京)2019-0010]。MPC5细胞由北京北纳创联生物技术研究院细胞系传代而来。
1.1.2 主要试剂与仪器
LPS(脂多糖)和FOXM1单克隆抗体购自Beyotime公司;NLRP3和IL-1β单克隆抗体购自Affinity Biosciences公司;IL-6多克隆抗体、一抗稀释液、二抗稀释液和Dual-Lumi双荧光素酶报告基因检测试剂盒购自Servicebio公司;α-tubulin多克隆抗体购自Beyotime公司;组织裂解液(10×)购自Biosharp公司;RNA isolater购自Vazyme公司;ToloScript All-in-one RT EasyMix for qPCR和2×Q3 SYBR qPCR Master Mix (Universal) 购自TOLOBIO公司;NeofectTMDNA transfection reagent购自北京码因科技有限公司。
荧光定量PCR仪(美国Bio-Rad公司);凝胶成像分析系统(美国Bio-Rad公司);NanoDrop 2000(中国赛默飞世尔科技有限公司)。
1.2 实施方法
1.2.1 动物模型制备
将10只C57小鼠于SPF级动物房[SYXK(鄂)2018-0071]适应性喂养1周后,随机分为正常对照组(CON,n=5)和LPS组(LPS,n=5)。LPS组小鼠按照10mg/kg体重一次性腹腔注射1mg/mL的LPS溶液;正常对照组注射等体积的生理盐水,两组小鼠均于给药24h后取材。眼球取血用于ELISA检测,4%多聚甲醛固定双肾,左肾用于免疫组化染色,右肾用于免疫印迹检测。
1.2.2 细胞培养及转染
采用含10%FBS和抗生素的DMEM完全培养基,将MPC5细胞培养在含5%CO2、恒温37℃的条件下的培养箱中。待细胞密度达到80%左右,换新鲜完全培养基,将细胞分组为空白对照组、pCMV-Vector组、pCMV-FOXM1(1μg)组、pCMV-FOXM1(2μg)组和空白对照组、SiCTL组、SiFOXM1(1μg)组、SiFOXM1(2μg)组。2h后将各组质粒DNA加入100μL无血清DMEM,充分混匀后制成DNA稀释液,再向其中直接加入2μL NeofectTMDNA transfection reagent,轻柔混匀,室温静置20min后将转染复合物加入细胞培养基中,混匀后继续培养36h收取细胞。
1.2.3 血清生化指标
各组小鼠眼球取血,室温自然凝固20min,2000rpm,15min(4℃条件下),收集上清液。采用全自动生化分析仪(深圳雷杜生命科技,Chemray 240)测定血清中尿酸(UA)、尿素(UREA)和肌酐(CREA)的含量。
1.2.4 免疫组化法染色
肾组织石蜡切片烤片脱蜡至水化,于3%H2O2溶液浸泡15min,阻断内源性过氧化物酶,高压抗原修复,室温封闭30min后分别加入IL-1β、IL-6和NLRP3一抗(1∶200)4℃孵育过夜,次日加入相应种属的二抗,室温摇床孵育1h,充分洗涤后DAB显色,苏木素复染、脱水、透明、封片,显微镜下观察IL-1β、IL-6和NLRP3的免疫组化染色结果。
1.2.5 Western blot检测
在10mg小鼠肾脏组织中加入300μL组织裂解液,研磨珠配平后于超速破碎仪充分研磨,所得组织匀浆液置冰上裂解30min,4℃,12 000rpm离心10min后,取上清液测BCA进行蛋白定量,加入5×loading buffer充分混匀,于98℃煮沸7min行蛋白变性,10%SDS-PAGE电泳,250mA转膜2h,5%脱脂牛奶封闭1h,4℃摇床过夜孵育一抗稀释液FOXM1(1∶1000)、NLRP3(1∶1000)、IL-6(1∶1000)和α-tubulin(1∶1000)。次日1×TBST快摇洗膜3次,10min/次,于相应种属的二抗稀释液(1∶1000)室温孵育1h,再次快摇洗膜3次,10min/次,配制ECL发光显影液显影。使用ImageJ软件分析各蛋白条带灰度值,目的蛋白表达水平(%)=目的蛋白灰度值/α-tubulin灰度值×100%。
1.2.6 生物信息学预测和双荧光素酶实验验证FOXM1与NLRP3的靶向关系
利用HumanTFDB网站分析(http://bioinfo.life.hust.edu.cn/)预测FOXM1与NLRP3的靶向结合情况。在此基础上,设计合成NLRP3启动子(1~2000bp)荧光素酶报告载体pNLRP3-pro-Luc。培养MPC5密度达到80%~90%后,将其以每孔1×105细胞传代于12孔板培养24h,使用转染试剂进行转染。转染荧光素酶检测相关重组载体pNLRP3-pro-Luc(实验室构建)、pRL(renilla luciferase reporter vector)和pCMV-FOXM1(实验室构建)等质粒,继续培养48h后移除培养基,无菌0.01mmol/L的PBS洗涤1次。将双荧光素酶检测试剂盒中1×PLB(passive lysis buffer)裂解液分别以每孔200μL加入12孔板,剧烈摇动20min。将裂解液收集于1.5mL离心管,于离心机12 000rpm离心30s,收取上清液待检测。取双荧光素酶试剂盒中LARII 10μL于1.5mL离心管。加入上述细胞裂解液10μL于离心管轻轻混匀,采用GLOMA检测仪获取数值A。取出1.5mL离心管再加入10μL Stop&Glo Reagent溶液,轻轻混匀,置于GLOMA检测仪获取数值B。计算样本的A/B(每组重复3次)值即为荧光素酶相对表达量,代表基因的相对转录活性。
1.2.7 实时定量逆转录聚合酶链反应(qRT-PCR)
弃去培养基,用37℃无菌PBS洗涤2~3次,用RNA isolater提取各组MPC5 RNA,NanoDrop2000测定RNA总浓度,用ToloScript RT EasyMix for qPCR (with 2-Step gDNA Erase-Out)去除基因组DNA和逆转录为cDNA,使用2×Q3 SYBR qPCR Master Mix (Universal)进行定量检测,条件:95℃ 5min,95℃ 10s,58℃ 30s,72℃ 30s,总共35个循环。以GAPDH为内参定量NLRP3和FOXM1表达,采用2-△△Ct计算相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.3 统计学方法
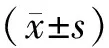
2 结 果
2.1 UA、UREA和CREA在SA-AKI血清中的浓度
UA、UREA和CREA的产生增加是LPS诱导的SA-AKI小鼠模型的一个重要标志[7]。实验结果显示,与对照组相比,LPS组血清中UA、UREA和CREA的浓度明显增加,见图1。

与对照组比较,*P<0.05,**P<0.01,***P<0.001,n=5。
2.2 IL-1β、IL-6和NLRP3在SA-AKI肾组织中表达情况
通过免疫组织化学染色法检测LPS诱导的SA-AKI小鼠模型肾组织中IL-1β、IL-6和NLRP3的表达情况。实验结果显示,与对照组相比,LPS组可见数量较多的胞质、胞核呈大量棕黄色的阳性细胞,由此表明LPS组小鼠肾脏组织中IL-1β、IL-6和NLRP3表达增加,见图2。

图2 免疫组化检测LPS诱导的SA-AKI肾组织中IL-1β、IL-6和NLRP3的表达(标尺:20μm)

A.免疫印迹检测LPS诱导SA-AKI模型中IL-6和NLRP3表达水平变化;B.IL-6和NLRP3蛋白条带灰度值分析(与对照组比较,*P<0.05,**P<0.01,n=5)。
2.3 IL-6和NLRP3在SA-AKI模型中表达情况
通过免疫印迹检测LPS诱导的SA-AKI模型中肾组织炎症因子的表达情况。实验结果显示,与对照组相比,LPS组小鼠肾脏组织中的IL-6和NLRP3表达水平上调,与免疫组化检测结果一致,见图3。
2.4 FOXM1与NLRP3的靶向关系及结合位点
HumanTFDB网站分析显示,FOXM1-NLRP3启动子区域通过碱基互补配对的方式结合,且二者之间有“-219 to -227bp、-388 to -394bp、-396 to -402bp和 -462 to -470bp”4个结合位点,见图4。

图4 FOXM1和NLRP3的靶向结合位点
2.5 转录因子FOXM1对NLRP3基因表达的影响
双荧光素酶实验结果显示,高表达FOXM1后荧光活性升高,提示FOXM1靶向结合NLRP3启动子,说明转录因子FOXM1能够转录调控NLRP3基因表达(P<0.05),见图5。

与对照组比较,**P<0.01,***P<0.001,n=3。
2.6 FOXM1在SA-AKI模型中表达情况

A.免疫印迹检测Lps诱导的Sa-Aki模型中Foxm1表达水平的变化;B.Foxm1蛋白条带灰度值分析(与对照组比较,***P<0.001,n=5)。
通过免疫印迹检测LPS诱导的SA-AKI模型中FOXM1的表达情况。实验结果显示,与对照组相比,FOXM1在LPS诱导的SA-AKI模型中高表达,见图6。
2.7 FOXM1对NLRP3基因表达的影响
qPCR检测结果显示,与空白对照组相比,pCMV-FOXM1组在MPC5细胞中过表达FOXM1,NLRP3 mRNA水平随之升高,且随着浓度梯度的升高而升高。与空白对照组相比,SiFOXM1组在MPC5细胞中沉默FOXM1的表达,FOXM1的表达明显降低,同时NLRP3 mRNA水平也随之降低,且随着浓度梯度的降低而降低,表明FOXM1能调控NLRP3基因表达,并呈现出浓度梯度依赖性,见图7。

与空白对照组比较,*P<0.05,**P<0.01,***P<0.001,n=3。
3 讨 论
根据急重症质量倡议(acute disease quality initiative,ADQI)提出脓毒症诊断后7天内发生AKI,同时存在符合共识标准的胀毒症和AKI标准,可定义为SA-AKI,SA-AKI是危重患者的常见并发症,可以使其死亡风险提高16倍[8]。近些年,新兴的生物标志物已在肾脏相关应激和(或)损伤中显示出巨大的开发潜力,能够提供更多的SA-AKI病理生理情况,作为功能性检查的重要补充。
SA-AKI的发病机制是多因素且复杂的,涉及炎症、微循环功能障碍和代谢重编程之间的相互作用,其中炎症失调尤其是NLRP3炎症小体的异常活化,是导致系统性炎性介质和细胞因子(IL-1β、IL-6和TNF-α)的过度释放、诱发一系列外周至中枢的炎性级联反应[9]、加重肾脏细胞坏死、引起全肾和局部的肾脏炎症反应的常见病因。NLRP3炎性小体的激活可促进SA-AKI,且靶向NLRP3炎症小体已被证明对急性肾损伤具有明确的治疗作用。比如:通过迷迭香酸(RA)治疗阻断炎症小体信号通路可减轻小鼠急性肾损伤[10],瑞德西韦(RDV,GS-5734)可以通过调节巨噬细胞炎症小体激活和炎症免疫反应来改善急性肾损伤[11]。蟾蜍灵通过抑制NLRP3炎性体减轻细胞焦亡产生的急性肾损伤,但其在SA-AKI中的作用机制尚不明确。
本文通过生物信息学软件分析发现NLRP3是FOXM1的靶基因,且荧光素酶实验验证了该结果,确认FOXM1可靶向调控NLRP3表达。转录因子FOXM1能够直接或间接调控炎症反应过程中多种信号分子Wnt/β-catenin[12]、JAK/STAT[7]、NF-κB[13]和P38MAPK[14]、炎症相关介质(IL-1β、IL-6和TNF-α[15])及细胞趋化因子(MCP-1、CCL2和CX3CL1)的表达。比如,FOXM1的表达受到TNF-α/ROS/HIF-1途径的调节[16],抑制FOXM降低了CCL11、CCL24以及趋化因子受体CCR2和CX3CR1的表达,导致嗜酸性粒细胞和巨噬细胞的募集减少[17]。高表达FOXM1能够增加Th1和Th2细胞因子的分泌、促进PI3K/AKT/GSK-33和p38MAPK信号通路所介导的炎症反应[18]。此外,Wnt/β-catenin信号通路可诱导FOXM1去泛素化,稳定FOXM1的结构和表达,从而驱动β-catenin入核,促进炎症生物学行为相关基因的转录。若抑制FOXM1则可以阻止细胞凋亡、炎症、NF-κB和JAK/STAT信号通路活化的影响[19],且FOXM1与p38MAPK、NF-κB的表达量呈正相关关系,通过p38MAPK/NF-κB信号通路来启动炎症因子的表达、诱导炎症反应级联放大[20],而miR-4429靶向FOXM1可以降低SMAD3的表达水平[21],阻碍细胞的细胞增殖、迁移、侵袭和上皮-间质转化过程,从而抑制炎症进展[22]。为进一步确认FOXM1在LPS诱导的SA-AKI模型中的表达变化,本研究采用免疫印迹分析技术,结果显示FOXM1在LPS诱导的SA-AKI模型中呈现高表达。为了更为直观地揭示NLRP3与FOXM1二者之间的关系,本研究选用研究急性肾损伤常用的肾足细胞(MPC5)作为研究载体,在MPC5中瞬时转染FOXM1干扰质粒,通过qRT-PCR检测干扰FOXM1后对NLRP3表达的影响。实验结果显示,与对照组相比,在MPC5中FOXM1的表达水平显著升高,同时,NLRP3 mRNA水平也随之上升,且随浓度梯度升高而上升。相反,在MPC5中FOXM1表达明显下降,同时NLRP3 mRNA水平也随之降低,且随浓度梯度下降而降低。这提示NLRP3炎症小体的激活可能通过FOXM1的特异性上调来实现,且FOXM1与NLRP3之间存在正向调控作用。因此,推测FOXM1可能通过靶向NLRP3影响其下游炎性因子的表达,进而参与脓毒症相关肾损伤的发生发展(图8)。

在LPS诱导的脓毒症相关急性肾损伤模型中,FOXM1通过转录激活NLRP3炎症小体促进下游炎症因子的释放,从而加剧脓血症相关急性肾损伤的发展。
综上所述,FOXM1在MPC5中对NLRP3基因表达具有靶向调控作用,且上调FOXM1表达后NLRP3表达增加,下调FOXM1表达后NLRP3表达随之降低,且呈现出浓度梯度依赖性。因此,FOXM1、NLRP3有望成为脓毒症相关肾损伤进展过程中生物治疗新靶点。然而,目前尚未明确FOXM1调控脓毒症相关肾损伤发展是否还涉及其他因子的参与,需要进一步研究来阐明。

