基于价-类二维模型的“二氧化硫性质辨析”复习课例
韦小云 罗伟杰

[摘 要]基于价-类二维模型的“二氧化硫性质辨析”复习教学由真实的问题情境引入,通过微型实验辨析SO2的多重性质,培养学生的“科学探究与创新意识”“证据推理与模型认知”等化学学科核心素养。具体地,以不同情境中的问题为驱动,带领学生设计工业尾气SO2的处理方案及葡萄酒中SO2的含量測定方案,引导学生学会多角度思考问题,自主运用价-类二维模型解决问题,提升研究物质性质与相互转化的能力,形成能迁移应用的问题解决思路和认知模型。
[关键词]价-类二维模型;二氧化硫;复习课例
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674-6058(2023)29-0061-04
一、教学内容
人教版高中化学教材(2019年版)在介绍硫时,从元素周期表中的位置入手,分析硫原子结构,预测其基本性质,注重体现“位、构、性”之间的内在联系;接着,介绍SO2是一种大气污染物,也是一种重要的化工原料,我们应正确认识其“功与过”。本节复习课通过辨析SO2在不同情境中的性质,指导学生构建价-类二维模型,进而提升学生分析问题、解决问题的能力;同时,关注生产生活中与化学相关的问题,体现了课程标准中培养学生的社会责任感、参与意识和决策能力的要求[1]。
二、学情分析
学生已经学习了物质分类、氧化还原反应、离子反应及部分元素化合物等理论知识,对物质性质的研究有了初步的认识。在化学实验方面,学生已经有一定的实验操作能力和观察分析能力,对化学实验兴趣浓厚,但是综合实验操作能力、分析能力以及实验方案设计能力还有待提高。
三、教学目标
为了达成课程标准提出的“立德树人”“培养必备知识、关键能力”等培养目标,本节课设计不同的情境,引导学生以问题解决者的身份去思考和构建解决问题所需的基本策略及方法,从物质类别和元素化合价的角度辨析SO2的性质,促进学生“证据推理与模型认知”核心素养的发展。如处理工业尾气SO2的问题,设计方案测定葡萄酒中SO2的含量,进而建构“物质分类观”和“氧化还原观”这两个化学学科核心大概念[2]。并在进行微型实验时,解决气体泄漏问题,通过实验创新,让学生形成科学的探究意识,培养社会责任感。
四、教学重难点
教学重点:二氧化硫性质辨析。
教学难点:价-类二维模型的构建和应用。
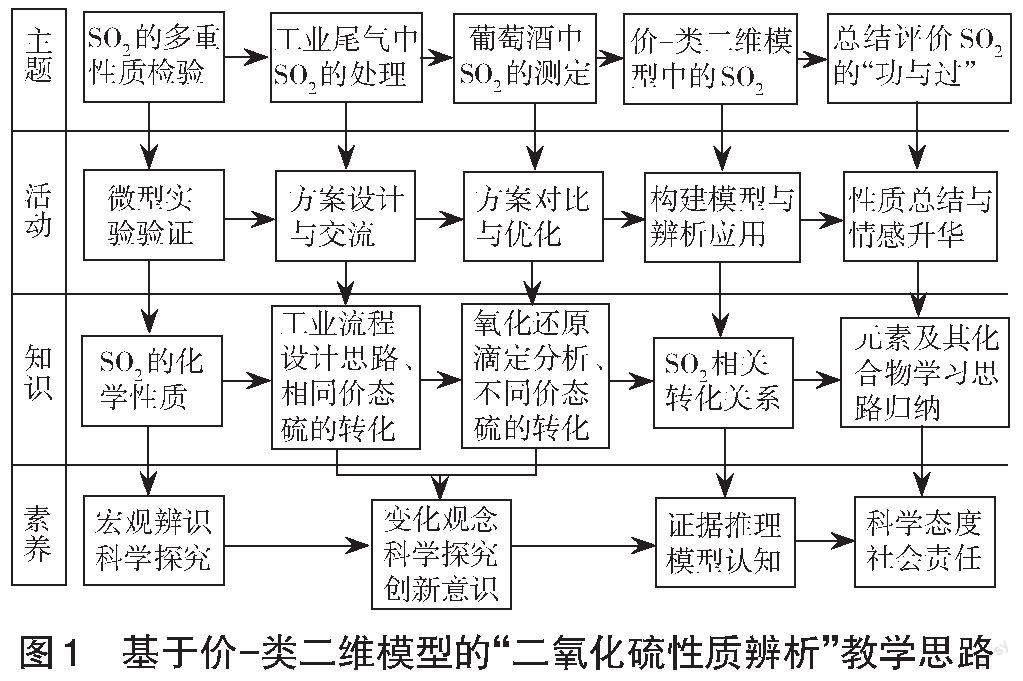
五、教学思路
以不同情境中的“二氧化硫性质辨析”为主题展开复习教学,从不同生产生活的情境到知识概念的转化,让学生在问题解决中进一步构建硫元素及其化合物的价-类二维模型,形成高中化学重要的价类思维(同价态转化和不同价态转化)学科大概念[3]。在介绍二氧化硫给环境、健康带来的负面影响的同时,引导学生认识二氧化硫在生产生活中的重要作用,辩证认识事物的两面性,有助于培养学生的科学态度和价值观,彰显学科价值,渗透哲学思想。
在教学中穿插以二氧化硫性质探析为主题的多样式情境,促进情境与知识概念的相互转化,推进问题解决,以构建硫及其化合物价-类二维模型,使学生形成基于学科大概念的价类思维。在介绍二氧化硫多面性的同时,渗透哲学思想,并引导学生树立正确、辩证的问题观与价值观。具体的教学思路如图1所示。
六、教学过程
环节一:辨识SO2
【引课】化学与生活息息相关,今天我们的主角是SO2。
【播放视频】介绍SO2是大气污染物,是形成酸雨的主要成分,有毒且属于三类致癌物;SO2在生产生活中可用作漂白剂、杀虫剂、防腐剂、抗氧化剂,也应用于农药、纺织、染料、润滑油等方面。
【教师提问】同学们眼中的SO2是魔鬼还是天使?
【学生回答】是魔鬼也是天使。
【追问引导】为什么二氧化硫是魔鬼也是天使呢?这是由于SO2有着多重性质。现在,让我们通过实验辨析SO2的性质。
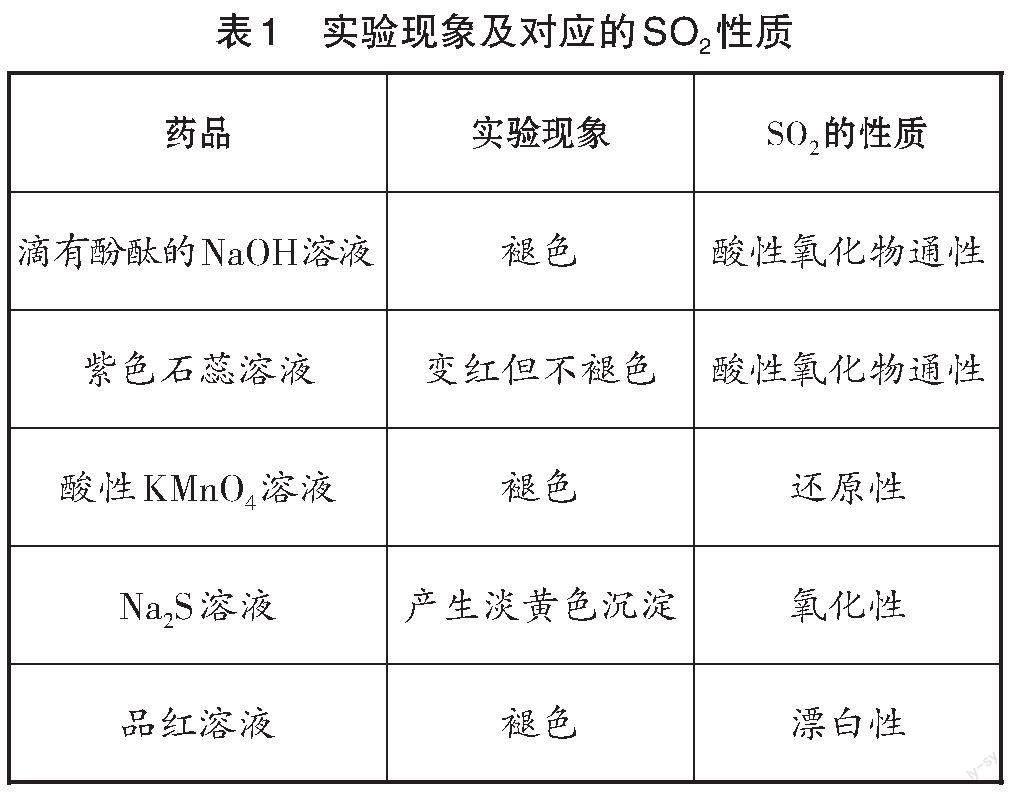
【微型实验】这是一个包含SO2制备及性质检验的微型实验。将点滴板放入培养皿内,在点滴板上分别滴入滴有酚酞的NaOH溶液、紫色石蕊溶液、酸性KMnO4溶液、Na2S溶液、品红溶液;向培养皿中的Na2SO3固体滴几滴浓硫酸,立即用另一培养皿扣在上面,防止SO2泄漏。
【学生实验】学生分组进行实验,观察实验现象并记录。
【实验现象】实验现象如图2所示。
【引导】通过实验现象辨析SO2体现出的不同性质(见表1)。
【板书】
【核心问题】如何快速辨析SO2在不同情境中的性质?
【核心技巧】运用价-类二维模型来准确辨析。
设计意图:通过短视频,让学生直观地认识到SO2在生产生活中的“功与过”,学会辩证地看待事物;通过微型实验辨析SO2的多重性质,培养学生的科学探究与创新意识、证据推理等学科核心素养,明确同价态、不同价态硫元素及其化合物之间的转化,引导学生从物质类别、元素化合价的角度构建认知模型;通过SO2多重性质的微观实验,体现宏观辨识、微观探析与科学探究等学科核心素养,让学生切身体会物质转化以及元素价态变化在宏观现象中的映射,促进价类变化和物质变化在化学教学中交融生根、思维模型在科学探究中落地。
环节二:辨析不同情境中SO2的性质
情境1:工业尾气中的SO2
【创设情境】在我们的印象里,柳州是一座环境优美的工业城市。但同学们,你们是否知道柳州曾一度被贴上“酸雨之都”的标签?作为老牌西南工业重镇,柳州在发展进程中也曾走过弯路。二十世纪八九十年代的柳州,烟囱林立、浓烟滚滚,曾有“十雨九酸”的说法,而后柳州以壮士断腕的决心,打响了环境保卫战。如今,柳州蜕变为一座“紫荆满城”、号称“水质冠军”的优美城市。你们知道形成酸雨的原因是什么吗?
【学生回答】煤和石油等化石燃料的燃烧会产生SO2,工业生产中也会产生SO2废气,而SO2会导致酸雨的形成。
【任务1】如果你是一名工业设计师,你会选择什么试剂吸收工业尾气中的SO2呢?小组讨论,设计方案,并分享方案。
【学生讨论】小组讨论得出吸收SO2的方案并分享方案:选择的吸收试剂有NaOH溶液、石灰乳、氨水、生石灰、酸性KMnO4溶液、碘水、过氧化氢、Na2S溶液等。如果应用于工业生产,更倾向于使用石灰乳和生石灰,因为价格相对便宜。
【评价学生方案】学生在设计方案时,不仅考虑到了这些物质可以与SO2发生反应,还考虑到了其他因素,如原料成本、经济效益等。
【引导】在实际的工业应用中,同样要综合考虑各方因素来选择吸收方案。工业上常见的SO2处理方法有钠碱脱硫法、氨水脱硫法、石灰-石膏脱硫法、钙基固硫法等。
【任务2】思考上述工业治理方案的反应原理,试着写一写相应的反应方程式。
【书写方程式】让学生根据提供的信息书写工业上常见的吸收SO2尾气的化学反应方程式。
(1)以烧碱为吸收液:2NaOH+SO2=Na2SO3+H2O;
(2)以浓氨水为吸收液:SO2+2NH3·H2O=(NH4)2SO3 +H2O;
(3)以石灰浆液为吸收液:SO2+Ca(OH)2=CaSO3+H2O;
(4)以生石灰为固硫剂:SO2+CaO=CaSO3。
【启示】以上反应体现了SO2酸性氧化物的通性,即可与碱或碱性氧化物反应,S元素化合价不变。由此,我们可以得到这样一条物质转化规律:酸性物质+碱性物质[→] 盐,实现相同价态物质的转化。
设计意图:引导学生设计工业尾气中SO2的吸收方案,学会利用SO2酸性氧化物的性质将其与碱性物质反应转化为盐进行吸收,或加入氧化剂、还原剂通过氧化还原反应进行转化吸收。在实际的化工生产中还需要综合各方因素来选择最佳方案,这个过程可培养学生综合分析问题与解决问题的能力。二氧化硫吸收方法和原理的分析以及相关方程式的书写,可强化学生对相同价态物质转化的分析思路,建立“类别转化”的学科概念[4]。让学生运用所学知识解决实际问题,体会化学知识之于环境保护的重要作用,可培养学生的社会责任感。
情境2:葡萄酒中的SO2
【创设情境】在控制含量的情况下,SO2可被添加到食品中作为漂白剂、防腐剂和抗氧化剂。如当葡萄酒酿好后,为使其能够保存较长时间,通入SO2可起到抑菌和抗氧化的作用。为保障消费者健康,我国在食品添加剂标准中规定了SO2类物质在食品中的使用范围、使用量及允许最大残留量。
【任务3】假设你是一名葡萄酒检测员,你该如何测定葡萄酒中SO2的含量呢?请选择你认为可行的试剂设计测定方案,并写出相应的方程式。可供选择的试剂有:酸性KMnO4溶液、过氧化氢、碘水、氢硫酸、Ba(OH)2溶液等。
【学生讨论】学生根据SO2的性质分组讨论测定方案并书写相应的化学反应方程式。
(1)酸性KMnO4溶液:5SO2+2KMnO4+2H2O= K2SO4 + 2MnSO4+2H2SO4;
(2)过氧化氢:H2O2+SO2=H2SO4;
(3)碘水:I2+SO2+2H2O=H2SO4+2HI;
(4)氢硫酸:2H2S+SO2=3S↓+2H2O;
(5)Ba(OH)2溶液:Ba(OH)2+SO2=BaSO3+H2O。
【启示】SO2中S元素呈+4价,处于S元素的中间价,其既有还原性又有氧化性。将SO2与氧化剂反应,S元素价态升高,转化为更高价态的含硫物质;将SO2与还原剂反应,S元素价态降低,转化为更低价态的含硫物质。因此,向SO2中加入氧化剂和还原剂均可以实现不同价态物质的转化。
【评价学生方案】从原理上分析学生方案的可行性:我们在设计测定方案时以SO2的水溶液为理想模型,而真实的情境是测定葡萄酒中的SO2。对比分析发现二者存在差异,如葡萄酒中含有乙醇等还原性物质,葡萄酒中SO2含量较低等。因此,我们需要对方案进行优化。经查阅资料,将方案改进为先把葡萄酒中的SO2蒸出来,再用高灵敏度的滴定法(如碘量法)进行测定。
【资料卡片】碘量法是一种氧化还原滴定法,以碘作为氧化剂,或以碘化物(如碘化钾)作为还原剂进行滴定的方法,用于测定物质含量。
【任务4】定量计算:取20.00 mL的葡萄酒,通过碘量法进行测定,消耗0.002 mol/L碘水标准液的体积为25.00 mL。请通过计算判断该葡萄酒中SO2的含量是否达标。
【资料卡片】国家食品添加剂使用标准中葡萄酒中SO2的最大使用量为0.25 g/L。
【思考与计算】书写化学反应方程式,并列式计算葡萄酒中SO2的浓度。
设计意图:通过葡萄酒中SO2含量的测定方案设计,强化学生的价类思维;在方案评价中对比理论模型与实际模型进而优化方案,培养学生的思辨能力;通过葡萄酒中SO2的含量是否超标的计算,从“定性”到“定量”,培养学生严谨的化学学科研究思维。从化学走向社會,引导学生观察生活并将所学知识应用到实际中,可培养学生辩证看待事物的态度,体会“善用之则为福,不能用之则为祸”的哲学思想,增强学生的社会责任感。
环节三:总结提升
【引导总结】通过本节课的学习,你收获了哪些分析问题的方法?谈谈你的感想。
【学生自由表达】从价-类二维角度辨析SO2的多重性质并进行应用;当面对陌生物质时,也可以从价-类二维角度去分析其性质;当相同价态、不同价态的物质之间相互转化时,也可以从价-类二维角度进行分析;等等。
【核心技巧】运用价-类二维模型(如图3)来准确辨析。
【迁移应用】
连二亚硫酸钠(Na2S2O4)也称保险粉,该物质不溶于乙醇,溶于氢氧化钠溶液,遇少量水或暴露在潮湿的空气中会发生剧烈反应并燃烧,且有刺激性气味气体产生。下列说法错误的是()。
A. Na2S2O4中S元素化合价为+3价
B. Na2S2O4属于盐,既有氧化性又有还原性
C. Na2S2O4能和新制氯水反应,但不能和酸性高锰酸钾反应
D. 将产生的气体通入品红溶液中可使品红溶液褪色
【学生分析】运用价-类二维模型分析物质性质并解决问题。
设计意图:给予学生自由发挥的空间,让学生巩固SO2的多重性质等知识,并掌握物质性质的学习方法,学会运用价-类二维模型辨析性质、解决问题。同时关注情感教育,落實立德树人根本任务,将学科知识的学习和学习态度、健全人格的培养等相结合,使知识与情感融合,培智与育人一体化。
七、教学反思
本节课以基于真实情境的问题解决为主线,指向学科核心素养的培养,通过“工业尾气中SO2的处理”与“葡萄酒中SO2的测定”两个实例,将物质的学习置于问题的解决过程中,充分利用价-类二维模型进行实验探究、性质辨析与方案设计,形成二氧化硫的性质知识体系及元素化合物的学习方法,构建价-类二维模型及学科大概念,让学生对物质的研究形成更深刻、更本质的认识,提升学生的学科素养。在小组实验及方案探讨中,师生交流、生生交流的频次变高,学生学习热情高涨,学习能力与动手能力得到了增强,同时也培养了科学探究精神和团队合作意识。
SO2虽然是一种大气污染物,但也是一种重要的化工原料,在生产生活中有着广泛的用途。本教学围绕“立德树人”的教育宗旨,通过探讨SO2的“功与过”,引导学生树立辩证看待事物的世界观。
本节复习课充分融合了大概念教学视域下物质性质的一般学习思路,将价-类二维模型充分应用到实验探究中,形成以化学问题情境为引导、真实情境为主线、模型构建为思路、科学探究为手段的思维教学,辅助学科核心素养的落地与具体化,让学生在物质性质的学习中掌握知识、拓展思维、强化能力、升华观念。
诚然,学生所需的不仅仅是一类知识,更是使用知识的方法。“善用之则为福,不能用之则为祸。”学生是否能“善用之”取决于学习过程中是否以问题解决及观念建构穿插始终,故学科核心素养的落地必须根植于真实的问题情境,以观念建构为“养料”方能开出“善用”之花。
[ 参 考 文 献 ]
[1] 中华人民共和国教育部.普通高中化学课程标准:2017年版2020年修订[M].北京:人民教育出版社, 2020.
[2] 石磊,李德前.研读课程标准 关注教材变化:以“二氧化硫的性质和应用”教学为例[J].化学教学, 2020(8):43-48.
[3] 邹国华,童文昭,杨梓生.基于真实问题情境 指向学科核心素养:“酸雨及其防治”教学实录[J].中小学实验与装备,2022(13):34-38.
[4] 杨春宁.指向深度学习的“二氧化硫的性质”教学设计[J].中学化学教学参考,2022(2):39-41.

