儿童神经母细胞瘤化疗后严重感染的影响因素及重组人粒细胞刺激因子预防的应用效果
杨 兰,高林林,雷婉婷
南阳市中心医院,河南 南阳 473000
神经母细胞瘤(NB)是婴幼儿时期较为常见的颅外实体肿瘤,此病的临床特点为异质性高、生物学行为复杂、分子特征多等,不同的个体在发病后将出现不同的临床表现,患儿群体中有可能出现自行痊愈、自然退化或迅速发展3 种完全不同的趋势。近年来,随着临床医学技术的不断提升,针对NB 的诊断与治疗已迈入全新的分子生物学时代,疾病的早期筛查、早期诊断及治疗等都有了理想进展。随着医学界对NB 的认知程度不断加深,且改进了原有的治疗方案,使得NB 患儿的临床生存率得到了极大的提升,但是NB 5年期内的生存率仍不足40%。不少研究学者认为,目前临床治疗中常用的手术切除、化疗、放疗、免疫治疗及造血干细胞移植等治疗方案都各具优缺点,最科学的办法是尽快确定患儿的病情分期,并针对个体上的差异来制定综合的治疗方案,从而更好地降低患儿在临床上的不良反应,努力延长患儿的生存期。在现实治疗中,临床多以手术+化疗的方法治疗NB,但是出于多种因素影响,此法的预后并不理想,分析其原因可能跟疾病早期即可转移、恶性程度大等因素相关,且化疗所产生的毒副作用、患儿群体自身的依从性等同样会影响临床预后[1-2]。鉴于此,本研究回顾性分析2020 年3 月—2021 年12 月南阳市中心医院收治的100 例NB 患儿的一般资料,旨在分析、探究儿童NB 化疗后严重感染的影响因素及重组人粒细胞刺激因子(rhG-CSF)预防的应用效果,现将研究结果报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2020 年3 月—2021 年12 月南阳市中心医院收治的100 例NB 患儿的一般资料,统计所有患儿在化疗治疗后严重感染的发生率,并统计临床上可能诱发感染的影响因素。将停止化疗24 h后立即接受rhG-CSF预防干预的患儿为观察组(n=57);将出现粒细胞缺乏现象后再接受rhG-CSF 预防干预的患儿为对照组(n=43)。其中,观察组男37例,女20例;年龄1~12岁,平均年龄(3.95±1.54)岁。对照组男22 例,女21 例;年龄1~11 岁,平均年龄(3.85±1.49)岁。两组患儿一般资料具有可比性(P>0.05)。本研究经医院医学伦理委员会批准,且患儿家属签署知情同意书。
纳入标准:年龄1~12 岁,可供临床研究的资料齐全。排除标准:罹患严重心、肝、肾等重大器官疾病,有凝血功能障碍。
1.2 治疗方法
对两组患儿的性别、年龄、病情分期、病灶原发部位、远处转移情况、血清神经元特异性烯醇化酶(NSE)水平、手术切除情况、化疗所用药物、化疗维持时间等进行分析。观察组在停止化疗的24 h 后,立即接受rhG-CSF进行预防干预,应用剂量以5 μg/(kg·d)为准,对患儿的骨髓造血功能进行刺激,直至外周血循环中性粒细胞绝对计数为1.5×109/L时停用rhG-CSF治疗;对照组则在出现了粒细胞缺乏后,再进行rhG-CSF 治疗,用法及用量与观察组完全相同。观察患儿化疗后是否出现严重感染,如化疗后发热、体温高于40 ℃、出现合并或不合并性低血压。
1.3 统计学方法
采用SPSS 21.0 软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t 检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 NB患儿化疗后严重感染发生率单因素分析情况
100 例患儿中严重感染发生率为27.00%(27/100)。NB 患儿化疗后严重感染发生率单因素分析结果显示,不同患儿年龄、病情分期、远处转移、血清NSE、手术切除、化疗药物、化疗持续时间等都会影响到患儿化疗后严重感染发生率,差异有统计学意义(P<0.05),见表1。
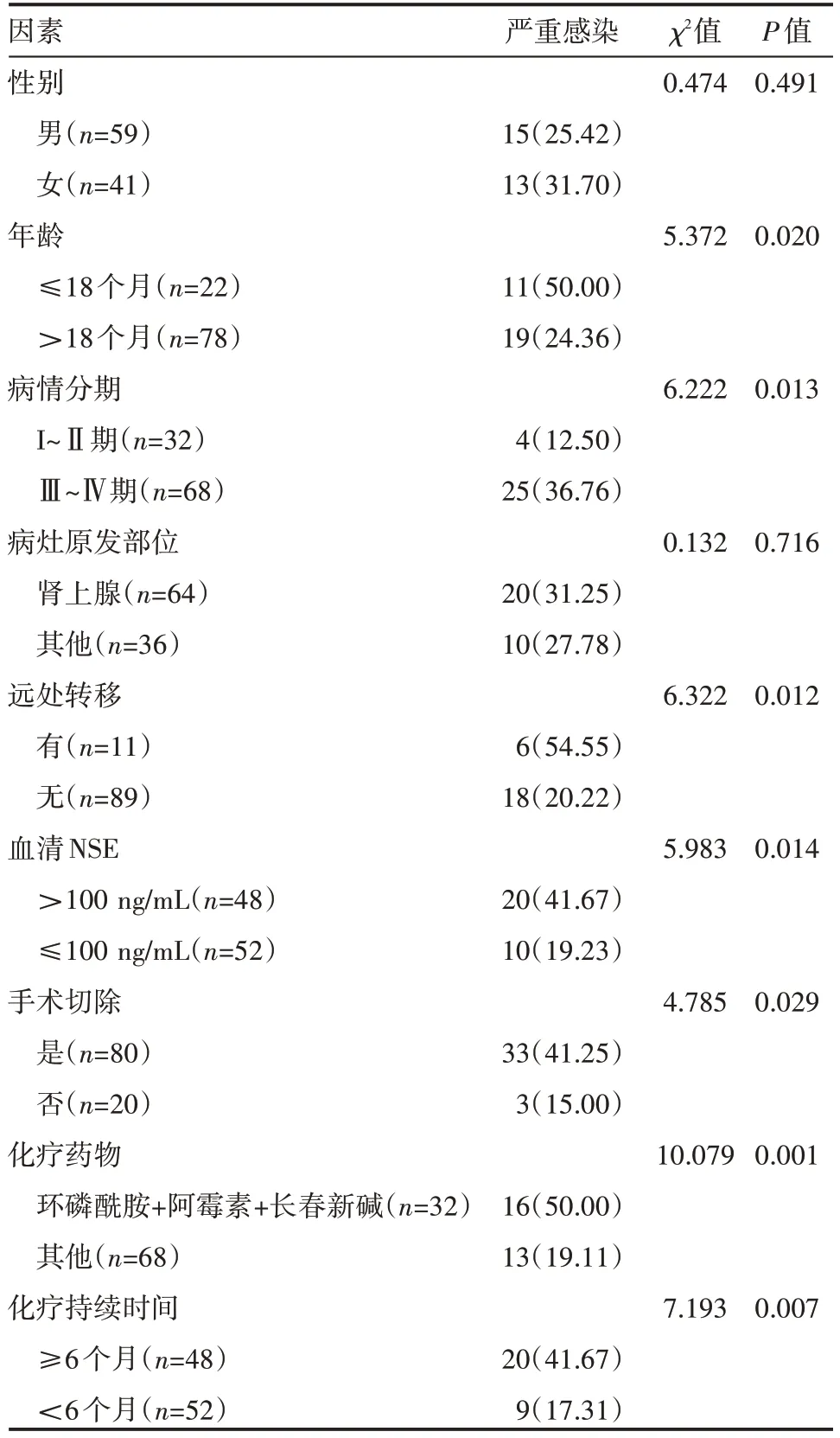
表1 患儿化疗后严重感染的影响因素单因素分析 例(%)
2.2 两组患者严重感染发生情况
应用rhG-CSF 干预治疗后,对照组严重感染发生率高于观察组,感染持续时间长于观察组,差异有统计学意义(P<0.05),见表2。
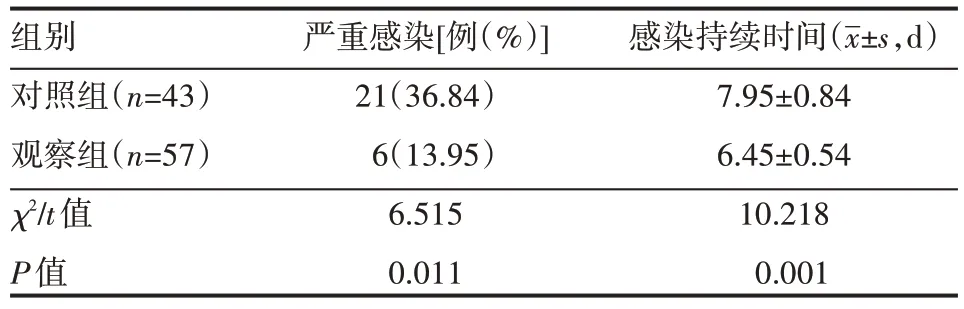
表2 两组患者严重感染发生情况
3 讨论
医学研究发现NB 是源于节后交感神经系统的胚胎性恶性肿瘤,多数病灶都源于人体的肾上腺。NB 在儿童恶性肿瘤中的占比为8%~10%,年发病率为0.3/10 万~5.5/10万。医学研究认为,给予NB 患儿尽早且准确的治疗是提高临床疗效的关键。NB 患儿常见的病灶部位为胸脊柱旁,尤其是在患儿的腹膜后,但是如果在诊断时肿瘤已经出现了广泛扩散,那很有可能无法明确原发病灶[3]。NB起病相对较为隐匿,不容易在早期时被发现,以致于初诊时约有70%的患儿都会出现病灶转移,在治疗过程中常见的转移部位为骨髓、骨、肝脏、淋巴结及皮肤等。有很多患儿都是因为转移病灶诱发了相关症状后,才被送医就诊,若是患儿出现了贫血、发热、四肢疼痛等病症,则说明患儿已经出现了骨或骨髓转移;若是患儿出现了眼球突出、眼眶瘀斑,则说明肿瘤已经侵犯到患儿的眼眶及眶周软组织;病情发展到4S期时,患儿则可能出现腹部膨隆及呼吸困难等病症[4]。
化疗向来都是中高危NB 主要的治疗手段之一,从临床治疗的整体情况来看,很多NB 患儿对化疗方法都比较敏感。目前临床上可为患儿实施术后化疗、大剂量化疗联合自体外周血造血干细胞抑制、术前减容化疗等[5-7]。美国儿童肿瘤协作组提出,针对中危NB,可用药物为多柔比星、卡铂、环磷酰胺及依托泊苷等;而针对高危NB,则以诱导性化疗、维持性诱导化疗、巩固性化疗等为主,同时该协作组的研究数据表明,针对一些没有N-MYC 基因扩增的特殊国际NB4期中危型患儿,如果临床上按照中危的治疗标准来实施治疗,那么患儿3 年的生存率可达到90%,若是患儿伴有N-MYC 基因扩增,那即使是为患儿实施更高强度的化疗方案,其生存率也只有10%左右。
NB 是由未分化的成神经细胞所构成的肿瘤,此肿瘤体积相对较大、质地偏软,切面为灰白色,可伴有出血坏死和钙化迹象,从临床治疗的情况来看,肿瘤的恶性程度比较高,生长的速度也比较快,很有可能在短期内便突破包膜,侵犯患儿病灶周围的脂肪组织,也有可能经淋巴及血液等发生转移。一般情况下,手术联合术后化疗是治疗NB 的主要措施,但是多数患儿在接受了化疗治疗后,都有可能出现明显的骨髓抑制及感染等问题[8]。而本次研究结果显示,年龄≤18 个月、临床分期为Ⅲ~Ⅳ期、出现远处转移、血清NSE>100 ng/mL、手术切除、化疗药物为环磷酰胺联合阿霉素与长春新碱、化疗持续时间≥6 个月的患儿都会出现更高的严重感染率。同时未接受rhG-CSF 预防干预的对照组出现严重感染的概率高于观察组。分期其原因,主要是化疗治疗不仅仅会杀死患儿体内中的癌细胞,同样也会损伤患儿体内的正常细胞,导致患儿出现免疫力下降的情况,而年龄越小的患儿越容易受化疗影响;且临床分期在Ⅲ~Ⅳ期的患儿病情要比Ⅰ~Ⅱ期的患儿更为严重,化疗后将出现骨髓抑制、造血功能不足、免疫力下降等问题;血清NSE 与肿瘤疗效及复发都有关系,可用于肿瘤疾病的诊断与监测;临床治疗中所用的化疗药物一般都是免疫抑制类药物,对机体的免疫功能会造成影响,使得机体状态逐渐变差,诱发严重感染。
本研究结果还显示,在停止化疗24 h后,立即为患儿给予rhG-CSF 治疗,有助于降低患儿在临床治疗中严重感染的发生率,并缩短患儿持续感染的时间。rhG-CSF 是一种调节人体骨髓中粒系造血功能的主要细胞因子,可被选择性的作用在粒系造血祖细胞中,能够促进细胞的增殖与分化,强化粒系未分化细胞的功能,促使粒细胞、单核巨噬细胞加更快成熟,让成熟细胞更好地向外周血释放。rhG-CSF 对人体骨髓抑制的治疗作用较为明显,且不会给患儿造成太大的不良反应,相对而言具有较为理想的安全性,而最佳的给药时机为Ⅱ度骨髓抑制期间。
综上所述,经分析后发现,影响儿童NB 化疗后严重感染的主要因素为患儿年龄、临床分期、血清NSE 水平、选用的化疗药物、化疗的持续时间等,若是能够在患儿化疗24 h后及时给予rhG-CSF干预治疗,能显著降低患儿群体出现严重感染的概率,有利于更好地改善患儿的预后。

