B型CpG寡聚脱氧核苷酸在细菌性疫苗中的研究进展
孙敏,蒋亚君综述,刘开云审校
四川大学华西医院生物制药研究院,四川 成都 610000
疫苗接种已成为各个国家预防感染性疾病不可或缺的措施,免疫佐剂的研究与应用极大提高了疫苗免疫效率。1995 年,KRIEG 等[1]发现,含有未甲基化CpG 的核酸序列具有诱导小鼠B 细胞增殖及分泌免疫球蛋白的作用,从此开启了CpG 寡聚脱氧核苷酸(CpG oligonucleotide,CpG ODN)作为新型疫苗佐剂的研究。近年来,细菌耐药性问题愈发严重,传统临床治疗面临困境,开发针对细菌的亚单位疫苗和重组基因疫苗成为重要防治手段。本文主要以B 型CpG ODN 为重点,综述了目前常用的几类CpG 基序在细菌疫苗中作为佐剂的研究进展,以期为细菌性疫苗的研究提供参考。
1 CpG ODN概述
CpG 是以非甲基化的胞嘧啶和鸟嘌呤核苷酸为核心的基序,也被称为免疫刺激序列DNA,在细菌与非脊椎动物基因组中普遍存在,但在哺乳动物基因组中其免疫刺激活性通常被甲基化后抑制,未甲基化的CpG基序可激活宿主免疫防御系统[2]。
CpG ODN是由人工合成的含有非甲基化CpG的ODN,具有1 个或多个免疫刺激的CpG 基序。CpG ODN 信号通过浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)上的Toll样受体9(Toll like recepter 9,TLR9)诱导IFNα产生,并通过自然杀伤(natural killer,NK)细胞间接诱导IFNγ 分泌[3]。CpG ODN 还可诱导B细胞表面Toll样受体9(surface Toll like recepter 9,sTLR9)从细胞膜重新定位至B 细胞核内体中,促使B 细胞的活化和成熟,同时使CD80、CD86、CD40和主要组织相容性复合体Ⅱ(major histocompatibility complexⅡ,MHCⅡ)分子显著上调,从而增强免疫应答的抗体反应。CpG ODN 同时具有抗肿瘤、抗病毒和免疫保护治疗等作用,是目前广泛应用且具有潜力的免疫佐剂[4-5]。
2 CpG ODN的分类及其结构特征
目前人工合成的CpG ODN 多为长度18 ~30 bp的DNA 单链,其免疫刺激基序由以CG 为核心的连续4 ~6 个核苷酸组成[6]。单链CpG ODN 存在易降解、难吸收等问题,而稳定性与免疫活性是影响其质量评价的重要指标[7],研究人员一般通过设计合成含特殊序列或骨架修饰的CpG ODN 来增加稳定性。含有回文结构、硫代磷酸化修饰及纳米递送系统等的CpG ODN 可免受体内核酸酶降解并延长其半衰期,从而达到增强CpG ODN免疫刺激活性的目的[8]。
CpG ODN根据其独特结构与多样化免疫调节活性的不同,主要分为4种类型。由于外周血单个核细胞对不同结构CpG ODN 的识别和反应不同,具有其种属特异性,导致引起的免疫应答情况有所差异[9],见表1。A 型CpG ODN 主要用于抗肿瘤及病毒治疗[10-11]。C 型CpG ODN 可作为自身免疫疾病的刺激剂[12-13]、疫苗佐剂[13],也可用于抗肿瘤[14]和免疫治疗[15]等,但目前针对P型CpG ODN应用的报道较少。
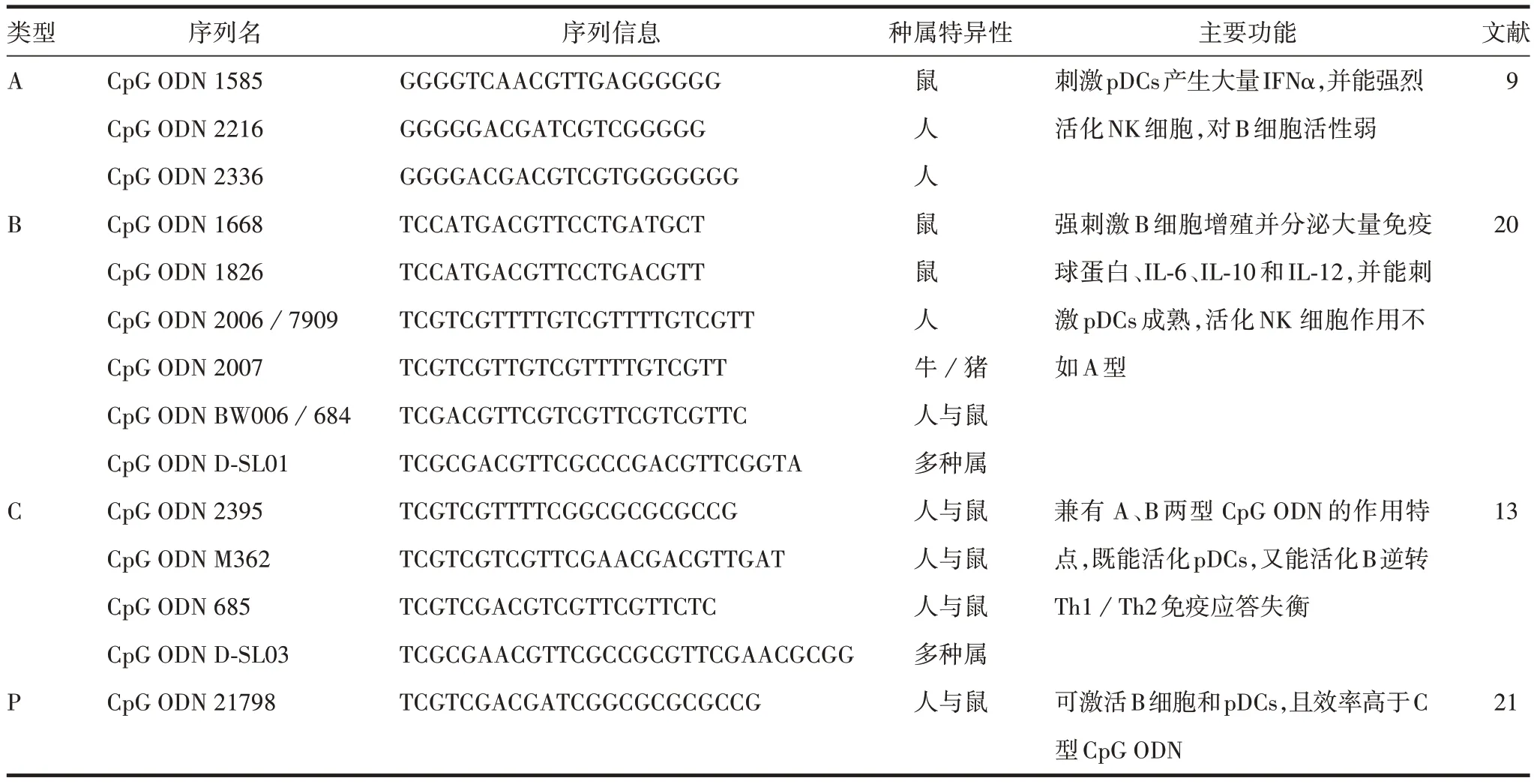
表1 4种类型CpG ODN信息及主要功能Tab.1 Information and main functions of four types of CpG ODNs
VERTHELYI 等[16]最早提出B 型CpG ODN 具有疫苗佐剂的潜力,近年来B 型CpG ODN 作为疫苗佐剂一直是研究热点,且在临床研究中已取得显著成效。其中,美国Dynavax公司以B型CpG ODN 1018为佐剂的乙型肝炎疫苗,已于2017 年被美国食品药品管理局(Food and Drug Administration,FDA)批准上市,该佐剂在临床试验中的安全性及免疫耐受性均良好,且比传统铝佐剂免疫诱导效果更强、更持久[3,17]。三叶草生物制药公司(Clover Biopharmaceuticals)研发的新型冠状病毒候选疫苗SCB-2019,是以CpG ODN 1018及氢氧化铝为疫苗佐剂,Ⅰ、Ⅱ期临床试验表明,该疫苗安全且具有良好耐受性,免疫效果强于新型冠状病毒腺病毒载体疫苗ChAdOx1-S[18-19]。B 型CpG ODN 因对人体良好的安全性及免疫效果,是应用前景广阔的疫苗佐剂,体现出极高的应用价值。
3 B型CpG ODN在细菌性疫苗中的应用
3.1 CpG ODN 1826 在细菌性疫苗中的应用 幽门螺杆菌(Helicobacter pylori,Hp)可导致慢性胃炎和胃溃疡等,是诱发胃癌的危险因素[22]。传统抗生素治疗存在耐药性和复发率高的风险,疫苗是控制感染性疾病最有效的方法。2003年,JIANG 等[23]发现,以CpG ODN 1826 或霍乱毒素(cholera toxins,CT)为佐剂,Hp 全菌抗原为免疫原滴鼻免疫小鼠,CpG ODN可有效诱导免疫应答并与CT 佐剂具有免疫协同作用,从而抑制Hp感染。同年,RAGHAVAN 等[24]仅以CpG ODN 1826 作为免疫原口服免疫小鼠,发现CpG ODN 使小鼠胃黏膜中的CC 趋化因子巨噬细胞炎性蛋白1α(macrophage inflammatory protein 1 alpha,MIP-1α)和受激活调节正常T 细胞表达和分泌因子(regulated upon activation normal T cell expressed and secreted factor,RANTES)及CXC 趋化因子γ 干扰素诱导蛋白10(interferon-γ induced protein 10,IP-10)显著增加,表明仅CpG 基序也可有效诱导机体的先天性免疫应答以对抗胃黏膜Hp 感染。2005 年,SHI 等[25]将Hp 全菌抗原与CpG ODN 1826 佐剂滴鼻免疫C57BL/6 小鼠与INFγ 基因缺陷型小鼠,攻毒试验发现,与缺陷型小鼠相比,免疫后的正常小鼠有70%可抗Hp 感染,随后研究表明,CpG ODN 1862诱导产生的Th1型免疫反应和IFNγ 是抗Hp 感染的关键因素,验证了在自然状态下感染Hp 后会诱导机体偏向Th1 型免疫应答反应[26-27]。此外,CpG ODN 1862 作为Hp 疫苗佐剂时,在Hp 感染机体后的胃肠道中检测出特异性黏膜IgA 抗体应答[28]。Hp 脲酶的B 亚基(urease B subunit,UreB)是一种Hp 疫苗研究中常见候选抗原,BÉGUÉ 等[29]将CpG ODN 1862 佐剂与抗原UreB 以肌内注射方式免疫小鼠后,可获得比铝佐剂或弗氏佐剂免疫小鼠后更高的血清抗体IgG水平。2017 年,LI 等[30]将UreB 分别与CpG ODN 1862、弗氏佐剂及AddaVax 3种佐剂,以皮下注射或滴鼻方式免疫小鼠进行对比,结果显示,CpG 可增强CD4+T 细胞对UreB 刺激后的树突状细胞(dendritic cell,DC)的提呈作用,揭示CpG 作为免疫佐剂的作用机制可能是影响抗原提呈细胞(antigen presenting cell,APC)对抗原的加工和呈递过程等,可见免疫佐剂和接种途径不同均会影响机体对免疫应答的效果。2018 年,GHASEMI 等[31]将编码Hp FliD、UreB、VacA 和CagL抗原的部分基因构建至载体上后,在大肠埃希菌BL21中表达获得融合蛋白(rFUVL),对其免疫原性进行评估,发现加入CpG ODN 1862 佐剂共同免疫小鼠后,引起小鼠脾细胞中IL-4与IL-17水平显著增加,表明该融合蛋白与CpG联合免疫不仅可引起Th1 型免疫应答,还可引发复杂的Th2/Th17免疫反应。揭示除免疫佐剂外,影响辅助性T 细胞类型偏向以及免疫效果的因素还可能与其免疫抗原有关。
此外,在类鼻疽疫苗和鲁氏菌病疫苗研究中,CpG ODN 1862也常被作为免疫佐剂。类鼻疽病是一种由类鼻疽伯克霍尔德菌(Burkholderia pseudomallei)引起的全球流行传染病。WONGRATANACHEEWIN 等[32]发现,在类鼻疽伯克霍尔德菌感染前2 d,小鼠仅肌内注射100µg CpG ODN 1862,即可达到90%保护率,表明仅免疫CpG ODN 可能是治疗败血症的一种新途径。而在布鲁菌病的疫苗研究中,CpG ODN 1862 佐剂与其抗原共同免疫小鼠后,能诱导强烈的Th1 型免疫反应,并对该病原菌具有显著的抑制效果[33-34]。综上,CpG ODN 1826已在Hp疫苗的研究中发挥出优于传统铝佐剂的作用,并且当辅以多抗原时免疫效果更佳。同时,在传统细菌传染性疾病的防治中也具有良好的治疗和应用前景。
3.2 CpG ODN 2006/7909 在细菌性疫苗中的应用炭疽病由炭疽芽孢杆菌(Bacillus anthracis)所致,是一种人畜共患的急性传染病。RYNKIEWICZ等[35]发现,在1970 年美国FDA 批准的炭疽吸附疫苗Bio-Thrax 中添加CpG ODN 7909 佐剂,可显著提高疫苗的免疫原性及保护率。开展的双盲试验结果表明,联合使用BioThrax 与CpG ODN 7909 具有良好的耐受性、可增强免疫特异性反应、缩短免疫过程等优点,可能是预防炭疽杆菌的潜力疫苗。艾滋病患者肺炎发病率为普通人6 倍,临床数据表明,现有7 价(7vPnC)或23 价(23vPnC)肺炎球菌疫苗对于免疫功能低下人群,其免疫原性有待增强[36-37]。SØGAARD等[38]在现有7vPnC 和23vPnC 肺炎球菌疫苗中加入CpG ODN 7909 佐剂,97 名艾滋病患者分别在第0(7vPnC)、3(7vPnC)和9(23vPnC)个月接种含有CpG ODN 7909佐剂的肺炎球菌疫苗,结果显示,在7vPnC中添加CpG 可显著提高疫苗高应答者比例,较单独使用7vPnC 时机体诱导的抗体反应更高、更持久且具有良好的免疫安全性。但在23vPnC 中添加CpG ODN 7909 免疫后,并未增加其免疫原性,可能与23vPnC 疫苗中的抗原不依赖于T细胞有关。革兰阴性菌是医院感染和败血症的主要病原菌,但多种抗生素耐药性的增加,使其临床治疗面临困境。2015年,CROSS 等[39]将B 群脑膜炎球菌(Meningococcus)的外膜蛋白(outer membrane protein,OMP)与大肠埃希菌脱毒脂多糖(detoxified lipopolysaccharide,dLPS)组成抗原,评估加或不加CPG ODN 7909佐剂对18 ~50 岁健康受试者免疫反应的影响。结果表明,加入佐剂安全有效且耐受性良好,还可显著增加特异性抗体血清IgG应答,且其免疫反应可持续至180 d。
此外,CpG基序也可激活鱼类的免疫细胞[40]。嗜水气单胞菌(Aeromonas hydrophila)是黄鲶鱼最常见致病菌,也是一种人畜共患病的病原体。2020 年,CAI 等[41]用CpG ODN 2006 肌内注射方式免疫黄鲶鱼,用嗜水气单胞菌液进行攻毒试验评价,结果表明,CpG 可显著降低机体内IL-1β 水平,提高IFNγ 水平,进而显著降低黄鲶鱼感染率。提示可能因CpG 参与上调机体胃肠道和脾脏中的一种免疫调节物质膜联蛋白(annexin,ANX),从而改善炎症和促进抗感染反应。CpG ODN 2006不仅应用于防治常见鱼类的细菌感染,在冷胁迫下,CpG ODN还可通过调控IL-1β、IL-12 和IFNγ 等细胞因子,诱导冷休克蛋白家族Y box结合蛋白1(Y box binding protein 1,YBX1)、激活核苷酸结合寡聚化结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)和核因子κB(nuclear factor kappa-B,NF-κB)等信号通路,从而发挥低温环境中的鱼类抗嗜水气单胞菌感染作用[42]。
将CpG ODN 7909与现有人用疫苗联用,可增强疫苗免疫效果,且具有良好的免疫安全性和耐受性。在用于防治鱼类细菌感染疾病时,CpG ODN 表现出不同的免疫作用机制,表明对相同CpG 基序免疫作用于不同机体的免疫反应机制仍需深入探讨。
3.3 CpG ODN 2007在细菌性疫苗中的应用目前,CpG ODN 2007 在鸡抗细菌性疾病中进行了大量研究,可对细菌败血症,如大肠埃希菌[43]、鼠伤寒沙门菌(Salmonella typhimurium)[44]和空肠弯曲杆菌(Campylobacter jejuni)[45]提供显著的免疫保护作用。为避免CpG ODN 遭受核酸酶降解,延长其在体内半衰期,同时也为防止局部浓度较高,可将CpG ODN 2007与聚磷腈、脂质体(liposomes,Lip)混合或与多碳纳米管连接。TAGHAVI 等[46]将CpG ODN 2007 与聚磷腈混合免疫雏鸡后,存活率为55%,验证了其抗细菌感染的免疫保护作用。GUNAWARDANA 等[47]用脂质体或碳纳米管制备的CpG ODN 2007可进一步增强免疫保护活性,且无不良反应。TOMPOROWSKI 等[48]也将CpG ODN 2007 以不同方式连接至多壁碳纳米管,仅需0.1 μg 即可保护鸡免受致死量鼠伤寒沙门菌感染。多聚D,L-乳酸-羟基乙酸(poly D,L-lacticco-glycolic acid,PLGA)可将配体吸附至表面或包裹在其内部基质中,是美国FDA、欧洲医药机构批准用于人体药物输送且可生物降解的聚合物。与可溶性形式的CpG ODN 2007 相比,经PLGA 包裹后,在鸡的巨噬细胞和脾细胞中诱导的先天免疫反应更高、更持久[49];14日龄肉鸡免疫25 μg即可显著减少空肠弯曲杆菌的定植[45];鉴定雏鸡肠道微生物群落后发现,免疫组的微生物多样性显著增加,表明CpG ODN 2007的免疫机制可能是通过促进特定微生物群的增殖,减少弯曲杆菌的定植[50]。
为大规模应用于无针操作,研究人员尝试以肺内气雾剂形式递送CpG ODN 2007,喷雾时间持续15和30 min 时,存活率显著提高,在免疫后6 h 即可诱导保护性免疫,持续至少5 d[51]。通过肺内途径的黏膜递送可引起新生雏鸡的全身效应,从而增强对大肠埃希菌败血症的保护性免疫[52],同时其代谢水平也发生变化,拮抗了宿主中微生物的增殖[53]。温度和湿度是喷雾免疫CpG ODN 2007的关键参数,随后该团队研发了商品化的禽类喷雾器,当温度保持在28 ℃或以下,相对湿度40%~60%时,对大肠埃希菌败血症的保护作用更高[54]。将CpG ODN 2007、阳离子Lip和金黄色葡萄球菌抗原(Staphylococcus aureus):凝集因子A(clumping factor A,ClfA)和纤维连接蛋白结合蛋白A(fibronection binding protein A,FnBPA)组成亚单位疫苗制剂,免疫6 ~8 月龄母牛后可产生较高血清IgG抗体水平,且可刺激产生免疫记忆[55]。
CpG ODN 2007 在鸡的抗菌感染中有较系统的研究,针对不同细菌产生的免疫保护作用不同,可通过与细菌抗原联合免疫或用其他制剂包裹后进行免疫,以增强其免疫活性。
3.4 CpG ODN 1668在细菌性疫苗中的应用 将Hp全菌抗原与CpG ODN 1668混合后免疫小鼠,可诱导产生局部和全身性Th1型免疫反应,但不能起到保护作用[56],可能与抗原或不同的免疫方式有关。HIKICHI等[57]对比滴鼻、灌胃和皮内注射3 种不同免疫方式,将β 半乳糖苷酶和CpG ODN 1668 混合后免疫,结果显示,口服免疫后1 周即可产生抗β-gal 的IgA 抗体,但至第2 和4 周,采用滴鼻免疫方式产生的IgA 抗体水平显著高于其他组,表明滴鼻免疫方式更有效,可诱导产生黏膜免疫和全身性免疫。CpG ODN 1668在鱼类的抗菌治疗中也有所研究,CÁRDENAS-REYNA等[58]研究了其对幼龄红鲷鱼抗副溶血性弧菌(Vibrio parahaemolitycus)感染的免疫应答增强作用,免疫后的鱼并未观察到组织病理学损伤,可上调TLR9 和IgM 介导的免疫应答,产生高水平的抗氧化活性,从而利于提高红鲷鱼的抗病能力。LEE等[59]用0.25或0.5 μg CpG ODN 1668 处理细胞后,可显著提高吞噬细胞呼吸爆发活性,注射免疫褐牙鲆鱼后,可提高其抗爱德华菌(Edwardsiella tarda)保护力,攻毒后存活率为83.3%。为研究罗非鱼的抗鳗弧菌(Vibrio anguillarum)感染,JAIKANG 等[60]用重组鞭毛蛋白或将其与CpG ODN 1668联用分别免疫罗非鱼,攻毒后单抗原和联合免疫组的存活率分别为35%和60%,表明在亚单位疫苗中联用CpG ODN 1668 可增强罗非鱼的免疫活性,提高鳗弧菌感染后的存活率。但即使同一类CpG,不同CpG基序的免疫效果也可能不同,CHA等[61]对比了同为B 类CpG 的ODN 1668 和ODN 2007 在幼年比目鱼中的抗爱德华菌感染效果,ODN 2007 处理组的存活率比ODN 1668高15%。综上,CpG ODN 1668 在动物疫病中具有潜在保护效果,但更多的抗菌效果及其免疫机制仍有待进一步研究。
3.5 B 型其他CpG ODN 基序在细菌性疫苗中的应用 CpG ODN BW006(又称CpG ODN 684)是我国自行设计合成的B 型CpG ODN,在动物实验(大鼠、食蟹猴)中具有良好的安全性[62-63],在抗肿瘤、抗感染、现有疫苗制备及免疫程序优化中具有一定应用价值[64]。CpG ODN D-SL001 含有2 种茎环结构(2 个GACGTT 基序),可有效刺激来自不同脊椎动物的外周血单核细胞和脾细胞增殖,具有一定抗乳腺癌作用[65]。但目前关于两种基序在细菌性疾病中的免疫活性和抗菌效果均有待进一步研究。
4 小结与展望
与其他类型CpG ODN 疫苗佐剂相比,B 型CpG ODN 因其良好的安全性和突出的免疫效果,且部分基序已进入临床试验阶段,具有更广阔的应用前景。在研究不同细菌性疾病时,选用的实验动物不同,使用的B 型CpG ODN 基序也会有一定的偏好性,提示研究人员需根据研究对象选择合适的CpG ODN 基序,以达到更好的免疫保护效果。同时,CpG ODN的递送方式、免疫使用剂量、免疫方式等也对其免疫效果产生影响。随着研究及临床数据的积累,相信更多的B型CpG ODN 基序可在细菌性疫苗的研发中发挥出最大优势,为我国细菌感染性疾病的防控及治疗提供策略和帮助。

