单纯疱疹病毒膜融合蛋白相互作用的研究进展
胡婧萍综述,刘存宝审校
中国医学科学院北京协和医学院医学生物学研究所,云南 昆明 650500
单纯疱疹病毒(herpes simplex virus,HSV)属疱疹病毒α亚科,具有独特的4层结构。HSV核心是长约152 000 bp 的线性双链DNA,由二十面体衣壳包围,衣壳外为被膜,内包含二十多种能调节病毒复制周期的重要蛋白,是疱疹病毒的特征性结构,可联络衣壳与囊膜形成完整的病毒粒子[1]。HSV 最外层为脂质双分子层包膜,膜上至少含12 种病毒膜蛋白(gB、gC、gD、gE、gG、gH、gI、gJ、gK、gL、gM、gN)[2-4],对病毒进入宿主细胞及病毒免疫逃逸均至关重要。HSV 有2 种血清型:单纯疱疹病毒-1 型(HSV-1)和HSV-2,它们在氨基酸序列上有83%的同源性[5]。HSV-1 感染可引起人体的口唇炎症,感染严重时可诱发结膜炎导致失明,还可能入侵神经细胞损伤神经系统导致脑炎。HSV-2 为生殖器疱疹的主要病原,患者一旦感染将终生携带该病毒,并且出现周期性的生殖器疱疹性损伤。近年的流行病学研究表明,HSV-2 感染导致的生殖器损伤会提高HSV-2 携带者感染和传播人类免疫缺陷病毒(human immunodeficiency virus,HIV)的风险[6-7],即使是在不引起生殖器损伤的情况下发生病毒脱落也会显著增加HIV的传播机率[8]。
不同的疱疹病毒具有相似的病毒结构,并能通过相似的膜融合机制进入宿主细胞。膜融合需要病毒表面4 种基本糖蛋白(gB、gD、gH 和gL)相互作用,这4种糖蛋白构成的复合物被称为核心融合机制[9-10],它们通常位于病毒包膜表面并能通过级联作用将激活信号从gD 传递至gB,引起gB 发生构象变化,在宿主细胞膜上形成融合孔从而实现膜融合,使病毒能够成功将核衣壳和DNA 释放至宿主细胞中进行新一轮的复制[11]。
近年来对HSV 的研究不断取得突破,本文重点综述了HSV 包膜糖蛋白gB、gD、gH、gL 的结构以及这4 种蛋白在膜融合中相互作用的方式。了解病毒结构和膜融合机制有助于寻找合适的靶点开发药物或疫苗,通过抑制HSV 进入宿主细胞来阻断HSV 的潜伏感染。
1 HSV进入宿主细胞的机制
HSV 在融合蛋白的帮助下可感染包括神经元、上皮细胞和成纤维细胞在内的多种细胞。在目前的研究模型中,HSV 与宿主细胞上的受体特异性结合后可引起病毒表面糖蛋白的构象变化,从而介导HSV进入细胞。作用机制通过2种类似的途径实现:①通过病毒包膜与宿主细胞质膜的直接融合进入细胞(见图1),病毒采用该途径进入成纤维细胞和淋巴细胞;②病毒触发宿主细胞质膜内陷形成内体,通过内吞作用进入细胞质中,病毒采用该途径进入神经元细胞[12]。但具体以哪种途径进入可能取决于宿主细胞表面受体的类型[13],如gB 的配对免疫球蛋白样受体α(paired immunoglobulin-like receptor alpha,PILRα),以及gH-gL的整合素受体αvβ3、αvβ6、αvβ8,可能与病毒非必需包膜蛋白(gC、gE、gG、gI、gJ、gK、gM、gN)的作用有关[14],宿主细胞膜上的受体数量也可能会影响病毒的进入方式。
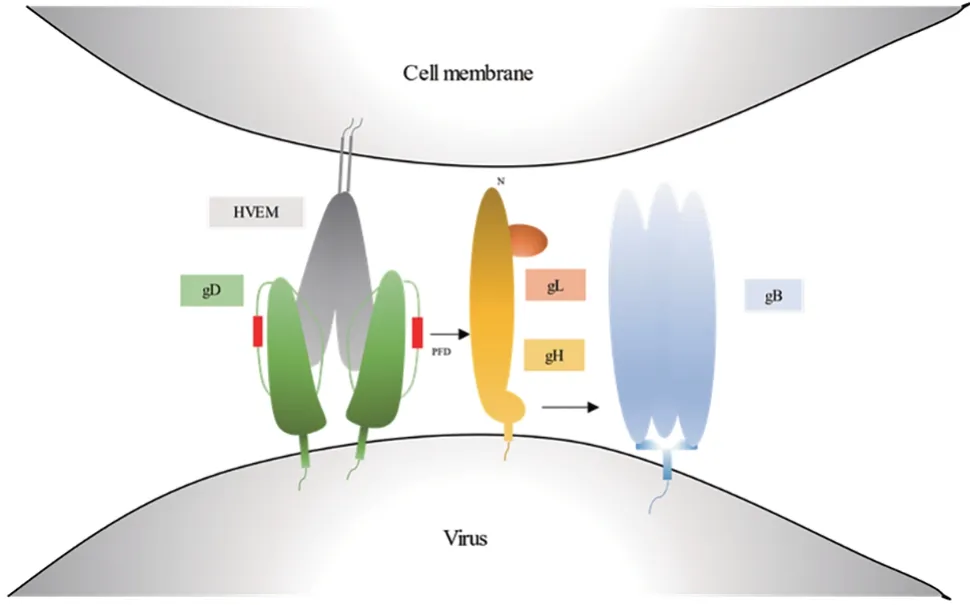
图1 HSV包膜糖蛋白介导融合的基本步骤示意图Fig.1 Schematic diagram of essential steps in HSV glycoprotein-mediated fusion
1.1 gD蛋白与宿主细胞特异性结合 游离状态的病毒与宿主细胞特异性受体结合前,带正电荷的包膜糖蛋白gC、gB会先结合宿主细胞表面带负电荷的硫酸肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)[15-16],这有助于在宿主细胞表面浓缩病毒颗粒[17],但该过程不引发特异性的膜融合。缺失HSPG 受体会降低病毒的结合效率但不会终止感染,说明该过程对于病毒进入宿主细胞不是必须的[15,18-19]。紧接着,结合蛋白gD 发挥作用,识别并结合宿主细胞表面的特异性受体,该过程是启动融合反应所必须的。HSV 包括3 类受体[11,20]:①HVEM,是第一个被鉴定的gD 受体,属于肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)家族,主要在免疫细胞、神经元、上皮细胞、成纤维细胞上表达。②凝集素-1/凝集素-2(nectin-1/nectin-2),是一种Ⅰ型跨膜糖蛋白,属于免疫球蛋白家族。nectin-1 是一种细胞黏附蛋白,可作为大多数α 疱疹病毒的进入受体,在神经元等多种组织中表达,并且在HSV-2 感染中比其他gD 受体发挥更大的作用[21-22];nectin-2 能介导少数HSV-1 和HSV-2 毒株进入宿主细胞。③硫酸乙酰肝素(heparan sulfate,HS)的3-O-磺化衍生物(3-O-sulfonated derivatives of heparan sulfate,3-OST-HS),是HS高度硫酸化形式,主要作为HSV-1的进入受体。
gD 是全长为369 个氨基酸的跨膜蛋白,其胞外结构域的长度为316个氨基酸。从电镜中观察gD的晶体结构可以看到,gD 胞外结构域的核心为V 型的免疫球蛋白样折叠,N-末端和C-末端的延伸围绕在核心的两侧[23-24](见图2A)。N-末端含有受体结合区(receptor binding domain,RBD),能影响gD 与特定的宿主细胞受体结合,因此在HSV 感染中发挥重要作用。C-末端是柔性结构,经过折叠后紧靠gD 核心的V 型区域,C-末端的最后16 个氨基酸残基大致平行于N-末端。
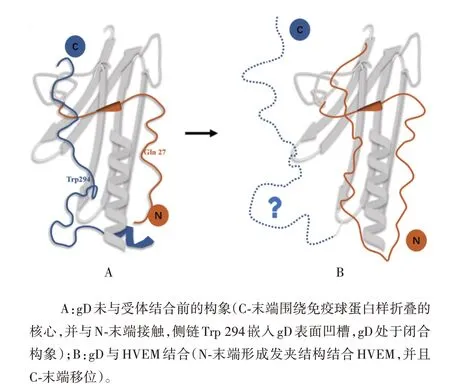
图2 HSV-1 gD的胞外结构域Fig.2 Ectodomain of HSV-1 gD
在gD 与其特异性受体结合前,N-末端一直处于紊乱状态,gD呈现自我抑制的闭合构象以防止gD与gH-gL 或gB 结合而过早激活膜融合反应[23,25],该构象的形成可能有以下几个原因:①C-末端掩藏了gD的受体结合位点;②C-末端的最后16 个氨基酸与N-末端相互作用,同时C-末端上Trp294、Pro291等氨基酸侧链能嵌入gD 表面的凹槽中;③N-末端的Gln27氨基酸侧链可与His295 主链上的氮、氧原子形成氢键限制N-末端和C-末端的相对位置[23]。当HVEM或nectin-1 等特异性受体以开放形式结合gD 的同时C-末端发生移位,gD转换为开放构象,暴露出N-末端上的RBD[21](见图2B)。LAZEAR 等[26]的研究表明,HVEM 可结合至HSV-1gD 的N-末端,使N-末端从无序状态折叠形成稳定的发夹结构,该发夹结构的前16个残基与gD闭合构象中的C-末端占据相同的空间。
另外C-末端的PFD 富含脯氨基酸,可能是融合信号向下游传递的部位[27-28]。有实验设计获得一种将C-末端延伸锁定在gD 核心的突变体,该突变体保留了与受体结合的能力,但未能触发融合[29]。证明gD 的C-末端上可能存在与gH-gL 相互作用的位点,或者是C-末端的移动能暴露出gD上的gH-gL相互作用位点[30]。但由于gD 与gH-gL 之间的作用非常短暂,且亲和力较低,因此尚未观察到α疱疹病毒gD与gH-gL之间的复合物。
1.2 gH-gL 蛋白的信号传递作用 gH-gL 异二聚体是疱疹病毒融合机制中的重要组成部分,在融合过程中的作用较为复杂,且在所有疱疹病毒中均是保守的。目前主流的观点认为,α 类疱疹病毒家族中gH-gL的结构不同于任何已知的融合蛋白,该异二聚体可能发挥信号传递作用,将受体结合信号从gD 传递至gB,而不直接作为融合蛋白[31-33]。
糖蛋白gH 是由UL22基因编码的Ⅰ型糖蛋白,长度为838 个氨基酸,具有较长的胞外结构域、单通道跨膜片段和14 个氨基酸的胞质尾区[34]。HSV-2的gH-gL 晶体结构已被解析,其中gH 的胞外结构域可分为H1、H2、H3、H4四部分[见图3,该图选自结构生物信息学蛋白质数据库(Research Collaboratory for Structural Bioinformatics Protein Data Bank,RCSB PDB),gH-gL的PDB编号为3M1C],在这4个结构域中,H1、H2结构域最不保守,H3结构域中度保守,H4结构域最保守。高度多样化的H1、H2结构域可接收各种激活信号,经过保守的H3、H4结构域的加工处理后,将这些信息传递至gB[35]。gL 是由UL1基因编码的含224 个氨基酸的糖蛋白,缺少跨膜结构域,不能独立锚定在细胞膜上[36],因此,gH 和gL 在HSV 感染的细胞和成熟的病毒体上总是以稳定的1∶1 异源二聚体复合物存在。gH N-末端的H1和H2结构域能夹住gL,同时H1结构域能很好地填充至gL 分子顶部的V形凹槽中,且H1 结构域与gL 相互作用的表面高度互补,说明该异二聚体需要彼此的存在才能正确折叠[37]。在HSV 缺乏gL 的情况下,宿主细胞内合成的gH 可能会滞留在内质网等部位,不会被整合至病毒包膜中;在缺乏gH时,一些gL能从细胞内分泌出来,但不能单独锚定在病毒包膜上,剩下的大量gL 仍以未成熟的形式存在细胞内[38]。gH-gL 异二聚体在形态上表现为以H4结构域为靴头的独特靴形结构,这种结构与任何已知的病毒融合蛋白结构均不相似,表明该异二聚体蛋白不具有直接的融合功能[36],而是作为一种融合调节因子发挥作用[32]。

图3 HSV-1 gH-gL的胞外结构域结构图Fig.3 Structure of HSV-1 gH-gL ectodomain
有研究发现,gH-gL的多个结构域能与不同的中和抗体结合,如mAb LP11能结合至gH-gL的H3结构域,而mAb 52S 结合至复合物另一面的H2 结构域[36,39]。说明gH-gL必须与多种病毒膜蛋白结合,才能将融合信号从gD 传递至gB,且作用的位点不同。目前为止,α 疱疹病毒gD 与gH-gL 复合物的结构尚未观察到,但AVITABILE 等[40]通过双分子荧光互补技术(bimolecular fluorescence complementation,BiFC)在活细胞中观察到gD 与gH-gL 之间直接的相互作用,并且通过BiFC 标签稳定gD 与gH-gL 复合体,结果发现,稳定gD与gH-gL复合体会抑制膜融合作用,说明gD与gH-gL之间的交互作用可能是短暂的。
gH-gL作为一个中间的信号传递分子,与其他病毒膜蛋白的结合是如何实现的一直是一个难题。CAIRNS 等[30]的研究使用不同mAb 结合至gH-gL 上,结果显示gD 与gH-gL 的结合位点可能位于gH 的N-末端和gL 的C-末端,且gH 的N-末端可能会部分封闭gL的C-末端直至与gD 结合。ROGALIN 等[41]的研究证明,gH C-末端的胞质尾区可能与gB的胞质尾区相互作用并调节和激活核心融合机制,gH 的胞质尾区的插入或者截断均会直接影响病毒融合活性。因此,gH可能作为一种楔形物,破坏gB的自我抑制,这可能是gH-gL 传递激活信号的一种方式,即通过物理作用直接与gD 及gB 结合。另外gH-gL 与其高亲和力受体整合素αvβ6、αvβ8 的结合有利于HSV 进入宿主细胞[42],GIANNI 等[43]、LEONI 等[44]的研究发现,gH-gL 可通过与αvβ3 或Toll 样受体2 结合,激活NF-κB 和先天性免疫应答;GIANNI 等[45]研究还发现,αvβ3、αvβ6、αvβ8 的信号能改变HSV 进入宿主细胞的模式,但这些通路与gH-gL 及其他膜蛋白之间信号传递的分子机制是否有关尚不清楚。
另外,PATAKI等[46]利用灵敏度更高的活细胞实时蛋白相互作用检测技术NanoBiT®,提出了gD、gHgL、gB 之间结合的新模型,即活细胞中gD、gH-gL、gB在gD 与受体结合前先形成复合物,复合物的形成独立于融合之前,并且在整个融合过程中保持不变。这与先前认为gD 与特异性受体结合后再依次结合gH-gL、gB 的途径有所不同,具体以哪种方式发挥作用目前尚不清楚。
1.3 gB蛋白介导膜融合作用 gB是一种Ⅲ类膜融合蛋白,是疱疹病毒中最保守的膜融合糖蛋白。gB 最初以融合前构象锚定在病毒包膜上[47],在收到上游传递的激活信号后,gB 发生构象变化重新折叠成融合后构象(见图4),融合后构象能将自身疏水性的残基插入宿主细胞膜中促进融合孔的形成[48],从而驱动病毒包膜和宿主细胞膜融合。有研究认为,该融合过程所需的能量来自于融合前的高能量构象重新折叠成融合后的低能量构象这一过程所释放的[49]。

图4 gB蛋白融合前和融合后的构象示意图Fig.4 Conformational diagrams of gB protein pre- and postfusion
融合后构象的X 射线晶体学结构表明,gB 胞外结构域的晶体结构类似三聚体尖峰或者棒状结构,每个亚基由5 个排列成发夹形状的不同结构域组成[50]。这些结构域与其他亚基上的等效对应的结构域相互作用,形成稳定的三聚体结构[4]。其中结构域Ⅰ包含2 个融合环,靠近跨膜段,称为融合域(fusion domain)[51];结构域Ⅱ上含有与gH-gL相互作用位点,因此称其为gH-gL 结合结构域(gH-gL binding domain);结构域Ⅲ由α-螺旋组成,形成了gB 的特征性三聚体螺旋中心;结构域Ⅳ位于gB 融合后形式的顶部,这个部位也称为冠结构域(crown domain),能在宿主细胞上形成疏水的孔道介导gB与宿主细胞的融合[24];结构域Ⅴ由一段长的延伸部分组成,能填充至其他2个原聚体间的凹槽中,将原聚体连接在一起[24,51](见图5,该图选自RCSB 蛋白数据库,gB 蛋白的PDB 编号为5V2S)。其中结构域Ⅱ和Ⅰ的上部区域包含2个串联排列的pleckstrin 同源性结构域(pleckstrin homology,PH),其可能具有结合脂质的功能[9,52]。

图5 HSV-1 gB的结构图Fig.5 Structure of HSV-1 gB
在gB 中,除了胞外结构域外,还包含3个重要的区域:MPR、TMD和CTD,MPR-TMD-CTD 在胞外结构域的下方形成了一个独特折叠的疏水性三聚体基座,这些结构域约占gB 单体多肽的20%,很大程度上影响了胞外结构域的结构和功能,并且可与膜发生相互作用(见图5)。其中CTD 结构对gB 的折叠和表达至关重要,CTD 的突变可能会影响整个融合过程[53]。COOPER 等[54]研究发现,CTD 能稳定gB 融合前构象并抑制gB 的融合活性,提出了HSV 融合的钳楔模型。CTD 作为钳夹以某种高能量的形式将gB的胞外结构域限制在其高能预融合形式,当gD 与其特异性受体结合后激活gH-gL 二聚体,激活的gH-gL胞外结构域与gB的胞外结构域相互作用,gH的胞质尾区充当楔形物破坏CTD 核心或破坏其与膜的相互作用,不稳定的钳夹就失去了对胞外结构域的控制[34]。解除抑制的gB 胞外结构域继续重新折叠成热力学上有利的融合后构象,而CTD 则恢复至其初始构象,在这个变化过程中,该三聚体不需完全分离。病毒和细胞的融合水平与gH的胞质尾区的长度有关,gH 胞质尾区的截短会导致细胞融合水平降低[55]。另外,为了影响胞外结构域的构象,CTD 必须通过介入MPR和TMD传达其自身的状态,因此TMD螺旋延伸进入CTD 空间,可能作为一个中间体将CTD 的运动信息有效传输至TMD[48]。但信息从CTD 传输至MPR这一过程的具体机制尚不清楚。
除了通过gH-gL 的激活外,gB 还需与特定受体结合才能实现HSV的融合。PILRα主要介导HSV-1进入宿主细胞,该受体主要在免疫细胞中表达,如单核细胞、巨噬细胞及树突状细胞等,是第1 个被鉴定的gB受体。在中国仓鼠卵巢细胞(Chinese hamster ovary,CHO)试验中发现,gB与PILRα的结合能将HSV-1的进入途径从内吞转变为直接融合[13]。另外,gB 的受体还包括位于神经胶质细胞表面的髓鞘相关糖蛋白(myelin-associated glycoprotein,MAG)[56]以及主要在细胞质中表达的非肌肉肌球蛋白重链-ⅡA(nonmuscle myosin heavy chain-ⅡA,NMHC-ⅡA)[57]。
2 总结与展望
科学技术的进步使HSV 的感染机制逐渐清晰,冷冻电子显微镜成像技术的应用展示了gB 蛋白的融合前构象,实时蛋白相互作用检测技术NanoBiT®有望揭示gD、gH-gL和gB蛋白激活的先后顺序,未来的结构蛋白和晶体学研究将继续探索病毒糖蛋白间的相互作用位点和构象变化。除了通过复杂的作用机制进入宿主细胞,HSV 还具有高超的逃避免疫和药物治疗的能力,因此HSV 在很长一段时间内仍可能是人类所面对的棘手病原体之一。但对HSV进入宿主细胞的一些结构细节的解析,将有助于设计更好、更有效的疫苗。如对gB融合前结构的解析有助于设计能将gB 锁定在其融合前结构的亚单位疫苗[47],避免gB 蛋白在宿主细胞膜上形成融合孔从而阻断膜融合。另外,由于所有疱疹病毒均需gH-gL和gB 3种蛋白,HSV 疫苗的成功研发不仅对预防HSV 感染有重要意义,还可能为其他疱疹病毒疫苗的开发提供思路。

