孢子丝菌病血清学诊断的研究进展
崔岩 石滢 Mulubwa Changa Chibesa 李珊山
(吉林大学第一医院,长春 130021)
孢子丝菌病(sporotrichosis)是我国最常见的慢性真菌病,主要侵犯皮肤、皮下组织及附近淋巴管。目前认为,该病由致病性孢子丝菌(pathogenic clade of the genusSporothrix)感染所致,其主要包括申克孢子丝菌(S.schenckii),巴西孢子丝菌(S.brasiliensis)以及我国主要流行株球形孢子丝菌(S.globosa)[1]。
目前孢子丝菌病常用的诊断方法包括真菌培养和皮肤组织病理检查,这两种方法不仅所需时间较长。因快速、技术门槛低等优势,血清学诊断的适用疾病不断通过研发而拓展,如β-1,3-D-葡聚糖(G试验)、曲霉半乳甘露聚糖(GM实验)、隐球菌荚膜多糖(GXM)等检测,已在临床中广泛应用[2]。尽管尚无商品化的孢子丝菌病血清学检测试剂盒,但是研究人员目前已发现了可适用于该病检测的抗原靶点,并在临床试验中验证了其有效性。本文将对孢子丝菌抗原及孢子丝菌病血清学诊断的研究进展进行综述。
1 鼠李甘露聚糖肽
1971年,Lloyd等[3]首次从申克孢子丝菌酵母细胞和其培养基中提取了一种全新结构的肽多糖,即鼠李甘露聚糖肽(peptidorhamnomannan,PRM)。经单糖分析发现,PRM中主要含有D-甘露糖(50%)和L-鼠李糖(33%)以及少量的半乳糖(1%)和多肽(16%),其中鼠李糖和甘露糖结合形成鼠李甘露聚糖复合物的结构是首次发现。琼脂扩散实验显示,PRM(特别是其中的多糖成分)可以与孢子丝菌病患者的血清发生特异性凝集,提示PRM作为血清学检测抗原靶点的应用前景。随后10年,研究人员不断对孢子丝菌细胞壁多糖的结构深入研究。Travassos等[4]分析申克孢子丝菌细胞壁肽聚糖结构发现,N-糖链中的主链为α-D-Manp-(l→6)- D-Manp,侧链则有两种α-L-Rhap-(l→2)- α-L-Rhap-(l→3)-D-Manp- (l →和α-L-Rhap-(l→3)-D-Manp。免疫沉淀结果显示,这两种侧链都具有抗原性。此外,利用β-消除的方法,Lopes-Alves等[5]首次分析了PRM中的O-糖链的结构,发现存在以下的寡糖结构:Man(αl→2)Man-ol, Rha(αl→3)Man(αl→2)Man-ol, Rha(αl→4)GlcA(αl→2)Man(αl→2)Man-ol和Rha(αl→4)[Rha(αl→2)] GlcA(αl→2) Man(αl→2)Man-ol。抗原性试验显示,O-糖链的寡糖对维持PRM的免疫原性具有重要的作用,其中的抗原表位[6]存在于四糖和五糖中。尽管后续又从Pseudallescheriaboydii[7]、Rathayibacterspp.等[8]微生物细胞壁中分离出了鼠李甘露聚糖,但是其中的糖苷键结构存在差异,表明PRM作为抗原可具有良好的特异性[9]。
2 Sporothrix schenckii ConA binding fraction (SsCBF)
为了更加特异并简化提取PRM的步骤,Penha首次利用刀豆蛋白A(ConA)亲和层析柱,从申克孢子丝菌酵母细胞中获得了PRM,并将可与ConA亲和层析柱结合的组份定义为SporothrixschenckiiConA binding fraction(SsCBF)[10]。研究者将SsCBF作为ELISA的底物,以检测孢子丝菌病患者血清中的特异性IgG。在受试的35份孢子丝菌病患者中,血清滴度为1∶400时,阳性率为100%,而对其他真菌感染的患者无交叉性。通过β-消除的方法证明SsCBF的特异性表位存在于四糖和五糖,这与之前报道结果的一致。在随后的研究中, 研究者利用同样的方法分别开展了两项大样本血清学检测,其中1项检测了92例孢子丝菌病患者,其敏感性为90%,特异性为80%;另1项研究检测了177例孢子丝菌病患者, 其敏感性为89%, 特异性为82%[12]。这两项研究的样本均涵盖了孢子丝菌病的各种临床型别,而且这种方法也可以适用于脑脊液检测。随访发现,在部分患者中,血清中特异性IgG的滴度会随着患者疾病的转归而降低。在临床病例中,有学者将这种方法作为孢子丝菌感染的辅助诊断,但仅是个案报导[13-14],其结果与真菌培养一致。
SsCBF的检测同样适用于猫孢子丝菌病的诊断,在1份30例猫孢子丝菌病血清检测的报道显示,其敏感性为90%,特异性为96%[15]。由于猫孢子丝菌病主要因巴西孢子丝菌感染导致,Baptista等[16]利用SsCBF检测了15例由巴西孢子丝菌感染的猫孢子丝菌病,结果显示,15例中只有1例呈现假阴性反应,提示来自申克孢子丝菌的CBF组分也可以对巴西孢子丝菌病感染的患者或动物进行检测,也表明寡糖表位可能广泛存在于巴西孢子丝菌、申克孢子丝菌和球形孢子丝菌中。
3 胞外抗原
与CBF的获得相比,来自菌体分泌胞外抗原(exoantigen)的获取工艺流程更为简单:通过对孢子丝菌菌丝相或酵母相的菌液灭活、过滤、冻干后,即可获得。胞外抗原的靶点主要是其多组分的可溶性蛋白,因蛋白表达受多种因素影响,来自不同课题组的蛋白范围差异较大,分子量包括110~120 kDa、90 kDa、80~85 kDa、70~76 kDa、60 kDa、40~48 kDa、30~38 kDa(考虑到实验结果分别来自不同的报道,蛋白分子量的差异可能是由于估算导致的,因而部分蛋白用范围表示)[17-22]。尽管胞外抗原的蛋白谱变化较大,但特异性蛋白靶点较为集中,如球形孢子丝菌为菌丝相35 kD蛋白、申克孢子丝菌为菌丝相40 kD、70 kD和90 kD蛋白和巴西孢子丝菌的酵母相85 kD蛋白[17-18,20,22-23]。
Scott等[17]以申克孢子丝菌胞外抗原作为靶点,利用ELISA法检测了孢子丝菌病患者血清中IgG,结果显示40例孢子丝菌病患者血清滴度为128~65200,健康人和非孢子丝菌真菌病患者血清滴度均不大于64,三组的阳性率分别为100%(40/40),20%(20/100)和18%(54/300)。尽管上述研究中异种真菌病患者血清阳性率较高,但结果提示ELISA作为一种定量检测手段,可以增加稀释倍数和提高cutoff值,以提高特异性。利用这种方法,Almeida-Paes等[24]将血清4000倍稀释,cutoff值设为0.582时,ELISA的敏感性为97%,特异性为89%。另一项研究[25]也显示了类似的结果,敏感性和特异性分别为100%和98%(血清经500倍稀释)。
有趣的是,来自申克孢子丝菌的胞外抗原也可用于猫孢子丝菌病的检测,敏感性和特异性分别为96%和98%,检测效果优于SsCBF-ELISA[15],这提示巴西孢子丝菌和申克孢子丝菌的胞外抗原抗原表位相同,这可能来自于胞外抗原中糖蛋白的糖苷键或同源蛋白。
4 Gp70
在寻找可用于孢子丝菌病血清学诊断分子靶点的过程中,研究者发现无论在酵母相中,胞外[23, 26]、细胞壁[27-28]或总蛋白[29-30]均存在具有抗原性的分子量约为70 kD的糖蛋白(Gp70)[26, 31]。这种糖蛋白存在N-糖链和O-糖链连接位点[27, 32]。通过免疫印迹2D电泳显示,申克孢子丝菌的Gp70存在6个亚型,他们的分子量相近,质谱鉴定分析比对结果显示均为三羧酸环化酶[30, 32-33]。在巴西孢子丝菌和球形孢子丝菌中[33],也存在该蛋白,但是他们的分子量存在差异。巴西孢子丝菌的三羧酸环化酶的分子量为60 kD,球形孢子丝菌的分子量为70kD[29, 32],分子量的差异可能与氨基酸组成、糖基化修饰或是翻译后加工有关。见图1。
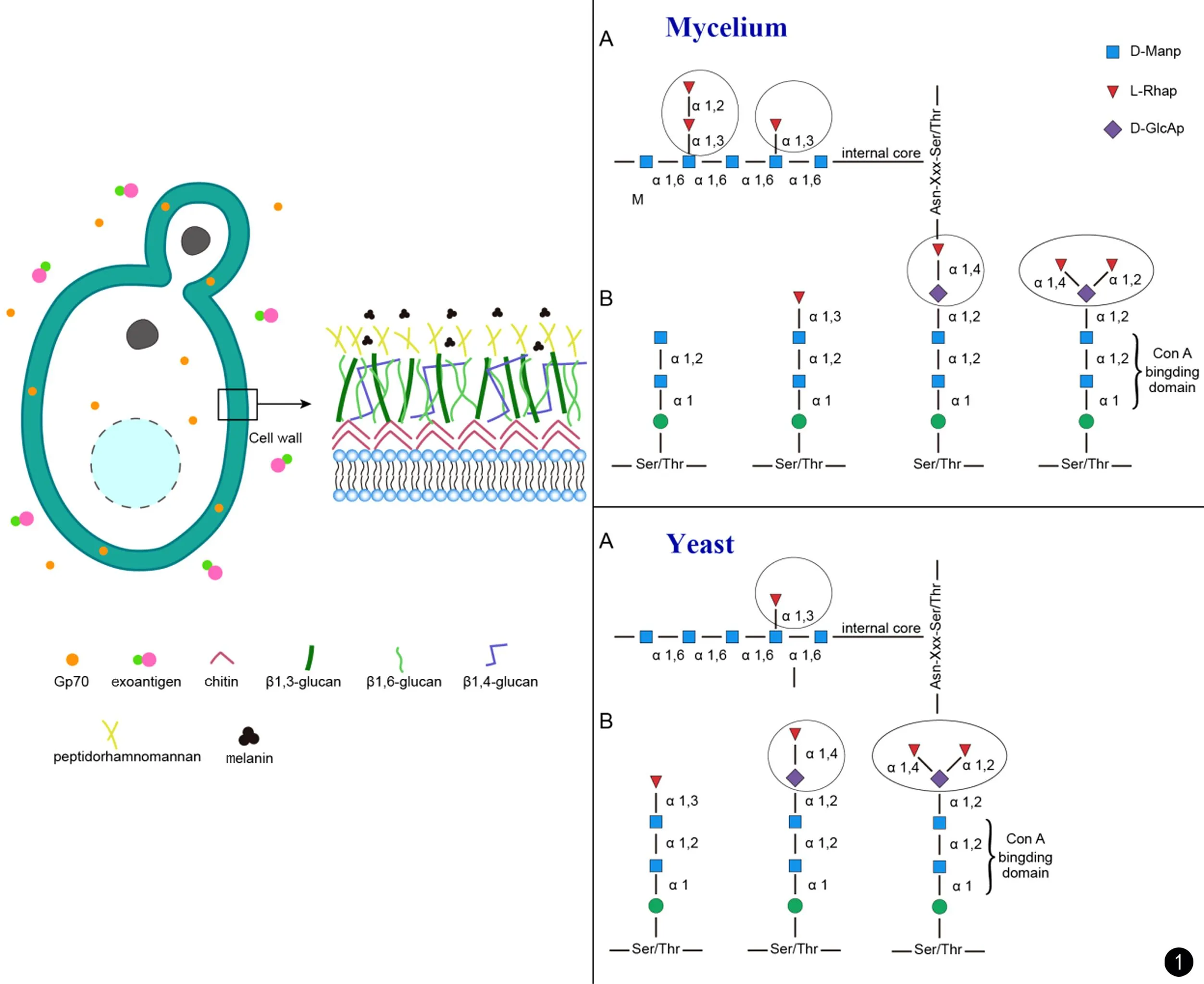
图1 孢子丝菌病血清学诊断的抗原靶点示意图. 孢子丝菌细胞壁主要由黑素(melanin)、鼠李甘露聚糖肽(peptidorhamnomannan,PRM)、β-1,3葡聚糖(β-1,3-glucan)、β-1-4葡聚糖(β-1,4-glucan)、β-1-6葡聚糖(β-1,6-glucan)以及几丁质(chitin)组成。胞外抗原(exoantigen)是孢子丝菌分泌的可溶性蛋白;Gp70可存在于细胞外、细胞壁或细胞内。PRM是细胞壁最外层的主要抗原表位,右侧示意图展示了孢子丝菌菌丝相(mycelium)和酵母相(yeast)的N-糖苷键(A)和O-糖苷键(B)的糖苷键结构Fig.1 Antigen target diagram for serological diagnosis of sporotrichosis. The cell wall of Sporothrix primarily consisted of melanin, peptidorhamnomannan (PRM), β-1, 3-glucan, β-1,4-glucan, β-1, 6-glucan, and chitin. Exoantigens were soluble proteins secreted by Sporothrix. Gp70 could be found extracellularly, in the cell wall, or intracellularly. PRM represented the major antigenic epitope in the outermost layer of the cell wall. The right-hand diagram illustrated the glycosidic bond structures of N-glycosidic bonds (A) and O-glycosidic bonds (B) in the mycelial and yeast phases of Sporothrix
Gp70可被申克孢子丝菌感染的孢子丝菌病患者、猫或诱导感染的小鼠血清识别,表明Gp70具有跨种属的免疫原性,可刺激机体产生特异性抗体[22, 28-29]。且申克孢子丝菌的Gp70也可被由球形孢子丝菌和巴西孢子丝菌感染的宿主血清识别[29-30]。但是Gp70却不能识别环境分支的孢子丝菌,如墨西哥孢子丝菌导致的感染[30]。尽管多份报道显示Gp70具有良好的免疫原性并且其单克隆抗体的免疫保护作用,目前缺乏利用天然的Gp70作为血清学诊断的评估报道,这与无法获得足够的Gp70有关。因此,Martínez-lvarez等[34]通过原核表达载体Escherichiacoli得到了重组的Gp70。重组Gp70的分子量为43 kD,与去糖基化天然Gp70分子量相近。重组Gp70和去糖基化Gp70可以与天然Gp70蛋白的单克隆抗体mAB P6E7结合,表明重组的Gp70不仅保留了抗原表位,而且mAB P6E7的抗原决定簇来自于氨基酸序列。但是重组Gp70-ELISA检测孢子丝菌病患者血清的敏感性仅为69.7%,远低于SsCBF或胞外抗原的方法。
5 小 结
近30年来,随着动物源性传播链的加入使孢子丝菌病发病率逐渐升高,传播速度不断加快,并伴有全球爆发流行趋势,孢子丝菌病已成为人类和动物健康不可忽视的潜在威胁[1]。准确、快速的诊断方法是孢子丝菌病及时治疗和遏制传播的有效手段。已有的研究结果表明了血清学诊断在孢子丝菌病中的可行性,其中SsCBF是目前具有应用前景的靶点。一方面,SsCBF的抗原表位以O-糖链为主,其独特的糖苷键是其他病原真菌中未见的,降低了交叉反应;另一方面,Con A亲和层析柱为SsCBF的制备提供了稳定、批量生产的条件。目前商品化的真菌血清学检测试剂盒,其抗原同样来自于多糖,如β-1,3葡聚糖、半乳甘露聚糖、荚膜多糖等,这也为开发孢子丝菌的血清试剂盒奠定了良好的工艺基础。
目前研究报道的血清学检测技术方法主要以ELISA为主,尽管免疫扩散、乳胶凝集法敏感性也较高,但是ELISA可以通过预设cutoff值,实现对检测值进行定量,参数可变性强,而且可对多种抗体联合检测。利用ELISA进行早期检测,可缩短诊断时间,并可降低真菌培养的假阴性病例。现有研究结果表明,由于不明确抗体特异性位点或抗原表位,与异种真菌感染血清的交叉反应是导致ELISA产生假阳性的最主要原因。Almeida-Paes等[35]以胞外抗原作为靶点,同时检测了患者血清中IgA、IgM、IgG等抗体,结果显示当两者或三者同时阳性时,可有效排除交叉反应导致的假阳性。另外,还可以通过添加特异性缓冲液,降低抗体和抗原的低亲和力结合,降低交叉反应[36]。未来,在ELISA检测体系成熟的基础上,可以考虑以纸层析开展的检测,如胶体金或荧光标记,使孢子丝菌病的诊断更为快速和便捷。
孢子丝菌病血清学诊断方法的商品化,仍有诸多工作需要开展,如球形孢子丝菌感染患者大样本检测、患者不同群体的有效性、免疫球蛋白单独或联合检测等。综上,在未来应用中,血清学诊断不仅可以作为真菌培养或病理检测的辅助诊断,而且血清学诊断还可用于监测病情的发展,甚至是曾感染情况的排查。

