不同浓度伏立康唑对人急性单核细胞白血病细胞株来源巨噬细胞免疫功能的影响
滕国杰 聂秀红
(首都医科大学宣武医院呼吸与危重症医学科,北京 100053)
既往研究表明,多种抗真菌药物除了对真菌的杀灭作用外,还具有免疫调节作用,其可能通过宿主免疫细胞信号通路,调节炎症反应,影响免疫细胞对真菌的作用。两性霉素B可以促进炎性细胞因子释放[1],而氟康唑可以减少曲霉菌丝刺激后人全血IL-6、IL-8和TNF-α的释放[2]。伏立康唑作为三唑类抗真菌药物,也具有免疫调节作用。Simitsopoulou等[3]的研究显示伏立康唑通过TLR2的上调来增强吞噬细胞的促炎程序,Fidan等[4]发现,伏立康唑作用下,白念珠菌刺激的外周血单个核细胞的IL-2、γ干扰素(interferon γ, IFN-γ)和IL-6水平显著增加。在伏立康唑作用下,烟曲霉诱导THP-1细胞更加显著的炎症基因表达,包括干扰素-γ和TNF-α等基因的表达明显增强,释放TNF-α、IL-1β明显增加[5]。
伏立康唑浓度差异是否会对免疫状况存在不同影响,目前国内外文献鲜有报道。为此,本研究观察THP-1来源巨噬细胞加入不同浓度伏立康唑及灭活烟曲霉菌液,检测细胞培养上清液中TNF-α、IL-1β、IL-10分泌水平及细胞膜表面模式识别受体TLR2、TLR4、Dectin-1表达的变化,探讨伏立康唑药物浓度对巨噬细胞免疫功能的影响差异。
1 材料与方法
1.1 材料
细胞及试剂 人急性单核细胞白血病细胞株(human acute monocytic leukemia cell line, THP-1细胞株)来源于中科院细胞库,RPMI1640培养基(美国Gibco-Invitrogen 公司),胎牛血清(fetal bovine serum, FBS)(美国Gibco-Invitrogen 公司),青霉素-链霉素-二抗溶液(美国Gibco-Invitrogen 公司),肉豆蔻酸佛波醇乙酸酯(phorbol-12-myristate-13-acetate, PMA)(中国碧云天试剂公司),伏立康唑(美国辉瑞公司生产),二甲基亚砜(dimethyl sulfoxide, DMSO)(美国Sigma公司)。
烟曲霉菌液的制备 烟曲霉感染患者的分离株,接种在沙堡弱葡萄糖琼脂培养基上于37 ℃和5% CO2培养箱下培养5 d,以形成分生孢子。分生孢子通过70 nm细胞筛进行过滤,使用RPMI 1640重悬分生孢子,在37 ℃和5%CO2的完全培养基中进行孵育,12 h部分分生孢子形成菌丝,进行收集,将孵育后的烟曲霉分生孢子和菌丝形成的菌液在玻璃管中于120 ℃高压灭活30 min[6-7]。
伏立康唑药液配置 伏立康唑粉剂微量电子天平称取10 mg,无菌操作下溶解于二甲基亚砜,国外文献报道二甲基亚砜对细胞无明显毒性作用[8],加入无内毒素蒸馏水补足至1 mL,进行分装,使用时加入完全培养基,倍比稀释至所需浓度。
1.2 方法
THP-1来源的细胞诱导为巨噬细胞 文献报道,THP-1细胞使用100 ng/mL佛波酯(PMA)诱导48 h分化为巨噬细胞[9],具有与人外周血单核细胞来源巨噬细胞类似的功能[10]。受不同微环境的影响,使用PMA诱导THP-1细胞为巨噬细胞,该细胞可以向M1表型进一步分化,也可以向M2表型进一步分化[11]。用100 ng/mL PMA在37 ℃诱导THP-1细胞48 h,倒置显微镜动态观察细胞变化。培养48 h后显微镜下观察细胞形态改变,细胞由悬浮细胞改为贴壁、并出现聚集、伪足伸出。诱导THP-1细胞形成巨噬细胞。将细胞加入0.02%乙二胺四乙酸溶液,使细胞脱离贴壁,离心收集。
CCK-8法检测不同浓度伏立康唑联合灭活的烟曲霉菌液对THP-1来源巨噬细胞的毒性 THP-1细胞诱导形成的巨噬细胞,以每孔100 μL培养液中包含5×103个细胞的浓度,接种于96孔培养板。每个孔加入浓度分别为0.25、0.5、1、2、4、8、16、32、64 μg/mL的伏立康唑后,再加入浓度为5×102个/mL的灭活烟曲霉液,并且设置仅含有THP-1来源巨噬细胞和灭活烟曲霉菌液的对照孔。分别37 ℃、5%CO2培养箱中孵育6、12、24 h。之后每孔加入10 μL的CCK-8溶液培养2 h后,用酶标仪在450 nm处测量吸光度值。实验重复3次,取平均值。
不同浓度伏立康唑联合灭活烟曲霉菌液体外刺激THP-1来源巨噬细胞 每孔1 mL培养基中包含1×106个THP-1细胞形成的巨噬细胞,接种于2个6孔培养板。孵育过夜。在培养板中,第1孔作为空白孔,其余各孔中加入终浓度为105个/mL的灭活烟曲霉菌液之后,再加入浓度分别为0、0.25、0.5、1、2、4、8、16、32、64 μg/mL的伏立康唑。并且设置仅含有THP-1来源巨噬细胞和灭活烟曲霉菌液的对照孔,在37 ℃和5%CO2培养箱孵育6 h[12]。培养后,收集培养板中每孔的上清液测定培养上清液中的细胞因子TNF-α、IL-1β、IL-10的水平。收获贴壁的巨噬细胞,流式细胞仪检测细胞表面的TLR2、TLR4、Dectin-1表达。实验重复3次,取平均值。
流式细胞检测体外培养细胞表面TLR2、TLR4、Dectin-1表达 流式管中加入荧光标记抗体:BD Pharmingen[TM]PE Mouse Anti-Human CD369 (Clec7A)(Dectin-1),BD Horizon[TM]BB515 Mouse Anti-Human CD282(TLR2),BD OptiBuild[TM]BV421 Mouse Anti-Human CD284(TLR4),各5 μg,加入待检测的细胞,同型对照管加入同型抗体:BD Pharmingen[TM]PE Mouse IgG2a κ Isotype Control,BD Horizon[TM]BB515 Mouse IgG1 κ Isotype Control, BD Horizon[TM]BV421 Mouse IgG2a κ Isotype Control,各5 μg,震荡混匀,应用BD FACS Canto型流式细胞仪进行细胞表面TLR2、TLR4、Dectin-1的表达检测。通过Flowjo软件进行分析,计算表达的平均荧光强度。
1.3 统计学处理
采用SPSS 20.0软件(IBM, Armonk, NY, USA)进行统计分析,正态分布的计量资料以均数±标准差表示,组间的比较采用Dunnett-t检验。非正态分布的计量资料以中位数及四分位数表示,组间比较采用Kruskal-Wallis检验。统计学假设检验采用双侧检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 THP-1诱导形成巨噬细胞
THP-1细胞呈类圆形,在完全培养基中悬浮生长。加入100 ng/mL的PMA后24 h后完全贴壁生长,细胞形态开始出现改变;48 h后,细胞呈现巨噬细胞特征、表现,形态不规则,胞体增大、胞浆疏松出现空泡、细胞表面伸出伪足,包膜周围可见突起,形成THP-1来源巨噬细胞,见图1。

图1 加入100 ng/mL的PMA刺激48 h THP-1细胞分化为巨噬细胞(×40) 图2 不同浓度伏立康唑联合灭活烟曲霉菌液对THP-1来源巨噬细胞的毒性:作用12 h:* P<0.05,作用24 h:# P<0.01(与未加入伏立康唑的对照组相比) 图3 不同浓度伏立康唑联合灭活烟曲霉菌液刺激THP-1来源巨噬细胞,培养上清液中TNF-α、IL-1β、IL-10浓度。* P<0.05,# P<0.01(与IAFL组相比) 图4 流式细胞仪检测THP-1来源巨噬细胞膜表面受体表达Fig.1 THP-1 cells were stimulated with 100 ng/mL PMA for 48 h and differentiated into macrophages (×40) Fig.2 Toxicity of voriconazole combined with IAFL to THP-1-derived macrophages: 12 h: * P<0.05, 24 h: # P<0.01 (compared with the control group without voriconazole) Fig.3 Levels of TNF-α, IL-1β and IL-10 in culture supernatant of different concentrations of voriconazole combined with IAFL stimulated THP-1-derived macrophages, * P<0.05, # P<0.01 (compared with IAFL group) Fig.4 The expression of THP-1-derived macrophage membrane surface receptor was detected by flow cytometry
2.2 不同浓度伏立康唑联合灭活烟曲霉菌液对THP-1来源巨噬细胞的毒性
THP-1来源巨噬细胞中加入不同浓度伏立康唑联合灭活烟曲霉菌液,分别作用6、12、24 h,使用CCK-8法计算细胞相对活力,绘制成活力曲线,见图2。
结果显示,与对照组相比,作用于6 h,在伏立康唑浓度为64 μg/mL时,对细胞抑制作用为4.30%±6.1%(P>0.05),作用12 h,伏立康唑浓度64 μg/mL时,显示19.9%±1.6%的抑制作用(P<0.05);作用24 h后,伏立康唑浓度8 μg/mL及64 μg/mL时,显示23.1%±7.0%和28.7%±8.1%的抑制作用(P均<0.01)。结果表明,随时间延长和伏立康唑浓度升高,伏立康唑对THP-1来源巨噬细胞毒性作用显示出随时间和剂量依赖的增强。
2.3 不同浓度伏立康唑联合灭活烟曲霉菌液体外刺激THP-1来源巨噬细胞培养上清液中TNF-α、IL-1β、IL-10浓度变化
文献报道,人巨噬细胞细胞在受到外界刺激后,TNF-α等炎症因子释放在6 h内达到峰值[12],本研究最终选择6 h作为细胞功能研究的时间。
在对照组中(LAFL组:仅含THP-1来源巨噬细胞和灭活烟曲霉菌液),培养上清液中TNF-α、IL-1β浓度分别(471.94±56.51) pg/mL和(110.56±15.04) pg/mL,加入不同浓度伏立康唑后,上清液中TNF-α、IL-1β浓度逐渐升高,在伏立康唑浓度4~64 μg/mL之间时, TNF-α、IL-1β浓度较对照组出现显著升高(P均<0.05)。在伏立康唑的浓度为16 μg/mL和8 μg/mL时,TNF-α和IL-1β浓度分别达到峰值,为(728.32±113.58) pg/mL和(210.08±41.39) pg/mL。不同伏立康唑浓度组之间IL-10浓度差异均无统计学意义(P>0.05),见图3。
2.4 不同浓度伏立康唑联合灭活烟曲霉菌液体外刺激THP-1来源巨噬细胞膜表面TLR2、TLR4、Dectin-1表达
在对照组中(LAFL组:仅含THP-1来源巨噬细胞和灭活烟曲霉菌液),流式细胞仪检测巨噬细胞膜表面模式识别受体TLR2、TLR4的平均荧光强度位于较低水平。加入不同浓度伏立康唑后,细胞膜表面TLR2、TLR4的平均荧光强度逐渐增强,在伏立康唑浓度为1~64 μg/mL时,TLR2、TLR4的平均荧光强度与对照组相比显著增强(P<0.05),在伏立康唑浓度为4 μg/mL时,细胞膜表面TLR2、TLR4的平均荧光强度达到峰值。模式识别受体Dectin-1对伏立康唑浓度变化更为敏感。伏立康唑浓度在0.5~64 μg/mL时,Dectin-1的平均荧光强度与对照组相比出现显著升高(P<0.01),在伏立康唑浓度为1 μg/mL时,Dectin-1的平均荧光强度即达到峰值,见图4、5。
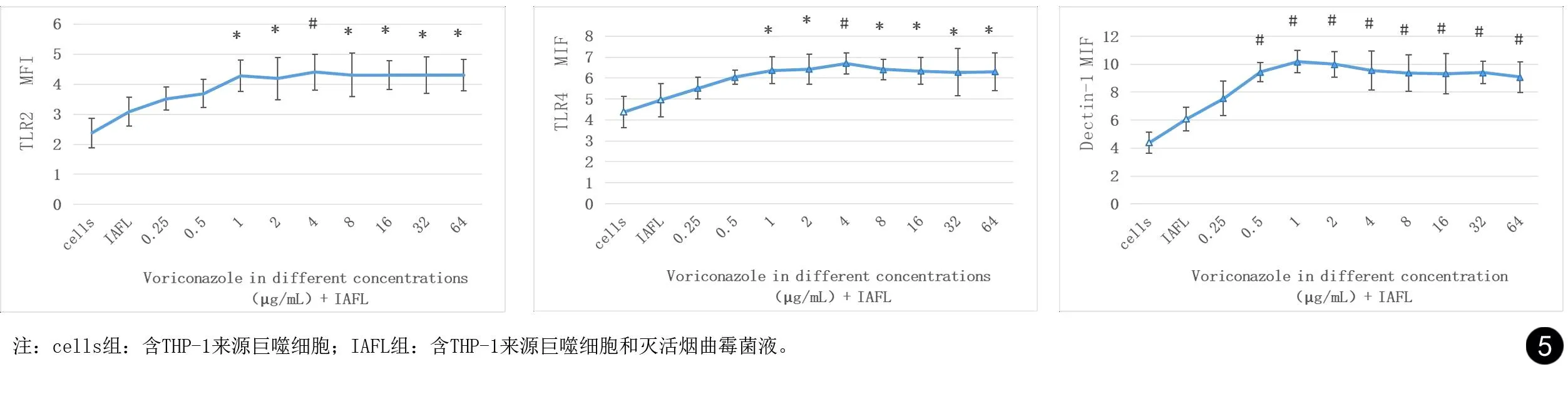
图5 不同浓度伏立康唑联合灭活烟曲霉菌液刺激THP-1来源巨噬细胞膜表面TLR2、TLR4、Dectin-1平均荧光强度。* P<0.05,# P<0.01(与IALF组相比)Fig.5 MFI of TLR2, TLR4 and Dectin-1 on the membrane surface of THP-1-derived macrophages stimulated by different concentrations of voriconazole combined with IAFL. * P <0.05, # P <0.01 (compared with IAFL group)
3 讨 论
对于曲霉感染患者而言,指南推荐长期口服抗真菌药物治疗,以防止曲霉感染的复发。侵袭性肺曲霉病指南推荐持续治疗6~12周[13],慢性肺曲霉病指南推荐至少口服治疗6个月,对于存在持续性免疫抑制的患者,则可能需要终身治疗[14]。在如此长时间里,药物对机体免疫功能的影响尤为明显。
不同组织中伏立康唑的浓度不同,伏立康唑在肺泡上皮衬液中的浓度最高,约为血浆浓度的11倍[15];脑组织中的浓度为血浆浓度的2~3倍[16];房水中的浓度仅仅为血浆浓度的0.53倍[17]。指南推荐伏立康唑血药浓度应维持在0.5~6 μg/mL,故而推测在肺泡上皮衬液中的浓度约5.5~66 μg/mL,房水中的浓度为0.25~3 μg/mL。在不同组织中,伏立康唑的浓度范围是0.25~66 μg/mL。本研究观察了浓度为0.25~64 μg/mL时伏立康唑对THP-1来源巨噬细胞免疫功能的影响。
TNF-α、IL-1β均为促炎因子,在抗曲霉感染中起重要作用[18]。本研究结果显示,加入灭活烟曲霉菌液后,THP-1来源巨噬细胞分泌TNF-α、IL-1β浓度显著升高,在灭活烟曲霉菌液存在情况下,伏立康唑的浓度为4~64 μg/mL时,刺激THP-1来源巨噬细胞分泌TNF-α、IL-1β较对照组显著升高(P<0.05),提示伏立康唑诱导THP-1来源的巨噬细胞促炎因子的分泌,但这种分泌的增加并不随伏立康唑浓度的倍增而持续递增,在伏立康唑浓度为8 μg/mL或16 μg/mL时达到峰值。
IL-10是一种有效的抗炎和免疫抑制细胞因子,能降低单核细胞和巨噬细胞活性,抑制单核细胞对曲霉菌丝的氧化爆发和抗真菌活性[19]。有研究报道,在伏立康唑作用下,暴露于曲霉的THP-1细胞IL-10的基因表达无变化[5]。本研究结果同样表明,不同浓度伏立康唑联合灭活烟曲霉菌液,对THP-1来源巨噬细胞培养上清液中IL-10浓度无显著影响(P>0.05)。
参与曲霉识别的模式识别受体主要是TLR2、TLR4和Dectin-1,其中细胞膜表面Dectin-1可以特异性识别真菌细胞壁中的β-葡聚糖[20-24]。有研究表明,伏立康唑通过上调固有免疫系统中模式识别受体TLR2 mRNA表达,增强吞噬细胞促炎程序,促进炎症因子TNF-α的分泌[3]。本研究结果表明,在灭活烟曲霉菌液存在情况下,浓度为1~64 μg/mL伏立康唑可以刺激THP-1来源巨噬细胞膜表面TLR2、TLR4和Dectin-1表达。推测伏立康唑可以通过刺激巨噬细胞膜表面模式识别受体TLR2、TLR4和Dectin-1的表达增强,促进宿主对曲霉的识别,进而杀灭曲霉。但这种表达的增强同样不随伏立康唑浓度的倍增而持续递增,在伏立康唑浓度为4 μg/mL、4 μg/mL、1 μg/mL时,TLR2、TLR4和Dectin-1的表达分别达到峰值。
出现这种情况的原因,推测与高浓度的伏立康唑对细胞的毒性作用有关。文献报道,伏立康唑浓度达100 μg/mL以上时会降低小鼠成骨细胞和成纤维细胞的生长[25]。伏立康唑浓度≥100 μg/mL时增加人角膜内皮损伤的风险。本研究结果显示,浓度64 μg/mL伏立康唑联合灭活烟曲霉菌液作用于巨噬细胞12~24 h,表现出明显的细胞抑制作用,证实高浓度伏立康唑对THP-1来源巨噬细胞具有的毒性作用。推测伏立康唑浓度高达64 μg/mL时导致THP-1来源巨噬细胞免疫活性的下降,引起炎症因子释放减少以及细胞膜表面模式识别受体表达减少。
本研究结果提示,对于需要长期口服伏立康唑治疗的曲霉病患者,适当浓度的伏立康唑可能更有利于促进患者巨噬细胞的免疫活性。宿主的免疫机制与曲霉的感染之间的关系错综复杂,涉及多种细胞及不同的作用机制,本研究仅进行了初步探讨。进一步对相关免疫细胞及其机制进行深入研究,将为临床工作提供更加有力的理论依据。

