经颅磁刺激仪的技术审评要点
吴丹 鄢峰 毛勇 罗丹
摘 要:本文基于安全性和有效性审查原则,概述了经颅磁刺激仪产品的结构组成、工作原理、预期用途,参考相关技术标准和指南文件,结合技术审评工作实际及已上市同类产品情况,对经颅磁刺激仪产品的审评要点进行讨论,重点讨论了风险分析与控制、产品性能研究、临床评价及说明书要求,以期为撰写注册申报资料和统一技术审评尺度提供指导,同时也为产品设计开发提供参考。
关键词:经颅磁刺激,审评,要点
DOI编码:10.3969/j.issn.1002-5944.2023.09.034
基金项目:本文受江西省药监局科研资助项目“经颅磁刺激仪技术审查要点”(项目编号:2022JS15)资助。
Technical Review Points of Transcranial Magnetic Stimulator
WU Dan1 YAN Feng1 MAO Yong1 LUO Dan2
(1. Jiangxi Drug Certifi cation and Evaluation Center; 2. Jiangxi Medical Device Testing Center)
Abstract: Based on the principles of safety and effectiveness review, this paper summarizes the structure, working principle and intended use of TMS products. By referring to the relevant technical standards and guidelines, technical review and similar products, it also discusses the risk analysis and control, product performance research, clinical evaluation and specifi cation requirements, in order to provide guidance for writing registration application materials and unifying the technical review scale, and provide reference for product design and development.
Keywords: TMS, review, key points
0 引 言
经颅磁刺激是一种非侵入式脑刺激技术[1],具有无创伤、痛感低、容易穿透颅骨等优势[2-3],已在临床得到广泛运用,例如,预期用于脑卒中[4]、睡眠障碍[5]、帕金森[6]、癫痫[7]等疾病的辅助治疗。经颅磁刺激仪按医疗器械管理,经颅磁刺激仪的技术审评是对产品设计开发过程形成的证明安全性和临床性能符合性的验证、技术文档进行系统分析,综合评价风险与受益比的过程,从而得出产品是否满足上市条件的技术审查结论。本文从当前科学认知水平和监管法规要求出发,基于安全性和有效性审查原则,对经颅磁刺激仪产品进行概述,参考相关技术标准和指南文件,结合技术审评工作实际及已上市同类产品情况,对经颅磁刺激仪产品的审评关注点进行讨论,以期为撰写经颅磁刺激仪产品的注册申报资料和统一技术审评尺度提供指导,同时也为产品设计开发提供参考。
1 经颅磁刺激仪产品概述
经颅磁刺激仪产品是利用高压储能电容对磁场线圈进行瞬间放电产生脉冲磁场作用于神经系统产生刺激的医疗设备[8]。经颅磁刺激仪产品在《医疗器械分类目录》[9]中编码为09-05-01,属于动磁场治疗设备。根据预期用途不同分别属于三类或二类医疗器械,本文针对二类经颅磁刺激仪产品进行研究。
1.1 结构组成
经颅磁刺激仪按结构型式不同分为台式和推车式。主要由主机(电源模块、控制系統、升压模块、散热模块)、电感线圈、软件、选配件(如推车、定位装置、线圈支架、动作电位模块等)组成。线圈的结构决定了感应磁场的分布和特点,线圈的刺激深度和聚焦性能影响刺激靶点位置的确定[10]。临床较为常用的是圆形和8字形线圈[11]。
1.2 工作原理
经颅磁刺激设备采用基于电磁感应与电磁转换原理的磁刺激技术,主要包括脉冲充电电路、脉冲放电电路及控制电路[12]。脉冲放电电路主要由储能电容、可控开关和磁刺激线圈组成。磁刺激前,电容充电到初始电压;磁刺激时,选通可控开关使其导通,电容快速放电,产生电流脉冲;电流脉冲使磁刺激线圈产生强大的脉冲磁场,并可以通过控制开关器件的通断顺序实现脉冲波的波形变化,从而达到不同的刺激效果[13]。
1.3 预期用途
经颅磁刺激仪产品主要用于神经性疾病、缺血性脑血管病、脑损伤性疾病等的辅助治疗[9]。统计已上市的二类经颅磁刺激仪产品信息,描述为缺血性脑血管病和脑损伤性疾病的产品占比29%,其他占比情况为:神经功能的检测及评定与改善20%、神经损伤性疾病19%、失眠12.8%、神经衰弱8.5%、脑卒中(中风)6.4%、心境低落4.3%。
2 经颅磁刺激仪产品技术审评要点
2.1 风险分析与控制
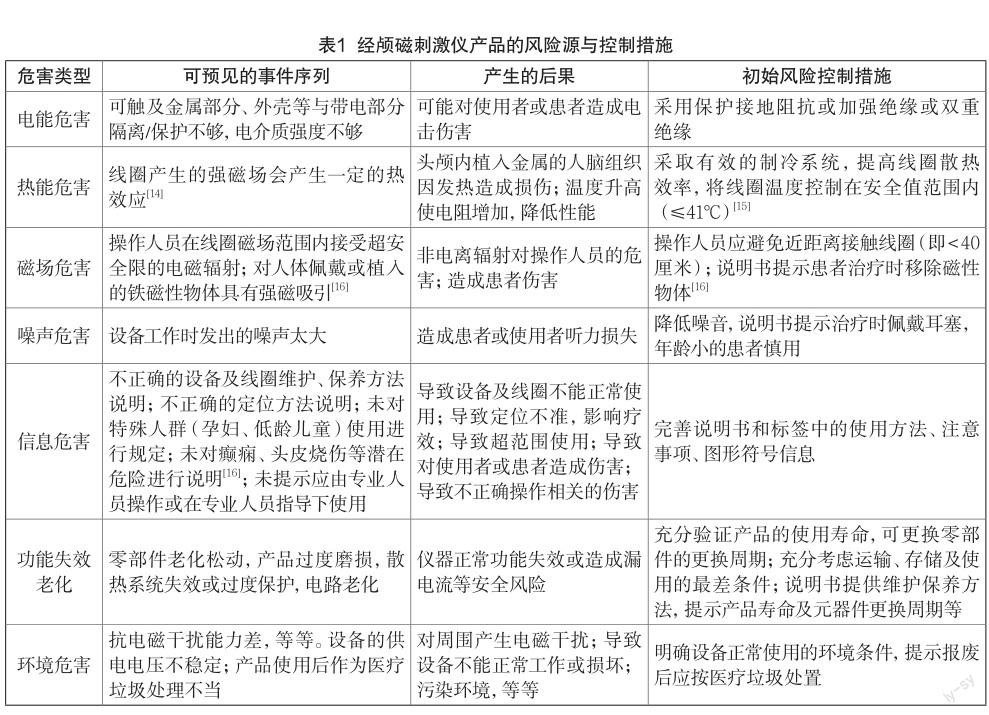
产品的安全性和有效性应满足风险大于受益的原则。表1简要分析了经颅磁刺激仪产品的风险来源,并提出了有关措施建议。
2.2 产品性能研究
经颅磁刺激仪产品应符合强制性标准要求,并推荐采纳非强制性标准[17]。电气安全应符合GB 9706.1-2020《医用电气设备第1部分:基本安全和基本性能通用要求》,电磁兼容应符合YY 9706.102-2021《医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容 要求和试验》要求。产品的物理性能指标主要参考YY/T 0994-2015《磁刺激设备》,至少包括外观(无机械制造缺陷、标记清晰等)、最大磁感应强度及允差、输出脉冲频率及允差、脉冲宽度及允差、磁场输出定时功能、刺激时间精度、冷却系统、充电电容寿命、安全保护装置。还应考虑线圈尺寸、线圈散热性能。软件性能指标主要参考《医疗器械软件注册审查指导原则》制定[18]。同时应对选配件性能进行研究,例如应制定运动诱发电位监测模块要求(如采样频率范围、采样通道数)、定位装置的性能要求(如定位精度)。感应电场聚焦性、感应电场对大脑的刺激强度、感应电场穿透深度、刺激定位精度及电场分布情况影响产品临床性能[19-20],建议提供相关性能研究资料。
2.3 临床评价
由申请人实施的临床评价用于论证产品的安全及临床性能符合性[21]。临床评价通过对不同来源的临床数据进行质量评价和系统分析形成证明上述符合性的临床证据。进行临床评价首先应准确识别产品的安全特征及临床特性,从而有针对性地搜集临床数据和进行分析评价,如现有数据不足以满足符合性评价要求,应通过临床试验等方式产生新的临床数据。经颅磁刺激仪临床评价应围绕宣称的适用范围开展,对相关临床数据进行系统、全面、客观分析。同时,应对说明书、标签等随机文件所宣称信息的合理性进行确认。
采用同品种临床数据评价,应充分证明申报的经颅磁刺激仪与对比产品的适用范围(包括适应症、适用人群、适用部位、与人体接触方式和时间、适用的疾病的阶段和程度等)相同,技术特征(工作原理、作用机理、关键元器件、软件、主要性能、材料、能源、线圈)和生物学特性(经颅磁刺激仪产品如有与人体接触部件适用)相同或广泛相似。可以选择一个或多个对比产品完成评价。搜集的临床评价数据应涵盖安全性数据,安全性数据应当包含不良反应及严重不良事件发生率,如紧张性头痛、癫痫发作、听力损伤、导致患者或操作者损伤的器械故障等。当现有的研究证据不足时,可进行临床试验获得新的评价数据。开展临床试验应明确研究目的,研究目的决定临床试验各设计要素(主要疗效评价指标、试验设计类型、对照试验的比较类型等),进而影响临床试验样本量。
2.4 说明书要求
经颅磁刺激仪产品说明书除应满足法规和强制性标准的规定以外,结合产品的特征,参考国际临床神经生理学联盟的经颅磁刺激安全指南[16]及中国专家共识[22-23],说明书一般还应至少包括:(1)该产品禁忌症:距离患者治疗部位30 cm范围内如有金属异物(口腔除外)和电子设备,禁止进行经颅磁刺激治疗;(2)慎用人群:例如孕妇、儿童、有严重心脏病或近期有心脏病发作的患者、正在服用可能降低癫痫发作阈值药物的患者、睡眠剥夺人群、酒精依赖人群等;(3)以下情况应仔细权衡利弊:如多个身体部位、连续长时间、成对脉冲刺激模式,刺激参数超出推荐范围,患者无法忍受停用抗抑郁药物治疗,曾经或同时运用电刺激疗法等;(4)为避免听力损伤,治疗室内所有人员应进行防护,如佩戴耳塞;(5)避免癫痫发作的刺激参数设置;(6)首次治疗:应进行风险评估并签署知情同意书,应测定患者大脑皮层运动阈值来确定刺激强度;(7)治疗前:提示从患者身上移除受磁场影响的物体及如无法移除應充分评估风险;(8)治疗过程:应监测不良反应并进行评估,如遇癫痫发作、意外抽搐、丧失意识等紧急情况应能够立即终止磁刺激,并配置急救设施和人员;(9)明确治疗靶点的定位方法。
3 结 论
经颅磁刺激仪按医疗器械管理,需要采取科学的评价方式,确保产品上市后能达到预期性能并将风险降至最低。本文从风险分析与控制、产品性能研究、临床评价研究、说明书要求四个方面对经颅刺激设备的技术审评要点进行探讨,以期为该产品注册提供指导。本文不包括产品安全性和有效性评价的全部要求,需要结合被审评产品的技术特征和预期使用目的进行综合评价。
参考文献
[1]陈庆梅,蔡秀英,潘习,等.重复经颅磁刺激治疗急性脑卒中后上肢运动功能障碍的研究进展[J].中国康复医学杂志,2022,37(10),1415-1420.
[2]王曈,董凌辉,孟萍萍,等.重复经颅磁刺激治疗卒中后吞咽困难的相关临床研究进展[J].中华物理医学与康复杂志,2022,44(10),931-934.
[3]MEHTA U M,NAIK S S, THANKI M V, THIRTHALLI J. . Investigational and Therapeutic Applications of Transcranial Magnetic Stimulation in Schizophrenia[J]. Current psychiatry reports,2019,21(9):124-129.
[4]MANTELL K E , SUTTER E N , SHIRINPOUR S, et al.Evaluating transcranial magnetic stimulation (TMS) induced electric fields in pediatric stroke[J]. Neuroimage Clin,2021,29:102563.
[5]NARDONE R, SEBASTIANELLI L, VERSACE V, et al. Effects of repetitive transcranial magnetic stimulation in subjects with sleep disorders[J]. Sleep Med, 2020 Jul;71:113-121.
[6]NARDONE R, VERSACE V, BRIGO F,et al.Transcranial magnetic stimulation and gait disturbances in Parkinsons disease: A systematic review[J]. Neurophysiol Clin, 2020 Jul;50(3):213-225.
[7]TSUBOYAMA M , KAYE H L, ROTENBERG A. Review of Transcranial Magnetic Stimulation in Epilepsy[J]. Clin Ther,2020 Jul;42(7):1155-1168.
[8]原国家食品药品监督管理总局.磁刺激设备:YY/T 0994-2015[S].北京:中国标准出版社,2015,3.
[9]原国家食品药品监督管理总局.医疗器械分类目录[EB/OL].( 2017-09-04)[2022-11-09].https://www.nmpa.gov.cn/xxgk/ggtg/ qtggtg/20170904150301406.html.
[10]熊慧,景昭,刘近贞.新型经颅磁刺激三层-8字形线圈的结构设计[J].浙江大学学报(工学版),2021,55(4):793-800.
[11]尧利书,孙聪,葛康.经颅磁刺激定位技术的研究进展[J].中国医疗设备,2022,37(2):159-163+171.
[12]方晓.经颅磁刺激系统关键技术研究[D].武汉:华中科技大学, 2022.
[13]李元晧.TMS电源系统的设计与优化[D].武汉:华中科技大学,2020.
[14]陈卓,强李林,祖慧鹏.医用高强度磁场的磁场线圈散热结构设计[J]. 医疗装备,2022,35(20):21-24.
[15]国家市场监督管理总局,国家标准化管理委员会.医用电气设备第1部分:基本安全和基本性能通用要求:GB9706.1-2020[S].北京:中国标准出版社,2020.
[16]ROSSI S, ANTAL A, BESTMANN S,et al. Safety and recommendations for TMS use in healthy subjects and patient populations, with updates on training, ethical and regulatory issues: Expert Guidelines[J]. Clin Neurophysi ol,2021,132(1):269-306.
[17]国家市场监督管理总局.医疗器械注册与备案管理办法[EB/ OL].( 2021-08-26)[2022-11-09].https://gkml.samr.gov.cn/nsjg/ fgs/202108/t20210831_334228.html.
[18]国家药品监督管理局医疗器械技术审评中心.医疗器械软件注册审查指导原则(2022年修订版) [EB/OL]. (2022-03-09)[2022-11-09].https://www.cmde.org.cn/flfg/zdyz/ zdyzwbk/20220309091706965.html.
[19]夏思萍,徐雅洁,余颖聪.经颅磁刺激电场分析研究进展[J].中国生物医学工程学报,2020,39(6):727-735.
[20]熊慧,景昭,刘近贞.经颅磁刺激系统的研究进展[J].航天医学与医学工程,2020,33(6):556-564.
[21]国家药品监督管理局.医疗器械临床评价技术指导原则[EB/ OL]. (2021-09-28)[2022-11-09]. https://www.nmpa.gov.cn/ylqx/ ylqxggtg/20210928170338138.html.
[22]許毅,李达,谭立文.重复经颅磁刺激治疗专家共识[J].转化医学杂志,2018,7(1),4-9.
[23]董心,郑洁皎,许光旭.《经颅磁刺激操作指南》团体标准解读[J].中国标准化,2021(14):89-93.
作者简介
吴丹,硕士,高级工程师,研究方向为医疗器械安全性和有效性评价。
鄢峰,本科,主管医师,研究方向为医疗器械安全性和有效性评价。
毛勇,硕士,工程师,研究方向为医疗器械安全性和有效性评价。罗丹,硕士,高级工程师,研究方向为医疗器械检验检测。
(责任编辑:袁文静)

